2. 海军军医大学(第二军医大学)纳米医学研究室, 上海细胞工程重点实验室, 上海 200433;
3. 同济大学附属上海市第四人民医院超声医学科, 上海 200434
2. Department of Nanomedicine & Shanghai Key Laboratory of Cell Engineering, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Ultrasound, Shanghai Fourth People's Hospital Affiliated to Tongji University, Shanghai 200434, China
超声成像因具有非侵入性、可便捷性、高安全性等优势被广泛应用于临床,已逐渐成为多种疾病首选的辅助诊断方式[1]。超声造影可在2D超声成像的基础上实时动态地观察组织血流灌注及微循环情况,被广泛应用于腹部、浅表器官、心血管系统及实质脏器损伤的诊断,并在良恶性肿瘤的鉴别及介入消融术的监测和疗效评估等方面表现出应用价值。
近年来,纳米材料和技术的发展给传统医学带来革命性发展,纳米技术为诸多传统疾病的诊疗方法提供了新的选择。传统的超声造影剂在自身微米级粒径的限制下,仅能在血管池内显像,对血管外病变的识别有一定的局限性;而基于纳米体系的靶向超声造影剂具有生物安全性、粒子尺寸可控性和血循环稳定性等优势[2],且可以穿透新生血管,并借助于其表面连接的各种靶向配体,成为辅助疾病诊断与治疗的新兴研究热点。相关研究在不同领域实现了分子影像学、化学、物理学、生物学等多个学科的紧密融合,促进了许多新兴成像剂和成像技术的发展[3]。然而有关肌肉骨骼关节(以下简称肌骨关节)纳米超声造影成像的报道少见。随着高分辨率超声检查在肌骨关节疾病诊断中的应用日趋成熟,肌骨超声亚专科已初步形成[4],但彩色多普勒血流成像识别病损区域内微循环灌注的灵敏性和特异性有待提高,同时其对肌骨关节功能信息的评估亦存在一定的局限性。超声造影已被证实可相对无创地对肌骨关节组织的微循环灌注进行实时动态评估,可反映组织的活性和代谢能力[5]。将纳米级超声造影剂应用于肌骨关节疾病的精准靶向量化评估或诊疗可能是一个新的契机。本文就纳米级超声造影剂的研究进展及其在肌骨关节疾病中的应用现状进行综述。
1 纳米级超声造影剂的研究进展 1.1 纳米级超声造影剂的体系设计与超声成像特点超声造影始于20世纪60年代末,Gramiak和Shah[6]首次经导管注射震荡后的吲哚菁绿和生理盐水混合液体,并将其应用于超声心动图检查,由此发现了超声图像信号的增强,这一发现拉开了超声造影剂研究和临床应用的序幕。经过不断的迭代更新,目前临床常规应用的超声造影剂[如注射用六氟化硫微泡(商品名为声诺维)、注射用全氟丁烷微球(商品名为示卓安)等]主要成分为微米级气泡,易停留于血液系统却不易穿过血管内皮组织间隙,常规用于肝脏等实质性器官血流灌注的评价。
目前,2种主流的纳米级超声造影剂主要以纳米级气泡和纳米级液滴为核心载体。相较于传统超声造影剂,纳米级超声造影剂在提高对比度的同时,实现了血管外成像的可能[7]。纳米级超声造影剂能够显著增强背向散射信号,因而具有良好的信噪比。得益于纳米材料的组织增强渗透和滞留效应,纳米级超声造影剂能实现被动富集,因而能产生更为明显的超声增强显影效果[8]。纳米级超声造影剂表面结合特异性靶向分子(如配体)是实现造影剂特异性富集的另一有效手段,通过体内配体与病灶部位细胞表面的受体选择性结合,使造影剂到达特定部位形成增强显影,从分子成像层面进一步提高了超声诊断能力[9]。如图 1所示,由于粒径小、穿透力强、特异性高,纳米级超声造影剂可以直接从脉管系统外渗到组织间隙或细胞表面并通过组织增强渗透和滞留效应而被动富集保留,能更容易、准确地主动靶向定位到病变区域的某些生物标志分子上。研究表明,纳米级超声造影剂在有肾脏疾病或健康状况较差的患者中安全性较高,未增加不良反应的发生率[10]。因此,针对肌骨关节疾病建立安全、有效的纳米研究平台,不仅可推动纳米级超声造影剂的进一步发展和临床转化,还有助于实现肌骨关节疾病的无侵入性诊断。
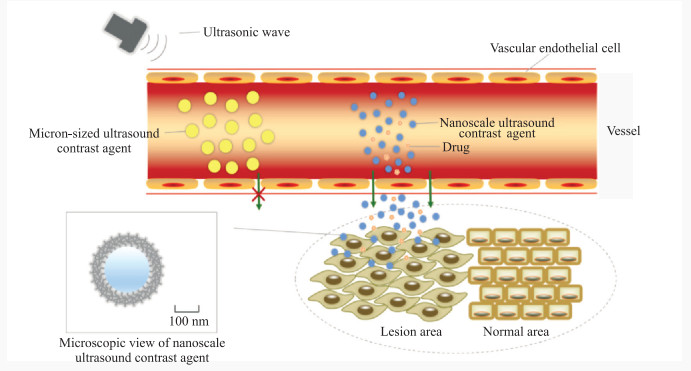
|
图 1 纳米级超声造影剂的作用示意图 Fig 1 Schematic diagram of nanoscale ultrasound contrast agent |
1.2 纳米级超声造影剂与新型生物诊疗
纳米材料及纳米技术的应用克服了大粒径超声造影剂的固有缺陷,不仅实现了长时程的干细胞超声实时追踪成像,而且为药物释放和基因治疗的可视化提供了技术支持,在新型生物诊疗领域焕发出新的生机。Chen等[11]报道了一种新型的可用于干细胞成像的纳米级超声造影剂,这种外泌体样的纳米颗粒实现了体内外的实时细胞跟踪及成像。Liu等[12]也成功制备了一种高效、灵敏且安全的纳米级脂质体气泡,实现了骨髓间充质干细胞的体外标记和体内实时超声成像。由此可见,纳米级超声造影剂能够实现基于纳米技术的无创活体分子影像示踪。
如图 2所示,纳米载体材料和体系能够负载具有治疗效果的小分子或大分子药物或基因,其进入体内后通过超声靶向微泡破坏技术激发气泡破裂,提高了组织和细胞膜的渗透性,克服了血脑屏障、致密结缔组织等坚固的生物屏障,在发挥超声造影显像作用的同时释放治疗性药物分子或基因至靶器官进行疾病治疗,从而达到疾病的高效、安全诊断和疗效监测的目的[13-14]。Ji等[15]开发了一种集超声造影剂和药物递送载体特性于一体的新型多功能纳米级液滴,并将姜黄素包裹在纳米级液滴中,最终发现具备超声响应性的纳米级液滴高度增强了姜黄素的抗癌效果。Song等[16]将神经营养因子负载至脂质体纳米泡中,在大鼠的脊髓损伤区域进行基因转染处理,结果表明由超声介导的脂质体纳米泡的破坏能有效地将神经营养因子基因转染至靶组织,在增加神经营养因子表达的同时减轻了组织学损伤,对损伤脊髓有显著疗效。除了作为载体进行基因转染外,超声靶向微泡破坏介导的纳米级气泡还可将基因沉默因子递送至肿瘤,已有研究人员开展了体内肿瘤模型的相关研究[17]。因此,纳米级超声造影剂有望作为一个精准且高效递送药物和基因的平台,其临床应用前景广阔。
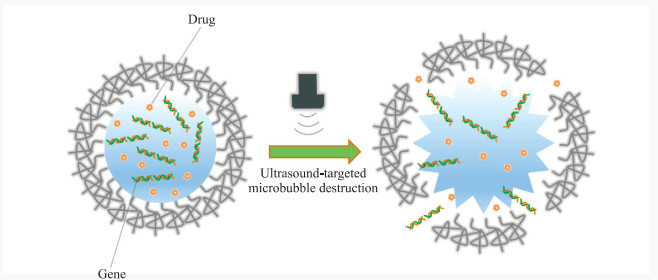
|
图 2 基于超声靶向微泡破坏技术的纳米递送载体 Fig 2 Nano-delivery carrier based on ultrasound-targeted microbubble destruction |
2 纳米级超声造影剂在肌骨关节疾病诊断与治疗中的应用
肌骨关节多位于人体浅表部位,且血供丰富,在日常活动中很容易受到损伤,相关的损伤或疾病在临床上颇为常见。在各种影像学检查方式中,MRI对肌肉等软组织的成像能力相对较好,但高成本和静态观察等不足限制了其实时诊断效果,而超声检查对肌肉、肌腱等软组织的疾病具有高特异性和动态成像等优势。肌骨超声能够快速动态评估骨骼肌肉成分和形态结构的变化(如肌纤维肿胀、断裂、出血及纤维化、钙化等)。随着超声医学和纳米医学的融合发展,纳米级超声造影剂的应用逐步拓展了肌骨关节疾病的超声诊疗研究。这种新型的纳米医学技术与肌骨关节系统的超声造影技术交叉融合,将有望为此类疾病的诊断、治疗及随访提供更加可靠和富有临床价值的分子影像依据。
2.1 肌肉与肌腱损伤肌肉和肌腱损伤是较为常见的肌肉骨骼疾病。虽然超声造影检查应用于肌骨关节的研究起步较晚,但相关研究表明超声造影极可能成为监测肌肉受累程度、再生过程进展甚至抗炎治疗效果的有效工具[18]。超声造影定量评估微循环血流灌注情况能够反映肌骨关节的功能特性[19],可作为组织活力和新陈代谢的替代参数。
肌肉与肌腱损伤的炎症变化以活性氧的产生为主要特点,Kim等[20-21]以过氧化氢为生物标志物,探究了2种纳米颗粒作为肌骨关节损伤诊疗一体化工具的可行性。肌肉和肌腱损伤时组织内过氧化氢水平显著升高,纳米颗粒可与损伤部位过氧化氢快速反应产生二氧化碳气泡,提高该部位的超声成像对比度。同时,纳米颗粒还可以通过抑制促炎细胞因子的表达和炎症细胞的浸润发挥治疗作用,动物实验证明其具有良好的超声成像能力及抗炎和抗凋亡效果。与之类似的是,骨骼肌缺血再灌注损伤导致的微循环障碍一直被认为是糖尿病微血管病变等外周血管疾病的重要发病机制,主要原因是肌肉短时间缺血后恢复血液灌注引起剧烈的炎症反应并产生高水平过氧化氢[18]。Lee等[22]报道了一种基于过氧化氢可激活的多功能纳米颗粒,研究者利用小鼠后肢缺血再灌注损伤模型在活体内对过氧化氢进行成像,同时将其作为给药载体进行体内抗氧化和抗炎治疗,初步显示临床应用潜力。Jung等[23]利用载姜黄素纳米颗粒评估小鼠缺血性损伤模型的炎症反应强度与治疗效果,结果表明载姜黄素纳米颗粒比空白对照组表现出更强的抗氧化能力和抗炎活性。另外,基于纳米级超声造影剂的超声造影不仅能识别早期肌骨关节损伤,还有望用于监测肌骨关节修复术后的血运重建,从而有利于患者的术后康复治疗[24]。
2.2 关节炎性疾病类风湿关节炎和骨关节炎是2类主要的慢性非创伤性关节炎,病情控制不佳往往会因持续性炎症而导致关节软骨破坏和骨侵蚀直至功能丧失[25],因此早期诊断和有效控制疾病活动至关重要。与血清学检查相比,肌骨超声被证实可有效评估关节炎症的活动度,能达到早期诊断和改善预后的目的[26]。尤其在小儿炎症性关节疾病中,超声造影对于疾病的初步诊断、疗效监测及术后关节灌注状态的评估是有益的[27]。
Zhao等[28]将类风湿关节炎的炎性生物标志物锁定于血管内皮生长因子,通过超声微泡靶向成像实现了滑膜血管炎性病变的早期诊断和准确评估。该研究所制备的气泡虽初步具备了声学及光学的双模态成像能力,但是气泡的粒径还处于亚微米级,纳米级气泡有待于进一步开发。然而更多学者将研究方向聚焦于治疗层面,Tang等[29]报道了可有效携载吲哚菁绿和O2的多功能纳米颗粒,吲哚菁绿介导的声动力效应可以对滑膜成纤维细胞产生显著的细胞毒性效应。梁竹西等[30]成功合成了一种多功能的诊疗一体化的分子影像探针,运用光动力疗法杀伤类风湿关节炎体外模型中的滑膜细胞,不仅能够实现无侵入性地监测早期病变中成纤维样滑膜细胞的增殖情况,而且能够实现同步化的光动力治疗。Wu等[31]将超声药物控释治疗与磷脂类纳米级载体药物递送系统结合,构建了iGRD多肽(一种具有靶向肿瘤新生血管和肿瘤细胞双重靶向能力的环肽)介导的载氨甲蝶呤及吲哚菁绿靶向声学脂质体多功能纳米颗粒,借助近红外荧光成像,以低频、低强度的超声定点控释氨甲蝶呤,实现了靶向治疗过程的可视化。Chen等[32]开发了一种基于黑色素纳米粒的靶向光声造影剂,通过分析阳离子纳米颗粒靶向骨关节炎关节软骨中糖胺聚糖含量的变化提供了软骨退变的准确信息,能有效区分骨关节炎早期和晚期的软骨退变情况,还可在药物治疗后持续跟踪患者预后。这些研究成果为靶向治疗炎症性关节疾病奠定了坚实基础。
2.3 组织工程与再生修复组织工程与再生医学是生物医学研究的前沿领域。骨的再生修复是一个涉及多因素的复杂过程,是成骨细胞、骨诱导刺激剂和骨传导支架相互作用的结果,而功能性血管网络则被认为是肌骨关节组织工程临床应用中的一个重大挑战[33]。新材料、纳米技术、基因工程、细胞治疗及干细胞技术的引入使肌骨关节的再生修复迈上了新台阶。
已有研究者对超声造影在组织再生修复中的应用进行了探索[34]。超声造影可以在病变早期实时监测修复愈合过程中肌骨组织内的血运重建情况,而彩色多普勒超声或能量多普勒超声很难实现[35]。Gong等[36]制备了一种负载血管内皮生长因子的脂质体微泡,通过在大鼠骨缺损模型中验证发现,于局部骨缺损区域靶向释放包裹的血管内皮生长因子在体外能够显著促进成骨表达,在体内能够促进骨的再生修复。在超声微泡的基础上,王宇等[37]结合纳米生物技术,制备了一种新型生物合成纳米级气泡,该气泡具有良好的超声显影能力,将其作为重组人骨形态发生蛋白基因的载体可高效转染骨髓间充质干细胞,诱导成骨分化。Nam等[38]在动物肌肉内注射纳米金示踪剂标记骨髓间充质干细胞,采用超声和光声双模式纵向追踪细胞并检测由其促进的新生血管生成的生物学行为,结果显示该方法不仅可对干细胞的生物学行为进行灵敏、无创地定量评估,也有助于观察新生血管的形成和伤口愈合过程。骨髓间充质干细胞一直是组织工程中的研究热点,干细胞的可视化研究有助于推动骨再生修复中骨髓间充质干细胞疗法的临床转化。由此可见,基于纳米级超声造影剂的超声造影可能是组织工程中可视化跟踪体内干细胞及监测重塑组织血运功能的有效方法。
虽然目前纳米级超声造影剂在组织工程应用中的研究不多,但是医工结合的新型超声造影剂有望为组织工程与再生医学开启新的篇章。
3 小结和展望随着肌骨关节超声的不断发展和深入研究,其已成为肌骨关节疾病诊断与治疗的一种快速、安全且经济的选择。超声造影突破了传统超声成像方式的形态学局限,在肌骨关节疾病中能够获得深、浅组织和微循环血流动力学的流场特性信息。纳米技术的引入,推动了新一代诊疗一体化多功能分子造影剂的发展,与荧光成像和光声成像等多种模式结合更有助于提高活体成像的对比度和分辨率,还实现了医学成像引导下的可视化诊疗。此外,具有多种成像方式优势互补的多模态纳米级超声造影展示出广阔的应用前景。
目前,大多数造影剂仍处于基础研究或临床前阶段,纳米载体也缺乏大样本的生物安全性评价研究,在人体内的预期成像及功能治疗还有待进一步验证。探讨并完善超声纳米医学新技术及其生物安全性问题,将有助于加速纳米级超声造影剂的临床转化。人工智能技术的兴起,肌骨关节损伤的超声诊断已拓展至人工智能领域[39-40],也促使肌骨关节疾病的超声诊疗迈入新阶段。未来如能实现新型的多模态纳米级超声造影与人工智能技术的医工融合,必将进一步拓展纳米级超声造影剂在肌骨关节疾病诊疗中的应用前景和实用价值。
| [1] |
NIELSEN M B, SØGAARD S B, BECH ANDERSEN S, SKJOLDBYE B, HANSEN K L, RAFAELSEN S, et al. Highlights of the development in ultrasound during the last 70 years: a historical review[J]. Acta Radiol, 2021, 62: 1499-1514. DOI:10.1177/02841851211050859 |
| [2] |
ZHAO P X, DENG Y B, XIANG G Y, LIU Y N. Nanoparticle-assisted sonosensitizers and their biomedical applications[J]. Int J Nanomedicine, 2021, 16: 4615-4630. DOI:10.2147/IJN.S307885 |
| [3] |
XIONG R H, XU R X, HUANG C B, DE SMEDT S, BRAECKMANS K. Stimuli-responsive nanobubbles for biomedical applications[J]. Chem Soc Rev, 2021, 50: 5746-5776. DOI:10.1039/C9CS00839J |
| [4] |
MOTAMEDI D, BAUER A H, PATEL R, MORGAN T A. Problem solved: integral applications of musculoskeletal ultrasound[J]. J Ultrasound Med, 2021, 40: 1693-1704. DOI:10.1002/jum.15551 |
| [5] |
HOTFIEL T, HEISS R, SWOBODA B, KELLERMANN M, GELSE K, GRIM C, et al. Contrast-enhanced ultrasound as a new investigative tool in diagnostic imaging of muscle injuries—a pilot study evaluating conventional ultrasound, CEUS, and findings in MRI[J]. Clin J Sport Med, 2018, 28: 332-338. DOI:10.1097/JSM.0000000000000470 |
| [6] |
GRAMIAK R, SHAH P M. Echocardiography of the aortic root[J]. Invest Radiol, 1968, 3: 356-366. DOI:10.1097/00004424-196809000-00011 |
| [7] |
CAI W B, YANG H L, ZHANG J, YIN J K, YANG Y L, YUAN L J, et al. The optimized fabrication of nanobubbles as ultrasound contrast agents for tumor imaging[J/OL]. Sci Rep, 2015, 5: 13725. DOI: 10.1038/srep13725.
|
| [8] |
TANG H L, ZHENG Y Y, CHEN Y. Materials chemistry of nanoultrasonic biomedicine[J/OL]. Adv Mater, 2017, 29: 1604105. DOI: 10.1002/adma.201604105.
|
| [9] |
ZLITNI A, GAMBHIR S S. Molecular imaging agents for ultrasound[J]. Curr Opin Chem Biol, 2018, 45: 113-120. DOI:10.1016/j.cbpa.2018.03.017 |
| [10] |
PAEFGEN V, DOLESCHEL D, KIESSLING F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery[J/OL]. Front Pharmacol, 2015, 6: 197. DOI: 10.3389/fphar.2015.00197.
|
| [11] |
CHEN F, MA M, WANG J X, WANG F, CHERN S X, ZHAO E R, et al. Exosome-like silica nanoparticles: a novel ultrasound contrast agent for stem cell imaging[J]. Nanoscale, 2017, 9: 402-411. DOI:10.1039/C6NR08177K |
| [12] |
LIU H M, LIU S, LIANG Y B, DENG Z T, WANG Y, YAN F. Real-time imaging tracking of mesenchymal stem cells labeled with lipid-poly(lactic-co-glycolic acid) nanobubbles[J]. J Biomed Nanotechnol, 2019, 15: 2271-2280. DOI:10.1166/jbn.2019.2852 |
| [13] |
CHEN D, ZHU X F, TAO W R, KONG Y, HUAG Y, ZHANG Y J, et al. Regulation of pancreatic cancer microenvironment by an intelligent gemcitabine@nanogel system via in vitro 3D model for promoting therapeutic efficiency[J]. J Control Release, 2020, 324: 545-559. DOI:10.1016/j.jconrel.2020.06.001 |
| [14] |
ZHANG F L, HOU Y, ZHU M H, DENG B, ZHAO M X, ZHU X D, et al. Death pathways of cancer cells modulated by surface molecule density on gold nanorods[J/OL]. Adv Sci (Weinh), 2021, 8: e2102666. DOI: 10.1002/advs.202102666.
|
| [15] |
JI G J, YANG J H, CHEN J H. Preparation of novel curcumin-loaded multifunctional nanodroplets for combining ultrasonic development and targeted chemotherapy[J]. Int J Pharm, 2014, 466(1/2): 314-320. |
| [16] |
SONG Z J, WANG Z G, SHEN J L, XU S X, HU Z M. Nerve growth factor delivery by ultrasound-mediated nanobubble destruction as a treatment for acute spinal cord injury in rats[J]. Int J Nanomedicine, 2017, 12: 1717-1729. DOI:10.2147/IJN.S128848 |
| [17] |
XIE X Y, YANG Y F, LIN W, LIU H, LIU H, YANG Y, et al. Cell-penetrating peptide-siRNA conjugate loaded YSA-modified nanobubbles for ultrasound triggered siRNA delivery[J]. Colloids Surf B Biointerfaces, 2015, 136: 641-650. DOI:10.1016/j.colsurfb.2015.10.004 |
| [18] |
KASPAR M, PARTOVI S, ASCHWANDEN M, IMFELD S, BALDI T, UTHOFF H, et al. Assessment of microcirculation by contrast-enhanced ultrasound: a new approach in vascular medicine[J/OL]. Swiss Med Wkly, 2015, 145: w14047. DOI: 10.4414/smw.2015.14047.
|
| [19] |
LIN H C, WANG S H. Window-modulated compounding Nakagami parameter ratio approach for assessing muscle perfusion with contrast-enhanced ultrasound imaging[J/OL]. Sensors (Basel), 2020, 20: 3584. DOI: 10.3390/s20123584.
|
| [20] |
KIM G W, KANG C S, OH Y B, KO M H, SEO J H, LEE D. Ultrasonographic imaging and anti-inflammatory therapy of muscle and tendon injuries using polymer nanoparticles[J]. Theranostics, 2017, 7: 2463-2476. DOI:10.7150/thno.18922 |
| [21] |
KIM G W, SONG N H, PARK M R, KIM T E, KIM D S, OH Y B, et al. Diagnosis and simultaneous treatment of musculoskeletal injury using H2O2-triggered echogenic antioxidant polymer nanoparticles in a rat model of contusion injury[J/OL]. Nanomaterials (Basel), 2021, 11: 2571. DOI: 10.3390/nano11102571.
|
| [22] |
LEE D, BAE S, KE Q G, LEE J, SONG B, KARUMANCHI S A, et al. Hydrogen peroxide-responsive copolyoxalate nanoparticles for detection and therapy of ischemia-reperfusion injury[J]. J Control Release, 2013, 172: 1102-1110. DOI:10.1016/j.jconrel.2013.09.020 |
| [23] |
JUNG E, NOH J, KANG C S, YOO D, SONG C, LEE D. Ultrasound imaging and on-demand therapy of peripheral arterial diseases using H2O2-activated bubble generating anti-inflammatory polymer particles[J]. Biomaterials, 2018, 179: 175-185. DOI:10.1016/j.biomaterials.2018.07.003 |
| [24] |
KUNZ P, MICK P, GROSS S, SCHMIDMAIER G, ZEIFANG F, WEBER M A, et al. Contrast-enhanced ultrasound (CEUS) as predictor for early retear and functional outcome after supraspinatus tendon repair[J]. J Orthop Res, 2020, 38: 1150-1158. DOI:10.1002/jor.24535 |
| [25] |
PAP T, KORB-PAP A. Cartilage damage in osteoarthritis and rheumatoid arthritis: two unequal siblings[J]. Nat Rev Rheumatol, 2015, 11: 606-615. DOI:10.1038/nrrheum.2015.95 |
| [26] |
NAM S W, KANG T. A pragmatic application of ultrasonography for the assessment of disease activity in patients with early inflammatory arthritis[J/OL]. J Clin Med, 2021, 10: 283. DOI: 10.3390/jcm10020283.
|
| [27] |
NTOULIA A, BARNEWOLT C E, DORIA A S, HO-FUNG V M, LORENZ N, MENTZEL H J, et al. Contrast-enhanced ultrasound for musculoskeletal indications in children[J]. Pediatr Radiol, 2021, 51: 2303-2323. DOI:10.1007/s00247-021-04964-6 |
| [28] |
ZHAO C Y, ZHANG R, LUO Y W, LIU S R, TANG T H, YANG F, et al. Multimodal VEGF-targeted contrast-enhanced ultrasound and photoacoustic imaging of rats with inflammatory arthritis: using dye-VEGF-antibody-loaded microbubbles[J]. Ultrasound Med Biol, 2020, 46: 2400-2411. DOI:10.1016/j.ultrasmedbio.2020.05.007 |
| [29] |
TANG Q, CUI J Y, TIAN Z H, SUN J C, WANG Z G, CHANG S F, et al. Oxygen and indocyanine green loaded phase-transition nanoparticle-mediated photo-sonodynamic cytotoxic effects on rheumatoid arthritis fibroblast-like synoviocytes[J]. Int J Nanomedicine, 2017, 12: 381-393. DOI:10.2147/IJN.S120902 |
| [30] |
梁竹西, 何欣雨, 常淑芳, 王志刚, 郝兰, 李发琪, 等. 载IR-820相变型纳米粒双模态成像及其对类风湿关节炎成纤维样滑膜细胞光动力效应的体外研究[J]. 解放军医学杂志, 2021, 46: 425-431. DOI:10.11855/j.issn.0577-7402.2021.05.01 |
| [31] |
WU H H, HE Y N, WU H, ZHOU M J, XU Z L, XIONG R, et al. Near-infrared fluorescence imaging-guided focused ultrasound-mediated therapy against rheumatoid arthritis by MTX-ICG-loaded iRGD-modified echogenic liposomes[J]. Theranostics, 2020, 10: 10092-10105. DOI:10.7150/thno.44865 |
| [32] |
CHEN L, JI Y, HU X M, CUI C, LIU H, TANG Y F, et al. Cationic poly-l-lysine-encapsulated melanin nanoparticles as efficient photoacoustic agents targeting to glycosaminoglycans for the early diagnosis of articular cartilage degeneration in osteoarthritis[J]. Nanoscale, 2018, 10: 13471-13484. DOI:10.1039/C8NR03791D |
| [33] |
GILBERT-HONICK J, GRAYSON W. Vascularized and innervated skeletal muscle tissue engineering[J/OL]. Adv Healthc Mater, 2020, 9: e1900626. DOI: 10.1002/adhm.201900626.
|
| [34] |
JIN L, LI P, WANG Y C, FENG L, XU R, YANG D B, et al. Studies of superb microvascular imaging and contrast-enhanced ultrasonography in the evaluation of vascularization in early bone regeneration[J]. J Ultrasound Med, 2019, 38: 2963-2971. DOI:10.1002/jum.15002 |
| [35] |
POZZA S, DE MARCHI A, ALBERTIN C, ALBANO D, BⅡNO G, ALOJ D, et al. Technical and clinical feasibility of contrast-enhanced ultrasound evaluation of long bone non-infected nonunion healing[J]. Radiol Med, 2018, 123: 703-709. DOI:10.1007/s11547-018-0902-7 |
| [36] |
GONG Y, LI S J, ZENG W, YU J N, CHEN Y, YU B. Controlled in vivo bone formation and vascularization using ultrasound-triggered release of recombinant vascular endothelial growth factor from poly(D, L-lactic-co-glycolicacid) microbubbles[J/OL]. Front Pharmacol, 2019, 10: 413. DOI: 10.3389/fphar.2019.00413.
|
| [37] |
王宇. 超声介导生物合成纳泡-干细胞复合体可视化转染rhBMP-2促进骨修复的初步研究[D]. 广州: 南方医科大学, 2020.
|
| [38] |
NAM S Y, RICLES L M, SUGGS L J, EMELIANOV S Y. In vivo ultrasound and photoacoustic monitoring of mesenchymal stem cells labeled with gold nanotracers[J/OL]. PLoS One, 2012, 7: e37267. DOI: 10.1371/journal.pone.0037267.
|
| [39] |
赵佳琦, 徐琪, 章建全, 黄禾菁, 刁宗平. 骨骼肌超声诊断迈向人工智能新领域: 计算机辅助骨骼肌损伤超声定量诊断[J]. 第二军医大学学报, 2017, 38: 1217-1224. ZHAO J Q, XU Q, ZHANG J Q, HUANG H J, DIAO Z P. Ultrasound diagnosis of skeletal muscle promoted by artificial intelligence: a quantitative evaluation of injured skeletal muscle by computer-aided ultrasonographic texture analysis[J]. Acad J Sec Mil Med Univ, 2017, 38: 1217-1224. |
| [40] |
赵佳琦, 徐琪, 潘倩, 章建全, 黄禾菁. 计算机辅助定量分析不同功率微波消融致兔骨骼肌急性损伤修复过程中的超声纹理特征[J]. 第二军医大学学报, 2020, 41: 991-997. ZHAO J Q, XU Q, PAN Q, ZHANG J Q, HUANG H J. Computer-aided quantitative analysis of ultrasonic texture characteristics during repair process of rabbit skeletal muscle acute injury caused by microwave ablation of different powers[J]. Acad J Sec Mil Med Univ, 2020, 41: 991-997. |
 2023, Vol. 44
2023, Vol. 44


