2. 海军军医大学(第二军医大学)第一附属医院肛肠外科, 上海 200433;
3. 海军军医大学(第二军医大学)基础医学院学员队, 上海 200433
2. Department of Anus and Intestine Surgery, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Student Team, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China
2020年全球癌症统计报告显示,结直肠癌是女性第2位常见的癌症,是男性第3位常见的癌症,每年导致约90万人死亡,约占癌症相关死亡的10%,是世界第四大致命癌症[1]。虽然目前临床可以通过多种手段对结直肠癌进行诊断和治疗,患者的总生存期也逐渐延长,但晚期患者的诊疗效果仍不理想[2]。因此,探索新的诊断和治疗靶点对提高结直肠癌的早期发现率与降低患者死亡率具有重要意义[3]。
镍纹样蛋白(meteorin-like protein,Metrnl)是近年发现的一种分泌蛋白[4],它在脂肪组织、屏障组织等高表达[5],可抑制肥胖诱导的脂肪组织炎症、改善胰岛素抵抗、促进骨骼肌修复等[6]。Metrnl还在肠道上皮中大量表达,肠道上皮缺乏Metrnl可使炎症性肠病恶化[7-8]。研究报道与Metrnl同属一个蛋白家族的meteorin在结直肠癌中表达上调,且与预后不良有关[9]。此外,Metrnl在恶性间皮瘤、基底细胞癌和毛母细胞瘤中表达上调[10-11]。然而,目前对Metrnl在结直肠癌中的作用尚不明确,本研究初步探讨了Metrnl与结直肠癌的关系及其在结直肠癌发生、发展中的作用。
1 材料和方法 1.1 人体组织样本的获取组织芯片(OD-CT-DgCol03-003;Outdo)是通过点排列30对结直肠癌患者的结直肠癌组织和癌旁组织及1对正常人的结直肠组织样本,用甲醛水溶液固定、石蜡包埋制备。另外15例结直肠癌患者新鲜的结直肠癌组织和15例正常人的结直肠组织标本从海军军医大学(第二军医大学)第一附属医院获得。标本收集获得所有受试者知情同意并签署知情同意书,本研究通过海军军医大学(第二军医大学)医学伦理委员会审批。
1.2 免疫组织化学染色与分析采用免疫组织化学方法检测包含30对人结直肠癌组织及癌旁组织和1对正常人结直肠组织的组织芯片。该30对组织取自30例结直肠癌患者[年龄为31~85(62.8±15.2)岁,男19例、女11例],其中TNMⅡ期(13例)、Ⅲ期(12例)、Ⅳ期(5例)。使用Metrnl抗体(美国Sigma公司)对组织芯片(OD-CT-DgCol03-003)进行免疫组织化学染色后拍照、分析图像。染色强度评分标准:阴性计0分,弱阳性计1分,中阳性计2分,强阳性计3分。阳性率评分标准:阳性率<5%计0分,5%~30%计1分,31%~60%计2分,>60%计3分。结合染色强度和阳性率评分作为组织切片的评分。
1.3 细胞培养使用人克隆结肠腺癌细胞系Caco-2细胞(上海盈湾生物科技有限公司)进行研究。Caco-2细胞用含10% FBS(美国Gibco公司)的DMEM(美国Gibco公司)在37 ℃、5% CO2细胞培养箱中培养。
1.4 制备Metrnl敲减细胞模型构建携带Metrnl shRNA的慢病毒载体,靶向序列为5'-CACGCTTTAGTGACTTTCAAA-3'。细胞贴壁后将慢病毒与细胞共同孵育24 h后换液,获得Metrnl敲减的Caco-2细胞模型(Metrnl shRNA),对照组为无关序列(Scr shRNA),采用qPCR验证Metrnl的敲减效果。
1.5 qPCR检测Metrnl mRNA的表达使用TRIzol试剂(美国Invitrogen公司)分别从15例结直肠癌组织、15例正常结直肠组织和Caco-2细胞中提取总RNA,使用ABI 7500实时PCR系统(美国Applied Biosystems公司)进行PCR扩增。以GAPDH作为内参照,并使用2-∆∆Ct法进行定量分析。Metrnl正向引物序列为5'-CTGGAGCAGGGAGGCTTATTT-3',反向引物序列为5'-GGACAACAAAGTCACTGGTACAG-3';GAPDH正向引物序列为5'-GTATGACTCCACTCACGGCAAA-3',反向引物序列为5'-GGTCTCGCTCCTGGAAGATG-3'。
1.6 细胞活性及凋亡指标测定以每孔10 000个细胞接种到96孔板,用CCK-8检测不同5-氟尿嘧啶浓度和不同时间点的细胞活力。分别以含10、100、1 000 μg/mL 5-氟尿嘧啶的培养基孵育细胞24、48和72 h,而后换液移除5-氟尿嘧啶,加入100 μL完全培养基,同时加入10 μL CCK-8试剂(上海碧云天生物技术有限公司)于37 ℃、5% CO2培养箱中孵育3 h,测定波长450 nm处的光密度值。
以每孔50 000个细胞接种到6孔板,用含10 μg/mL 5-氟尿嘧啶的培养基孵育48 h后换液,收集细胞,用膜联蛋白Ⅴ-FITC/PI流式细胞术凋亡检测试剂盒和caspase 3活性检测试剂盒检测Caco-2细胞的凋亡情况。
1.7 统计学处理应用GraphPad Prism 8.0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验。所有检验均为双侧检验,检验水准(α)为0.05。
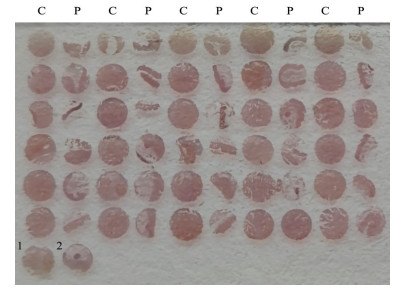
2 结果 2.1 结直肠癌患者的Metrnl表达情况组织芯片免疫组织化学染色结果见图 1,30例结直肠癌组织免疫组织化学染色评分均为6分,癌旁组织免疫组织化学染色评分为(4.17±0.30)分,结直肠癌组织中Metrnl蛋白质表达水平高于癌旁组织(P<0.000 1)。qPCR检测结果显示,结直肠癌组织中Metrnl mRNA的相对表达水平为0.09±0.02,低于正常结直肠组织中的表达水平(0.22±0.06,P<0.05)。
|
图 1 免疫组织化学染色分析结直肠癌组织中Metrnl表达 Fig 1 Metrnl expression in colorectal cancer tissue detected by immunohistochemical staining Human tissue microarray. C: Colorectal cancer tissue; P: Paracancer tissue. 1: Blank control; 2: Normal control. Metrnl: Meteorin-like protein. |
2.2 下调Metrnl表达增加Caco-2细胞活性
qPCR检测结果显示,Metrnl shRNA组和Scr shRNA组Caco-2细胞中Metrnl mRNA的相对表达水平分别为0.10±0.01、1.00±0.01,差异有统计学意义(P<0.000 1)。CCK-8检测结果表明,下调Metrnl表达在10~1 000 μg/mL 5-氟尿嘧啶孵育48、72 h的条件下均增加了Caco-2细胞的活性(P均<0.01,表 1)。
|
|
表 1 CCK-8检测下调Metrnl表达对Caco-2细胞活性的影响 Tab 1 Effect of down-regulating Metrnl expression on Caco-2 cell viability detected by CCK-8 |
2.3 下调Metrnl表达减少Caco-2细胞凋亡
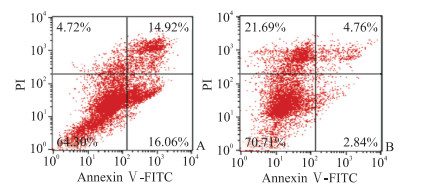
使用10 μg/mL 5-氟尿嘧啶作用48 h后,Metrnl shRNA组和Scr shRNA组Caco-2细胞中caspase 3活性分别为1.04±0.27和1.67±0.44,差异有统计学意义(P<0.05);Metrnl shRNA组和Scr shRNA组Caco-2细胞的凋亡比例分别为(12.53±6.69)%和(26.56±10.89)%,差异有统计学意义(P<0.05,图 2)。
|
图 2 流式细胞术检测Caco-2细胞凋亡水平 Fig 2 Caco-2 cell apoptosis detected by flow cytometry The cells were treated with 10 μg/mL 5-fluorouracil for 48 h. A: Scr shRNA group; B: Metrnl shRNA group. Scr: Scrambled; shRNA: Short hairpin RNA; Metrnl: Meteorin-like protein; PI: Propidium iodide; FITC: Fluorescein isothiocyanate. |
3 讨论
研究表明在人体多种组织中,结直肠上皮中Metrnl表达水平最高[9],本研究结果显示Metrnl在人结直肠癌组织及癌旁组织中存在差异表达,结直肠癌组织中Metrnl蛋白表达水平高于癌旁组织。研究发现Metrnl在肠上皮中特异性高表达,敲除肠上皮Metrnl未显著影响血液中Metrnl的表达水平,但肠液中Metrnl蛋白的含量减少,提示肠上皮表达的Metrnl主要分泌到肠液中,而肠癌组织的肠上皮结构被破坏,可能导致原本主要分泌到肠腔中的Metrnl蛋白在组织中富集,局部蛋白增加[9]。本实验结果显示,结直肠癌组织中Metrnl mRNA表达水平低于正常结直肠组织,表明Metrnl转录在结直肠癌组织中降低,这与癌症基因组图谱数据库显示的结果一致,提示Metrnl在结直肠癌细胞中的表达可能减少。
本实验对Metrnl表达降低在结直肠癌发生、发展中的作用进行了初步探讨,采用CCK-8检测敲减Metrnl的Caco-2细胞在不同5-氟尿嘧啶作用浓度和不同时间点的细胞活性,结果显示相较于对照组下调Metrnl不同程度地增加了细胞的活性。敲减Metrnl后Caco-2细胞在5-氟尿嘧啶的作用下其凋亡水平降低,凋亡执行蛋白caspase 3的活性也下降。这些结果表明,下调Caco-2细胞中Metrnl表达抑制了5-氟尿嘧啶诱导的细胞活性下降、细胞凋亡,结合前述结直肠癌患者癌组织中Metrnl转录水平下调的结果,说明Metrnl表达下调可能促进了结直肠癌的发生、发展。上调Metrnl表达可能成为结直肠癌治疗的潜在策略,尤其是Metrnl作为分泌蛋白在发展成为治疗靶点方面具有优势。
本研究存在一定的局限性。首先,Metrnl影响结直肠癌发生与发展的机制尚不明确。其次,Metrnl作为分泌蛋白,能否发挥结直肠癌的治疗作用还未得到验证。
本研究表明,在结直肠癌中,Metrnl蛋白在局部癌组织中蓄积,但Metrnl mRNA表达下调,敲减Metrnl可提高细胞活性、抑制凋亡,提示Metrnl可能成为结直肠癌的治疗靶点。
| [1] |
周雄, 胡明, 李子帅, 曹广文, 谭 晓㛃. 2020年全球及中国结直肠癌流行状况分析[J]. 海军军医大学学报, 2022, 43: 1356-1364. ZHOU X, HU M, LI Z S, CAO G W, TAN X J. Colorectal cancer in the world and China in 2020: an analysis of epidemic status[J]. Acad J Naval Med Univ, 2022, 43: 1356-1364. |
| [2] |
KOPENHAVER J, CRUTCHER M, WALDMAN S A, SNOOK A E. The shifting paradigm of colorectal cancer treatment: a look into emerging cancer stem cell-directed therapeutics to lead the charge toward complete remission[J]. Expert Opin Biol Ther, 2021, 21: 1335-1345. DOI:10.1080/14712598.2021.1929167 |
| [3] |
STARK V A, FACEY C O B, VISWANATHAN V, BOMAN B M. The role of miRNAs, miRNA clusters, and isomiRs in development of cancer stem cell populations in colorectal cancer[J/OL]. Int J Mol Sci, 2021, 22: 1424. DOI: 10.3390/ijms22031424.
|
| [4] |
WATANABE K, AKIMOTO Y, YUGI K, UDA S, CHUNG J, NAKAMUTA S, et al. Latent process genes for cell differentiation are common decoders of neurite extension length[J]. J Cell Sci, 2012, 125(Pt 9): 2198-2211. |
| [5] |
LI Z Y, ZHENG S L, WANG P, XU T Y, GUAN Y F, ZHANG Y J, et al. Subfatin is a novel adipokine and unlike Meteorin in adipose and brain expression[J]. CNS Neurosci Ther, 2014, 20: 344-354. DOI:10.1111/cns.12219 |
| [6] |
LI Z Y, SONG J, ZHENG S L, FAN M B, GUAN Y F, QU Y, et al. Adipocyte metrnl antagonizes insulin resistance through PPARγ signaling[J]. Diabetes, 2015, 64: 4011-4022. DOI:10.2337/db15-0274 |
| [7] |
LI Z Y, FAN M B, ZHANG S L, QU Y, ZHENG S L, SONG J, et al. Intestinal Metrnl released into the gut lumen acts as a local regulator for gut antimicrobial peptides[J]. Acta Pharmacol Sin, 2016, 37: 1458-1466. DOI:10.1038/aps.2016.70 |
| [8] |
ZHANG S L, LI Z Y, WANG D S, XU T Y, FAN M B, CHENG M H, et al. Aggravated ulcerative colitis caused by intestinal Metrnl deficiency is associated with reduced autophagy in epithelial cells[J]. Acta Pharmacol Sin, 2020, 41: 763-770. DOI:10.1038/s41401-019-0343-4 |
| [9] |
XU X, ZHANG C H, XIA Y, YU J W. Over expression of METRN predicts poor clinical prognosis in colorectal cancer[J/OL]. Mol Genet Genomic Med, 2020, 8: e1102. DOI: 10.1002/mgg3.1102.
|
| [10] |
KOCAMAN N, ARTAŞ G. Can novel adipokines, asprosin and meteorin-like, be biomarkers for malignant mesothelioma?[J]. Biotech Histochem, 2020, 95: 171-175. DOI:10.1080/10520295.2019.1656344 |
| [11] |
KOCAMAN N, YUKSEL E I, DEMIR B, CALIK I, CICEK D. Two novel biomarker candidates for differentiating basal cell carcinoma from trichoblastoma; asprosin and meteorine like peptide[J/OL]. Tissue Cell, 2022, 76: 101752. DOI: 10.1016/j.tice.2022.101752.
|
 2023, Vol. 44
2023, Vol. 44


