2. 安徽医科大学附属安庆第一人民医院, 安徽省安庆市第一人民医院胃肠外科, 安庆 246052
2. Department of Gastrointestinal Surgery, Anqing First People's Hospital of Anhui Medical University & Anqing First People's Hospital of Anhui Province, Anqing 246052, Anhui, China
食管癌、胃癌、结直肠癌是最常见的消化道肿瘤,患者由于进食梗阻、摄食下降、手术创伤、放射治疗、化学治疗(以下简称化疗)等原因,营养不良发生率高[1]。化疗是消化道肿瘤的重要治疗手段,但不可避免带来骨髓抑制、呕吐、腹泻、肝功能损伤等一系列不良反应。这些不良反应会进一步加重营养不良,并影响后续治疗方案的实施。因此,探索导致不良反应的因素将有利于做出系统性治疗决策。然而,近些年来该领域的研究结论并不一致,时至今日仍未能得出对化疗不良反应有确切预测价值的临床因素[2-3]。实际工作中,化疗方案和剂量的选择大多是在权衡患者年龄、脏器功能状态、一般行为状况及既往对化疗的耐受力等因素后,根据临床医师的经验进行个体化剂量调整。
肠道屏障功能一直是消化道疾病研究的热点。在一些良性疾病[4]和重症疾病[5]中开展的研究表明,肠道屏障功能损伤的患者对于治疗的耐受力明显下降,且并发症增多。肠道屏障功能损伤与不良的临床预后有关,并且和营养不良互为因果[6]。本研究旨在评价化疗前消化道肿瘤患者肠道屏障功能对化疗后常见不良反应和营养状态恶化的影响,为临床干预提供参考。
1 材料和方法 1.1 临床资料本研究通过安徽医科大学附属安庆第一人民医院伦理委员会审批。收集2019年9月至2022年5月安徽医科大学附属安庆第一人民医院收治的食管癌、胃癌、结直肠癌患者资料。纳入标准:(1)经病理证实的食管鳞状细胞癌、胃腺癌或结直肠腺癌;(2)需要行辅助或姑息化疗;(3)年龄>18岁;(4)体力活动状态(performance status,PS)评分≤2分;(5)预计生存时间>3个月;(6)患者知情同意。排除标准:(1)治疗前1个月内或研究期间联合靶向或免疫治疗;(2)近半年或研究期间接受腹盆腔放射治疗;(3)患有严重贫血、主要脏器严重功能损伤、消化道穿孔和严重消化道出血。通过医院病案系统收集158例食管、胃或结直肠恶性肿瘤患者资料,排除治疗前1个月及研究期间联合靶向或免疫治疗患者60例、近半年或研究期间接受腹盆腔放射治疗患者16例、有主要脏器严重功能损伤患者2例、患有小细胞癌患者1例、门诊失访患者2例,最终入组食管鳞状细胞癌、胃腺癌或结直肠腺癌患者共77例。
1.2 研究方法 1.2.1 肠道屏障功能检测化疗前1周内空腹采静脉血2 mL,使用北京中生金域诊断技术有限公司生产的二胺氧化酶(diamine oxidase,DAO)/D-乳酸/内毒素三联检肠道屏障功能分析仪测定血清DAO、D-乳酸、内毒素水平(DAO、D-乳酸、内毒素正常参考值分别为0~10 U/L、0~15 mg/L、0~20 U/L)。
1.2.2 化疗方案根据不同瘤种,化疗方案选用氟尿嘧啶类、铂类、紫杉类或拓扑异构酶抑制剂等消化道肿瘤常用化疗药物的单药或联合方案,对于部分行为状况评分为2分的老年患者、食管癌同步放疗患者或早期低危的消化道肿瘤患者选择单药化疗。
1.2.3 营养干预方法遵循《中国肿瘤营养治疗指南》(2015版)[7]推荐的营养风险筛查、评估和五阶梯营养干预方法,化疗前对患者进行患者主观整体营养评估量表(patient generated subjective global assessment,PG-SGA)评分,PG-SGA评分≥4分判定为中或重度营养不良。能量供给达到每天热量25~30 kcal/(kg·d)(1 cal=4.184 J)及蛋白质1.2 g/(kg·d)以上营养需求。在营养耐受到达90%~100%的目标能量需求时,启动抗肿瘤治疗。
1.2.4 评价指标化疗结束后3 d内或门诊每周复查血常规和肝功能,2~3周后或下一个化疗周期开始前进行第2次PG-SGA评分,评价本次化疗周期内中性粒细胞、血小板、丙氨酸转氨酶和天冬氨酸转氨酶等指标及呕吐、腹泻、PG-SGA评分的变化。营养状态恶化定义为第2次PG-SGA评分大于化疗前PG-SGA评分。
1.3 统计学处理应用SPSS 21软件进行统计分析。计量资料先采用Kolmogorov-Smirnov法进行正态性检验,均符合正态分布,以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,多重比较采用最小显著性差异法。计数资料以例数和百分数表示,组间比较采用χ2检验。筛选差异有统计学意义的临床特征和肠道屏障功能指标引入二元logistic回归方程,与化疗后不良反应和营养状态恶化进行回归分析。对回归分析有统计学意义的肠道屏障功能指标绘制ROC曲线,评价其预测化疗后不良反应和营养状态恶化的效果,采用约登指数计算最佳预测值、灵敏度和特异度。检验水准(α)为0.05。
2 结果 2.1 患者基线特征及肠道屏障功能比较化疗前血清DAO、D-乳酸、内毒素水平在不同年龄、性别、PS评分、PG-SGA评分、肿瘤分期、辅助或姑息化疗、化疗方案、首程或后程化疗的患者间差异均无统计学意义(P均>0.05)。食管癌患者的血清内毒素水平高于胃癌患者(P=0.042),化疗前3个月内进行过胃肠手术治疗的患者内毒素水平低于未行手术治疗的患者(P=0.036)。见表 1。
|
|
表 1 不同临床特征消化道肿瘤患者的肠道屏障功能指标 Tab 1 Intestinal barrier function indicators of gastrointestinal tumor patients with different clinical characteristics |
2.2 化疗后不良反应和营养状态恶化的临床影响因素
初始PG-SGA评分≥4分的患者中性粒细胞减少发生率高于PG-SGA评分为1~3分的患者(P=0.033),同步胸部放射治疗的患者中性粒细胞减少发生率高于单纯化疗者(P=0.037)。血小板减少和转氨酶升高的发生率在不同临床特征组之间比较差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 不同临床特征消化道肿瘤患者骨髓抑制及转氨酶升高的发生率 Tab 2 Incidence of bone marrow suppression and transaminase elevation of gastrointestinal tumor patients with different clinical characteristics |
PG-SGA评分≥4分、化疗前3个月内接受胃肠手术和首程化疗的患者呕吐发生率分别高于PG-SGA评分为1~3分、未行胃肠手术和后程化疗的患者(P均<0.05)。后程化疗的患者营养状态恶化发生率较首程化疗者更高(P=0.027)。见表 3。
|
|
表 3 不同临床特征消化道肿瘤患者化疗后呕吐、腹泻及营养状态恶化的发生率 Tab 3 Incidence of vomiting, diarrhea and nutritional deterioration after chemotherapy in gastrointestinal tumor patients with different clinical characteristics |
2.3 肠道屏障功能指标对化疗后不良反应及营养状态的影响
化疗后出现中性粒细胞减少及血小板减少的患者化疗前DAO、D-乳酸、内毒素水平与未发生骨髓抑制的患者相比差异均无统计学意义(P均>0.05)。化疗后呕吐、腹泻和营养状态恶化的患者化疗前DAO和D-乳酸水平较无呕吐、无腹泻和营养状态未恶化的患者更高(P均<0.05),化疗后转氨酶升高和腹泻的患者化疗前内毒素水平较无腹泻和转氨酶未升高的患者更高(P均<0.001)。见表 4。
|
|
表 4 消化道肿瘤患者肠道屏障功能对化疗后不良反应的影响 Tab 4 Effects of intestinal barrier function on adverse reactions after chemotherapy in patients with gastrointestinal tumors |
2.4 化疗后不良反应及营养状态恶化影响因素的二元logistic回归分析
对化疗后呕吐、腹泻及营养状态恶化有影响的肠道屏障功能指标及部分临床特征进行二元logistic回归分析,结果显示化疗前DAO、D-乳酸和3个月内行胃肠手术与化疗后呕吐相关(P=0.028、0.008、0.020),化疗前D-乳酸是化疗后腹泻的独立影响因素(P=0.001),化疗前D-乳酸增高和后程化疗的患者化疗后营养状态更易恶化(P=0.037、0.016)。见表 5。
|
|
表 5 消化道肿瘤患者化疗后不良反应及营养状态恶化影响因素的二元logistic回归分析 Tab 5 Binary logistic regression analysis of adverse reactions and nutritional deterioration after chemotherapy in patients with gastrointestinal tumors |
2.5 肠道屏障功能指标预测化疗后不良反应和营养状态恶化ROC曲线分析
根据ROC曲线及约登指数计算,内毒素对于化疗后转氨酶升高的最佳预测值为17.36 U/L(AUC=0.850,P<0.001),灵敏度为78.6%,特异度为90.5%。DAO与D-乳酸对化疗后呕吐均有预测价值,最佳预测值分别为10.47 U/L(AUC=0.727,P=0.001)和18.55 mg/L(AUC=0.708,P=0.003),灵敏度分别为68.0%、52.0%,特异度分别为76.9%、84.6%。D-乳酸对化疗后腹泻的最佳预测值为17.63 mg/L(AUC=0.920,P<0.001),灵敏度为87.5%,特异度为85.2%。D-乳酸对化疗后营养状态恶化的最佳预测值为12.77 mg/L(AUC=0.684,P=0.006),灵敏度为74.3%,特异度为64.3%。见图 1。
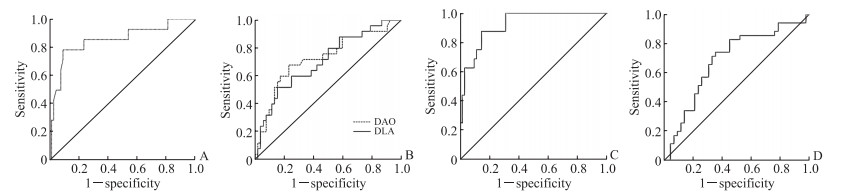
|
图 1 消化道肿瘤患者肠道屏障功能指标预测化疗后不良反应和营养状态恶化的ROC曲线 Fig 1 ROC curves of intestinal barrier function indicators predicting adverse reactions and nutritional deterioration after chemotherapy in patients with gastrointestinal tumors A: ROC curve of endotoxin predicting transaminase elevation (AUC=0.850, 95% CI 0.723-0.978, P < 0.001); B: ROC curves of DAO and DLA predicting vomiting (AUC=0.727, 95% CI 0.601-0.853, P=0.001; AUC=0.708, 95% CI 0.584-0.832, P=0.003); C: ROC curve of DLA predicting diarrhea (AUC=0.920, 95% CI 0.856-0.984, P < 0.001); D: ROC curve of DLA predicting nutritional deterioration (AUC=0.684, 95 CI 0.562-0.806, P=0.006). ROC: Receiver operating characteristic; DAO: Diamine oxidase; DLA: D-lactic acid; AUC: Area under curve; CI: Confidence interval. |
3 讨论
肠道屏障包括机械屏障、化学屏障、生物屏障和免疫屏障,其功能损伤的机制及影响因素较为复杂。普遍认为感染、创伤、消化道梗阻、营养不良、失血、脱水,以及广谱抗生素、免疫抑制剂、放射治疗、化疗等临床治疗均可能导致肠道屏障功能损伤[8]。肠道屏障功能的损伤程度可用DAO、D-乳酸和内毒素等指标评价[9]。DAO主要存在于人小肠绒毛的上皮细胞中,血清中含量较低,肠道黏膜受损时DAO释放入血,因此,血清中DAO水平增高可以反映肠上皮细胞受损和肠道屏障完整性破坏[10]。D-乳酸是肠道内细菌的代谢产物,正常情况下几乎不被人体吸收。肠上皮细胞损伤时肠壁通透性增加即可导致D-乳酸大量入血,由于人体缺乏D-乳酸降解的酶系,其水平升高通常反映肠壁通透性增高和上皮受损[11-12]。内毒素主要存在于革兰阴性菌的细胞外膜中,在肠道屏障功能受损时肠内细菌或毒素可向区域淋巴结和外周血易位,引起血液中内毒素水平升高。血清内毒素升高常提示在肠道屏障功能损伤的同时存在肠源性细菌移位[13]。
既往研究提示,营养状态恶化会加重肠道屏障功能损伤[14]。然而,本研究入组的PG-SGA评分≥4分的中、重度营养不良患者肠道屏障功能指标与PG-SGA评分为1~3分的营养状况较好的患者比较差异无统计学意义。此外,本研究中半数以上为后程化疗患者,后程化疗患者的营养状态恶化发生率虽然较首程化疗患者更高,但肠道屏障功能指标差异无统计学意义。有研究证实,早期的营养干预有利于肠道屏障功能恢复[15]。本研究入组的后程化疗患者前期在我院均接受了规范的营养补充干预,而首程化疗患者多是首次来我院治疗或前期在其他医院治疗且未接受充分营养干预者。分析认为,这种前期营养干预程度不同可能是本研究中不同营养状态分组和不同治疗疗程分组比较肠道屏障功能差异无统计学意义的重要原因。这也提示早期营养干预可能在改善全身营养状态之前优先促进了肠道屏障功能恢复。
近3个月接受胃肠手术的患者较近3个月未行手术的患者内毒素水平更低,提示经手术降低肿瘤负荷、切除有肿瘤病变的消化道组织可以降低内毒素水平,从而降低近期肠源性细菌易位和内毒素血症的可能性。在不同瘤种的比较中,食管癌患者的内毒素水平较胃癌更高,与结直肠癌患者相比也较高,但由于本研究入组结直肠癌患者较少,食管癌患者与结直肠癌患者内毒素水平比较差异无统计学意义(P=0.105)。一项胃癌术后的营养干预研究表明,早期肠内营养比肠外营养更有利于肠道屏障功能的恢复[16]。虽然本研究患者在入组后均进行了充分的营养干预,但食管癌患者由于进食梗阻或因术后上消化道生理结构改变导致摄食减少的程度高于胃癌和结直肠癌患者,治疗过程中更多地依赖肠外营养供给,推测这种营养给予的途径不同可能是本研究食管癌患者内毒素水平高于胃癌和结直肠癌患者的原因。
根据以上分析可以看出肠道屏障功能的影响因素非常复杂,初始营养状态、既往化疗周期数、减瘤手术、营养干预的早晚及肠内肠外营养的营养素占比可能都是肠道屏障功能的影响因素,有必要进一步开展相关研究。
2021年肿瘤放化疗相关中性粒细胞减少症规范化管理指南指出,年龄>65岁、既往化疗或放射治疗、近期手术、营养状况或PS评分差均是接受中风险化疗方案患者发生中性粒细胞减少的危险因素,患者具有其中任何1个危险因素,该指南均推荐长效升白药作为一级预防措施[17]。然而,本研究结果显示化疗后中性粒细胞减少的发生率仅在营养状况较差和同步胸部放射治疗的患者中有所增高,且与近期手术、年龄、PS评分及初始DAO、D-乳酸、内毒素水平无关。由于本研究入组的患者在化疗期间均进行了规范营养干预,故认为规范的营养干预会降低指南中提及的其他危险因素导致的化疗后骨髓抑制风险。针对上述指南中提及的多项可导致中性粒细胞减少的危险因素,也应进一步开展研究以排除这些危险因素之间的交互作用,从而确定长效升白药一级预防的实际获益人群。
内毒素存在于革兰阴性菌的细胞外膜中,主要来源于肠道细菌,可被肝脏库普弗细胞清除。肝功能异常的患者更容易出现内毒素水平增高和感染风险[18],内毒素水平增高也是肝损伤加重的重要因素[19]。本研究结果显示,化疗后转氨酶升高的患者化疗前内毒素水平更高,内毒素对于化疗后转氨酶升高的最佳预测值为17.36 U/L(AUC=0.850,灵敏度为78.6%,特异度为90.5%,P<0.001)。以上结果提示内毒素水平较高的患者是化疗后肝脏易损人群。
抗肿瘤治疗相关恶心呕吐预防和治疗指南(2019版)将抗肿瘤药物致恶心呕吐的主要影响因素归为个人体质、其他疾病和伴随治疗3个方面[20]。然而,该指南提供的参考因素由于缺乏具体的量化指标,导致临床预防处理并不容易抉择。本研究结果显示,PG-SGA评分≥4分、3个月内行胃肠手术、首程化疗、DAO及D-乳酸水平增高的患者化疗后呕吐发生率更高。进一步logistic回归分析结果表明,化疗前DAO和D-乳酸水平及近3个月内是否行胃肠手术与化疗后呕吐有关。ROC曲线分析结果显示DAO和D-乳酸对化疗后呕吐均有一定的预测价值,最佳预测值分别为10.47 U/L(AUC=0.727,灵敏度为68.0%,特异度为76.9%,P=0.001)和18.55 mg/L(AUC=0.708,灵敏度为52.0%,特异度为84.6%,P=0.003)。根据本研究结果,化疗前完善肠道屏障功能检测,用可量化的肠道屏障功能指标来预测呕吐的发生,对于临床预防呕吐有一定的补充参考作用。DAO预测化疗后呕吐的灵敏度高于D-乳酸,而D-乳酸预测特异度高于DAO,临床实践中可综合参考这2个指标,再结合指南推荐的建议,采用个体化的呕吐预防处理措施。本研究logistic回归分析结果提示,化疗前3个月内接受了胃肠手术也和化疗后呕吐发生率增高有关,但需要注意的是,不同的手术方式对呕吐的影响可能会存在差异[21]。由于本研究样本量偏小,未能进一步根据手术方式进行分组比较。
腹泻也是化疗后常见的不良反应。本研究结果显示肠道屏障功能的3项检测指标均与腹泻发生有关,其中D-乳酸水平增高提示肠壁的通透性增高。进一步logistic回归分析提示仅D-乳酸是化疗后腹泻的独立影响因素,且D-乳酸对腹泻的预测灵敏度和特异度均较高。值得注意的是,化疗后出现腹泻可能与治疗药物有关,也可能是肠内营养不耐受导致[22]。然而,肠道屏障功能损伤所致的肠壁通透性增高是腹泻发生的重要环节,通过改善肠道通透性可以降低腹泻的发生率[23]。
化疗后营养状态的保持对于后续能否按期、足量治疗至关重要。本课题组前期开展的一项关于食管癌放化疗后营养状况分析的研究结果显示,在规范营养干预下,年龄、PS评分、初始营养状况不良并不是导致化疗后营养状态恶化的危险因素[24]。而本研究结果也仅提示治疗疗程会影响营养状态恶化,后程化疗的患者营养状态恶化发生率较首程化疗患者更高,其他临床特征未导致营养状态恶化发生率增高,这与本课题组前期研究的主要结论有共同之处。肠道屏障功能指标的比较显示,化疗后营养状态恶化的患者基线DAO、D-乳酸水平更高。logistic回归分析结果提示,D-乳酸和后程化疗是营养状态恶化的独立影响因素。D-乳酸预测化疗后营养状态恶化的最佳预测值为12.77 mg/L(AUC=0.684,灵敏度为74.3%,特异度为64.3%,P=0.006),其特异度稍低。根据本研究结果分析认为,后程化疗的患者更容易出现营养状态恶化。D-乳酸预测营养状态恶化有一定的参考价值,灵敏度高但特异度相对较低说明采用D-乳酸进行预测漏判率较低,但有一定的误判率。因此,在肿瘤患者的全程营养管理中,对于基线D-乳酸水平高的患者应该加强化疗期间营养状态的评估和监测,特别是在后程化疗期间。
综上所述,本研究重点分析了肠道屏障功能指标DAO、D-乳酸和内毒素对消化道肿瘤化疗后常见不良反应和营养状态的影响。化疗前进行肠道屏障功能检测对于化疗后呕吐、腹泻、转氨酶升高有较好的预测作用,D-乳酸是预测化疗后营养状态恶化较灵敏的指标。在化疗前了解肠道屏障功能对于化疗后不良反应的防治和全程营养管理有积极的参考价值。
| [1] |
唐淑慧, 王汇, 夏陈成, 凤美娟, 赵金晶. 消化道恶性肿瘤化疗病人营养状况现况调查和影响因素分析[J]. 肠外与肠内营养, 2021, 28: 35-40. |
| [2] |
MOTH E B, KIELY B E, STEFANIC N, NAGANATHAN V, MARTIN A, GRIMISON P, et al. Predicting chemotherapy toxicity in older adults: comparing the predictive value of the CARG toxicity score with oncologists' estimates of toxicity based on clinical judgement[J]. J Geriatr Oncol, 2019, 10: 202-209. DOI:10.1016/j.jgo.2018.08.010 |
| [3] |
张茜茜. 老年结肠癌患者化疗毒性影响因素分析及CARG工具的预测价值探讨[D]. 苏州: 苏州大学, 2019.
|
| [4] |
胡安印, 王经琳, 任昊桢, 施晓雷. 肠道屏障功能受损与非酒精性脂肪性肝病的研究进展[J]. 医学综述, 2021, 27: 2497-2502. DOI:10.3969/j.issn.1006-2084.2021.13.001 |
| [5] |
杨明华, 施保柱, 董妍, 许梅, 董旭, 王雷, 等. 老年脓毒症患者肠屏障状况和预后危险因素[J]. 中国老年学杂志, 2021, 41: 1221-1225. DOI:10.3969/j.issn.1005-9202.2021.06.030 |
| [6] |
黎介寿. 肠内营养与肠屏障功能[J]. 肠外与肠内营养, 2016, 23: 257-259. |
| [7] |
中国抗癌协会肿瘤营养与支持治疗专业委员会. 中国肿瘤营养治疗指南[M]. 北京: 人民卫生出版社, 2015: 29-30, 41-48.
|
| [8] |
雷泓, 宋云林. 肠屏障功能障碍发病机制的研究进展[J]. 医学综述, 2021, 27: 2715-2720. DOI:10.3969/j.issn.1006-2084.2021.14.003 |
| [9] |
丁春龙, 王玉海, 杨理坤, 朱洁, 史亚琴. 血清D-乳酸、细菌内毒素及二胺氧化酶在创伤性颅脑损伤后肠道黏膜屏障功能评估中的作用[J]. 中华神经外科杂志, 2019, 35: 1258-1261. DOI:10.3760/cma.j.issn.1001-2346.2019.12.015 |
| [10] |
FUKUDOME I, KOBAYASHI M, DABANAKA K, MAEDA H, OKAMOTO K, OKABAYASHI T, et al. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats[J]. Med Mol Morphol, 2014, 47: 100-107. DOI:10.1007/s00795-013-0055-7 |
| [11] |
LI K Y, WANG J L, XU Y Y, GAO S Y, ZHANG Y Y, HE A Q, et al. Intestinal barrier disruption in ileal pouchitis after ileal pouch-anal anastomosis in a rat model[J]. Inflamm Bowel Dis, 2017, 23: 923-931. DOI:10.1097/MIB.0000000000001129 |
| [12] |
QING Y, XIE H Y, SU C, WANG Y W, YU Q Y, PANG Q Y, et al. Gut microbiome, short-chain fatty acids, and mucosa injury in young adults with human immunodeficiency virus infection[J]. Dig Dis Sci, 2019, 64: 1830-1843. DOI:10.1007/s10620-018-5428-2 |
| [13] |
刘丹, 刘伟, 王晓红, 杨晓军. 脓毒症患者肠屏障功能损伤的临床研究[J]. 中华急诊医学杂志, 2018, 27: 785-789. DOI:10.3760/cma.j.issn.1671-0282.2018.07.015 |
| [14] |
BINDELS L B, NEYRINCK A M, LOUMAYE A, CATRY E, WALGRAVE H, CHERBUY C, et al. Increased gut permeability in cancer cachexia: mechanisms and clinical relevance[J]. Oncotarget, 2018, 9: 18224-18238. DOI:10.18632/oncotarget.24804 |
| [15] |
张明, 童静, 高天巍, 徐雁, 陈欣, 汪建英, 等. 早期完全肠内营养对肿瘤并发脓毒症患者的肠黏膜屏障保护作用的研究[J]. 全科医学临床与教育, 2018, 16: 647-651. |
| [16] |
陈德利, 葛思堂, 左芦根, 朱平胜, 李仕青, 刘牧林. 胃癌术后早期肠内营养对术后炎症反应及肠屏障功能的影响[J]. 肠外与肠内营养, 2020, 27: 222-225, 229. |
| [17] |
秦叔逵, 马军. 中国临床肿瘤学会(CSCO)肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021)[J]. 临床肿瘤学杂志, 2021, 26: 638-648. DOI:10.3969/j.issn.1009-0460.2021.07.011 |
| [18] |
SANADA Y, URAHASHI T, IHARA Y, OKADA N, YAMADA N, HIRATA Y, et al. Pretransplant levels of endotoxin can predict the risk of bacterial infections and graft liver function after liver transplantation[J]. Eur J Pediatr Surg, 2015, 25: 236-241. |
| [19] |
JIANG T, XIA G, YANG B, ZHANG H W, YIN Y S, TANG C W, et al. Application of bone marrow mesenchymal stem cells effectively eliminates endotoxemia to protect rat from acute liver failure induced by thioacetamide[J]. Tissue Eng Regen Med, 2022, 19: 403-415. |
| [20] |
中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)抗肿瘤治疗相关恶心呕吐预防和治疗指南[M]. 北京: 人民卫生出版社, 2019: 11-13.
|
| [21] |
武迪, 薛英威, 张洪峰. 近端胃癌消化道重建术式改良临床观察的研究[J]. 实用肿瘤学杂志, 2015, 29: 97-101. |
| [22] |
SRIPONGPUN P, LERTPIPOPMETHA K, CHAMROONKUL N, KONGKAMOL C. Diarrhea in tube-fed hospitalized patients: feeding formula is not the most common cause[J]. J Gastroenterol Hepatol, 2021, 36: 2441-2447. |
| [23] |
王海翔, 王志国, 陈浩, 徐海, 严锋, 程文芳, 等. 肠内营养性腹泻与肠壁通透性相关性研究进展[J]. 现代医学, 2020, 48: 791-795. |
| [24] |
余嘉文, 程进, 姚文娟, 胡智刚, 张洪波, 钱立庭. 规范化营养干预下食管癌患者放化疗营养状况分析[J]. 重庆医学, 2022, 51: 1841-1845, 1851. |
 2023, Vol. 44
2023, Vol. 44


