2. 空军军医大学药学系生物制药学教研室, 西安 710032;
3. 空军军医大学西京医院核医学科, 西安 710032
2. Department of Bio-pharmaceuticals, School of Pharmacy, Air Force Medical University, Xi'an 710032, Shaanxi, China;
3. Department of Nuclear Medicine, Xijing Hospital, Air Force Medical University, Xi'an 710032, Shaanxi, China
原发性肝癌(primary hepatic cancer, PHC)是目前世界上发病率最高的癌症, 也是我国常见的恶性肿瘤之一[1-2]。其恶性程度较高, 多数患者初诊时已为晚期, 且治疗效果较差、生存率低。目前手术及术后放、化疗依然是肝癌的主要治疗手段, 其疗效受到多种因素的限制, 且放、化疗在杀伤癌细胞的同时也会给正常细胞和组织带来损伤[3]。因此, 开发高效、低毒的靶向治疗和药物递送方法是治疗PHC的重要发展方向[4]。
近年来, 工程化外泌体作为药物载体成为研究热点[5]。外泌体可以通过携带蛋白质、miRNA、siRNA等其他治疗性物质在肿瘤的治疗中发挥重要作用[6]。外泌体作为核酸药物递送载体的独特优势在于: (1)相较于病毒、脂质体等人工载体, 外泌体具有更低的毒性和免疫原性; (2)外泌体可以有效包裹药物, 使其完好无损地到达受体细胞, 延长药物在体内的半衰期; (3)外泌体具有优异的生物分布和生物相容性, 更容易到达某些靶细胞或靶器官。然而, 外泌体药物递送的靶向性差且容易被单核吞噬细胞系统(mononuclear phagocyte system, MPS)吞噬等问题导致递送效率低, 是其应用的主要障碍, 提高靶向性和递送效率是外泌体工程化改造研究的主要方向。
研究发现, 肝癌特异性靶向肽SP94能特异性靶向肝癌细胞但不能被肝细胞识别[7]。CD47是抑制吞噬作用的“不吃我”信号, 作为信号调节蛋白α(signal regulatory protein α, SIRPα)的配体发挥作用[8-9], 那么, 在外泌体上表达CD47和SP94是否可以既保护外泌体不被巨噬细胞吞噬又提高肝癌靶向性, 进而提高递送效率呢?在本研究中, 我们设计了联合表达SP94和CD47的外泌体, 通过工程化外泌体靶向递送潜在的肝癌治疗性核酸Polo样激酶1(Polo-like kinase 1, PLK1)siRNA, 并考察了其对PHC的治疗效果。
1 材料和方法 1.1 细胞系及主要试剂小鼠肝癌细胞系Hepa1-6、巨噬细胞系RAW264.7和人胚肾细胞系HEK293T均由空军军医大学药学系生物制药学教研室保存。青霉素-链霉素混合液、DMEM高糖培养基及FBS均购于美国Gibco公司。培养皿、6孔板及共聚焦小皿购于美国CORNING公司。GAPDH、CD9、肿瘤易感性基因101(tumor susceptibility gene 101, TSG101)、高尔基体基质蛋白130(Golgi matrix protein 130, GM130)、CD47、溶酶体相关膜蛋白2b(lysosomal associated membrane protein 2b, Lamp2b)抗体和相应二抗, 以及超敏ECL化学发光试剂盒均购于西安壮志生物科技有限公司。
1.2 质粒与修饰外泌体的构建将编码SP94与Lamp2b和/或CD47的cDNA片段插入pcDNA3.1载体中人巨细胞病毒(cytomegalovirus, CMV)启动子的下游, 同时在Lamp2b序列的末尾添加人流感血凝素(hemagglutinin, HA)标签, 分别组装成SP94-Lamp2b-HA质粒, CD47质粒、融合表达SP94和CD47的SP94-CD47-Lamp2b-HA质粒。将SP94-Lamp2b-HA质粒、CD47质粒、SP94-CD47-Lamp2b-HA质粒分别转染进HEK293T细胞, 收集细胞上清后提取SP94修饰的外泌体、CD47修饰的外泌体、SP94和CD47双修饰外泌体。
1.3 外泌体分离及鉴定 1.3.1 外泌体收集与提取将HEK293T细胞在DMEM完全培养基中培养至汇合度为80%, 用无血清DMEM培养基培养48 h后收集细胞上清, 4 ℃ 2 000×g离心30 min去除残留细胞及碎片, 0.22 µm滤膜过滤并收集过滤液。将过滤液于4 ℃ 100 000×g超速离心1 h获得外泌体沉淀, 用PBS重悬后于-80 ℃保存备用。
1.3.2 外泌体粒径分析送样至和元生物技术(上海)股份有限公司, 采用纳米颗粒跟踪分析系统测量外泌体粒径大小。
1.3.3 透射电子显微镜检测送样至和元生物技术(上海)股份有限公司, 用透射电子显微镜观察外泌体形态。首先吸取样品10 μL滴加于铜网上沉淀1 min, 用滤纸吸去浮液。取醋酸双氧铀10 μL滴加于铜网上沉淀1 min, 用滤纸吸去浮液。常温干燥数分钟, 在100 kV下进行透射电子显微镜检测。
1.3.4 蛋白质印迹法检测外泌体标志物采用蛋白质印迹法检测HEK293T细胞及其分泌的外泌体中CD9、TSG101及高尔基体标志物GM130的蛋白表达水平, 以确定提取外泌体的纯度, 同时检测外泌体表面CD47和Lamp2b的蛋白表达水平。
1.4 SP94修饰的外泌体、CD47修饰的外泌体、SP94和CD47双修饰外泌体电穿孔加载PLK1 siRNA从HEK293T细胞上清中提取的SP94修饰的外泌体、CD47修饰的外泌体、SP94和CD47双修饰外泌体, 经BCA法定量后, 分别取200 µg外泌体用PBS重悬并转移至1.5 mL EP管中。PLK1 siRNA粉末经离心后加入DEPC水溶解混匀。将外泌体与PLK1 siRNA混匀后转移至预冷电转杯中, 体系为50 μL。使用日本BEX公司CUY21 EDIT Ⅱ超级电转化仪设置电转参数(110 V, 4 ms, 循环次数10, 电阻80 Ω左右)并进行电穿孔, 随后置于冰上30 min即可使用。
1.5 小鼠PHC模型构建6~8周龄C57BL/6小鼠购于空军军医大学实验动物中心[动物生产许可证号为SCXK(军)2017-0020]。在小鼠体内过表达N-Ras和Akt并使2种基因相互作用, 诱导小鼠肝癌的发生和发展。通过给小鼠尾静脉高压注射myrAkt-Luc、pT3-N-RasV12质粒及pCMV-sleeping beauty7转座子构建小鼠PHC模型。
1.6 外泌体体内靶向效率验证将构建的PHC模型小鼠随机分成2组(每组5只), 分别将200 μg未修饰外泌体(ExosCtrl组)和SP94修饰的外泌体(ExosSP94组)经DiD标记[DiD∶外泌体=1∶300(体积比)]后, 通过尾静脉注射进小鼠体内。在注射后0、3、6、9、12 h时使用美国Perkin Elmer公司IVIS lumina Ⅱ小动物活体成像仪成像, 并剥离小鼠肝脏进行成像, 通过荧光强度分析外泌体在小鼠体内的分布情况及靶向情况。
1.7 MPS和肝癌细胞对修饰外泌体的吞噬作用检测RAW264.7、Hepa1-6细胞进行常规消化后制成单细胞悬液, 按照合适的密度接种于共聚焦小皿中, 待细胞完全贴壁后即可进行相应处理并染色。首先吸弃培养基, 加入1 mL 4%多聚甲醛溶液室温固定20 min; 然后加入200 μL0.05% Triton, 室温破膜处理细胞20 min; 再滴加200 μL DAPI染色工作液, 室温避光孵育1 min。每步之后在摇床上用PBS洗3次, 每次5 min。随后用激光共聚焦显微镜(日本Nikon公司)观察和拍照。
1.8 加载PLK1 siRNA的外泌体的体外抗肝癌作用检测Hepa1-6细胞进行常规消化后制成单细胞悬液, 按照合适的密度接种于6孔板中, 待细胞完全贴壁后分为6组并进行相应处理: 未修饰外泌体空载组(ExosCtrl-siNC组)、SP94和CD47双修饰外泌体空载组(ExosSP94-CD47-siNC组)、未修饰外泌体加载PLK1 siRNA组(ExosCtrl-siPLK1组)、SP94修饰的外泌体加载PLK1 siRNA组(ExosSP94-siPLK1组)、CD47修饰的外泌体加载PLK1 siRNA组(ExosCD47-siPLK1组)、SP94和CD47双修饰外泌体加载PLK1 siRNA组(ExosSP94-CD47-siPLK1组)。处理完成后吸弃培养基, 用PBS洗1次, 用不含EDTA的胰酶消化细胞, 加完全培养基终止消化, 收集细胞沉淀。用预冷PBS清洗1次, 加入200 μL结合缓冲液清洗细胞, 重悬于200 μL含有5 μL膜联蛋白Ⅴ的结合缓冲液中, 室温避光孵育10 min。用200 μL结合缓冲液清洗细胞, 重悬于190 μL结合缓冲液中, 加入10 μL PI重悬细胞, 采用流式细胞仪检测。
1.9 加载PLK1 siRNA的外泌体的体内抗肝癌作用检测实验动物分为2部分, 分别用于肝癌生长情况的观察和生存期的统计。将PHC模型小鼠分为4组(每组5只): 未修饰外泌体组(ExosCtrl组)、SP94修饰的外泌体加载PLK1 siRNA组(ExosSP94-siPLK1组)、CD47修饰的外泌体加载PLK1 siRNA组(ExosCD47-siPLK1组)、SP94和CD47双修饰外泌体加载PLK1 siRNA组(ExosSP94-CD47-siPLK1组)。每3 d以尾静脉注射方式治疗1次, 按10 μL/g的剂量腹腔注射1.5 mg D-萤光素, 10~15 min后进行小动物活体成像, 根据平均荧光强度观察小鼠PHC的生长情况。用作生存期统计的各组小鼠(每组5只)治疗后饲养至死亡为止。
1.10 统计学处理应用GraphPad Prism 8.0软件进行统计学分析和生存曲线绘制。数据以x±s表示, 任意两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 SP94和CD47双修饰外泌体的鉴定将融合表达SP94和CD47的质粒转染进HEK293T细胞, 48 h后收集修饰外泌体(图 1A)。纳米粒径测量结果显示SP94和CD47双修饰外泌体(ExosSP94-CD47)与未修饰外泌体(ExosCtrl)大小均匀, 峰值在120 nm左右, 大小没有显著差异(图 1B), 透射电子显微镜证实修饰不会影响外泌体的形态(图 1C)。用蛋白质印迹法检测外泌体特征性标志物TSG101、CD9及高尔基体标志物GM130的表达水平, 结果显示SP94和CD47修饰未影响外泌体的标志物特征(图 1D)。通过蛋白质印迹法检测了外泌体表面CD47和Lamp2b的表达水平, 结果显示与ExosCtrl相比, CD47修饰的外泌体(ExosCD47)、ExosSP94-CD47表面CD47表达增加, SP94修饰的外泌体(ExosSP94)、ExosSP94-CD47表面Lamp2b的表达增加(图 1E)。
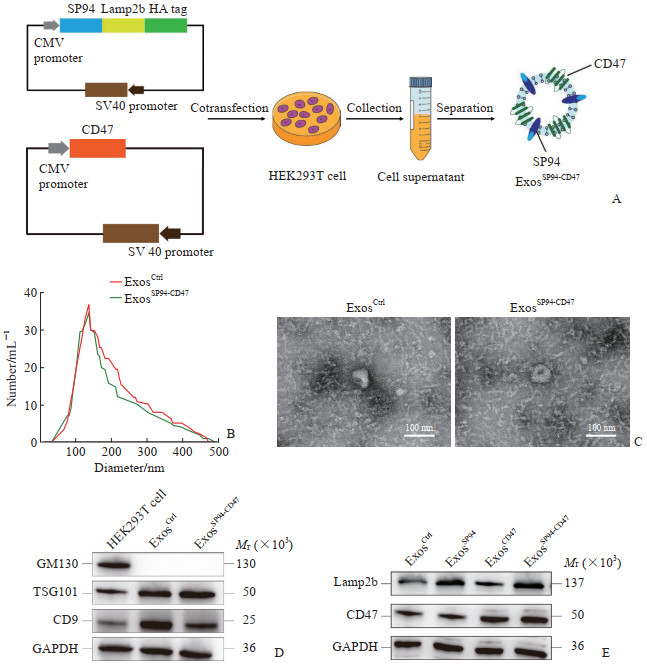
|
图 1 ExosSP94-CD47的构建与鉴定 Fig 1 Construction and identification of ExosSP94-CD47 A: Preparation and separation diagram of SP94 and CD47 double-modified exosomes (ExosSP94-CD47). B: Particle size distribution of exosomes. The particle sizes of unmodified exosomes (ExosCtrl) and ExosSP94-CD47 were measured by nanoparticle tracking analysis. C: Representative images of ExosCtrl and ExosSP94-CD47 under transmission electron microscope. D: The exosome markers CD9 and TSG101 and Golgi body marker GM130 were detected by Western blotting. E: The CD47 and Lamp2b on ExosCtrl, SP94 modified exosomes (ExosSP94), CD47 modified exosomes (ExosCD47), and ExosSP94-CD47 were detected by Western blotting. Lamp2b: Lysosomal associated membrane protein 2b; HA: Hemagglutinin; CMV: Cytomegalovirus; SV40: Simian virus 40; GM130: Golgi matrix protein 130; TSG101: Tumor susceptibility gene 101; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.2 SP94修饰增强了外泌体对小鼠肝癌组织的靶向作用
通过尾静脉注射的方式给小鼠分别注射DiD标记的未修饰外泌体(ExosCtrl)和SP94修饰的外泌体(ExosSP94), 通过小动物活体成像观察荧光强度。结果显示, 相较于ExosCtrl组, ExosSP94组PHC组织中的荧光强度较高(1.320±0.080 vs 0.788±0.039, P<0.05, 图 2A), 在肝癌组织中富集度高(图 2B)。体内实验结果表明, SP94修饰增强了外泌体在肝癌组织的富集。
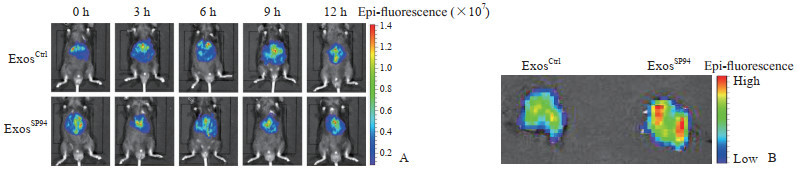
|
图 2 原发性肝癌模型小鼠中外泌体的肿瘤靶向能力 Fig 2 Tumor targeting ability of exosomes in primary hepatic cancer model mice A: In vivo fluorescence images of primary hepatic cancer mice 0, 3, 6, 9, and 12 h after injection of 200 µg DiD-labeled unmodified exosomes (ExosCtrl) or SP94 modified exosomes (ExosSP94) via tail vein; B: Fluorescence images of isolated primary hepatic cancer after injection of DiD-labeled exosomes via tail vein. |
2.3 CD47修饰减少了巨噬细胞RAW264.7对外泌体的吞噬
将DiD标记的未修饰外泌体(ExosCtrl)和CD47修饰的外泌体(ExosCD47)分别与巨噬细胞RAW264.7、肝癌细胞Hepa1-6共孵育。免疫荧光结果显示, 在巨噬细胞RAW264.7中, ExosCD47组细胞对外泌体的吞噬效率低于ExosCtrl组(0.600±0.115 vs 1.333±0.088), 差异有统计学意义(P<0.05, 图 3A)。在肝癌细胞Hepa1-6中, ExosCtrl组和ExosCD47组细胞对外泌体的吞噬效率(1.320±0.029 vs 1.440±0.038)差异无统计学意义(P>0.05, 图 3B)。以上结果表明CD47修饰减少了外泌体被巨噬细胞RAW264.7吞噬。
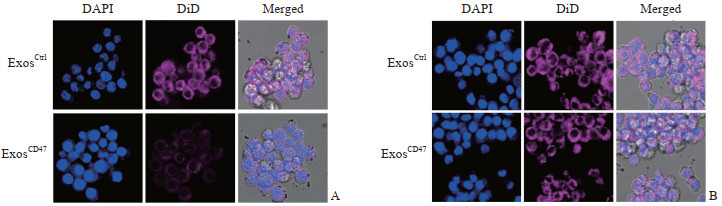
|
图 3 ExosCD47可以逃脱单核吞噬系统的吞噬作用(100×) Fig 3 ExosCD47 can escape phagocytosis of mononuclear phagocyte system (100×) A: Representative images of DiD-labeled unmodified exosomes (ExosCtrl) and CD47 modified exosomes (ExosCD47) in RAW264.7 cells; B: Representative images of DiD-labeled ExosCtrl and ExosCD47 in Hepa1-6 cells. Exosomes were stained with DiD and nuclei were stained with DAPI. The images of fluorescence were collected under confocal laser scanning microscope. DAPI: 4', 6-diamidino-2-phenylindole. |
2.4 修饰外泌体加载PLK1 siRNA促进了肝癌细胞Hepa1-6凋亡
将不同修饰的外泌体加载PLK1 siRNA至肝癌细胞Hepa1-6中, 48 h后收集细胞, 用流式细胞术检测肝癌细胞Hepa1-6凋亡水平。结果(图 4)显示, ExosCtrl-siNC、ExosSP94-CD47-siNC、ExosCtrl-siPLK1、ExosSP94-siPLK1、ExosCD47-siPLK1、ExosSP94-CD47-siPLK1组肝癌细胞凋亡率分别为(0.763±0.064)%、(0.847±0.047)%、(7.873±0.107)%、(14.830±0.215)%、(7.677±0.355)%、(14.930±0.080)%, 治疗性核酸PLK1 siRNA加载后肝癌细胞凋亡率相较于对照组增加(P<0.01)。其中ExosSP94-siPLK1组和ExosSP94-CD47-siPLK1组的细胞凋亡率高于ExosCtrl-siPLK1组(P<0.01), 说明靶向肽SP94修饰后外泌体的肝癌靶向性提高, 致使PLK1 siRNA递送效率提高、肝癌细胞凋亡率增加。由于缺少MPS的因素, ExosCD47-siPLK1组并未显示出对肝癌细胞凋亡的促进效果。
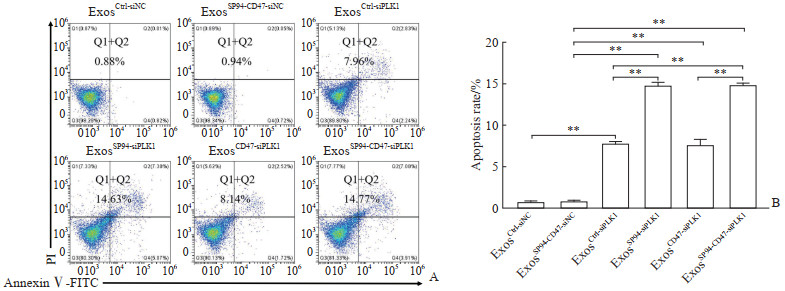
|
图 4 不同修饰的外泌体加载PLK1 siRNA促进肝癌细胞Hepa1-6凋亡 Fig 4 Different modified exosomes loaded with PLK1 siRNA promote apoptosis of Hepa1-6 hepatoma cells A: Flow cytometry detection of the cell apoptosis in ExosCtrl-siNC group (unmodified exosome negative control group), ExosSP94-CD47-siNCgroup (SP94 and CD47 double-modified exosome negative control group), ExosCtrl-siPLK1 group (unmodified exosomes loaded with PLK1 siRNA group), ExosSP94-siPLK1 group (SP94 modified exosomes loaded with PLK1 siRNA group), ExosCD47-siPLK1 group (CD47 modified exosomes loaded with PLK1 siRNA group), and ExosSP94-CD47-siPLK1 group (SP94 and CD47 double-modified exosomes loaded with PLK1 siRNA group); B: Statistical analysis of the cell apoptosis rates in the 6 groups. **P < 0.01. n=3, x±s. PLK1: Polo-like kinase 1; siRNA: Small interfering RNA; PI: Propidium iodide; FITC: Fluorescein isothiocyanate. |
2.5 修饰外泌体加载PLK1 siRNA对小鼠PHC的治疗作用
小动物活体成像结果(图 5A)表明, 与ExosCtrl组(1.581±0.032)相比, ExosSP94-siPLK1组(0.541±0.015)和ExosCD47-siPLK1组(0.346±0.037)的荧光强度均降低, ExosSP94-CD47-siPLK1组(0.131±0.005)荧光强度降低更明显(P<0.01)。离体移植瘤标本测定结果(图 5B)显示, 与ExosCtrl组相比, ExosSP94-siPLK1组和ExosCD47-siPLK1组小鼠肝癌结节的增长减缓, 且ExosSP94-CD47-siPLK1组减缓更为明显。生存分析显示, ExosSP94-CD47-siPLK1组荷瘤鼠的生存时间延长(图 5C)。以上结果显示, SP94和CD47双修饰外泌体可以更好地提高治疗性核酸的靶向性和递送效率, 有效抑制小鼠肝癌结节的生长, 提高对PHC的治疗效果。
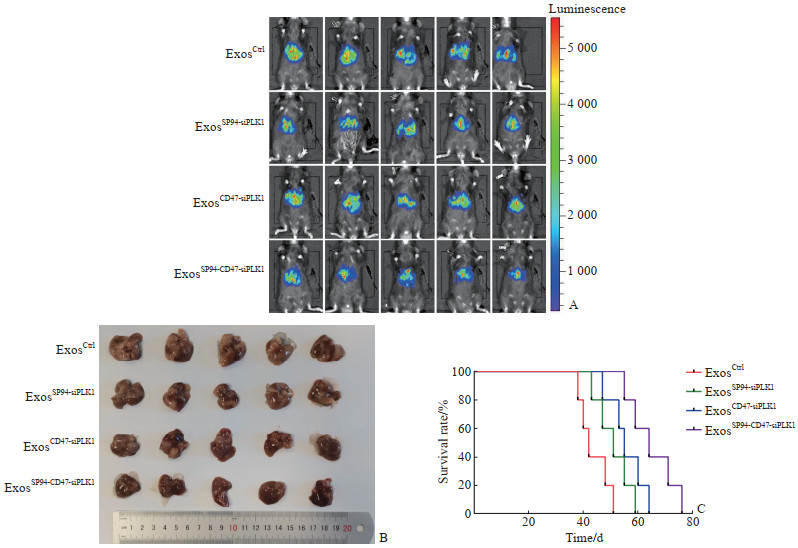
|
图 5 修饰外泌体对小鼠原发性肝癌的治疗效果 Fig 5 Therapeutic effect of modified exosomes on primary hepatic cancer in mice A: Live imaging of mice with primary hepatic cancer in ExosCtrl group (unmodified exosome group), ExosSP94-siPLK1 group (SP94 modified exosomes loaded with PLK1 siRNA group), ExosCD47-siPLK1 group (CD47 modified exosomes loaded with PLK1 siRNA group), and ExosSP94-CD47-siPLK1 group (SP94 and CD47 double-modified exosomes loaded with PLK1 siRNA group) (n=5); B: Representative liver macroscopic views of the primary hepatic cancer mice in the 4 groups (n=5); C: Survival curves of primary hepatic cancer mice in the 4 groups (n=5). PLK1: Polo-like kinase 1; siRNA: Small interfering RNA. |
3 讨论
PHC是我国常见的恶性肿瘤之一, 目前除了手术之外缺乏有效的药物治疗手段及递送方法。外泌体是细胞通过胞吐作用分泌的、具有双层膜结构的细胞外囊泡, 是细胞自然分泌的低免疫原性载体, 可以向动物输送药物或基因[10], 外泌体还有天然嗜肝细胞效应, 具有成为良好肝脏药物递送载体的潜力[11]。然而, 外泌体并不能在肝脏中区分癌细胞和正常细胞, 如何提高其对癌细胞的靶向性、尽可能在杀伤癌细胞的同时避免对正常细胞造成不良影响已成为外泌体工程化改造研究的重要内容。SP94是一种肝癌特异性靶向肽, 可与肝癌细胞特异性结合[12], SP94修饰的工程外泌体能使外泌体具有更强的肝癌靶向能力, 可以很好地解决药物精准递送问题, 增强药物疗效[13]。Zheng等[14]研究设计了一种靶向肝癌可注射纳米颗粒, 可通过SP94表面修饰降低药物使用剂量, 有效治疗肝癌。
此外, 基于外泌体的疗法主要障碍是MPS的吞噬作用限制了其临床应用。本研究设计ExosCD47作为核酸药物的递送载体。CD47主要表达于循环造血干细胞[15]、正常红细胞[16]和大多数类型肿瘤细胞[17]的表面, 它是一种跨膜分子, 与巨噬细胞表面的SIRPα结合产生“不要吃我”信号, 以防止吞噬作用[18]。本研究成功构建了ExosCD47, 并且通过实验验证CD47修饰减少了外泌体被巨噬细胞RAW264.7吞噬, 提高了核酸递送的有效性, 体内分布实验也验证了它可以逃避MPS的吞噬、增加在肿瘤中的分布。
PLK1与肿瘤的发生、发展有密切关系, 在多种癌症如乳腺癌、前列腺癌、卵巢癌等组织中高表达[19]。He等[20]研究发现, let-7b靶向PLK1通过减弱PLK1介导的存活蛋白磷酸化抑制肝细胞癌生长并诱导其凋亡。Cheng等[21]发现, 上调的Setd3促进了小鼠肝癌发生, 但敲低小鼠PLK1减少了Setd3促进的肿瘤发生, 表明抑制PLK1的表达可以有效治疗肝癌。Wang等[22]发现, 用纳米颗粒将PLK1 siRNA递送到肝细胞癌细胞和组织中, 可以降低HepG2细胞在体内的致瘤性。综上, PLK1被认为是潜在的治疗肝癌的新靶点。
本研究以肝癌细胞Hepa1-6为细胞模型, 以不同修饰的外泌体加载PLK1 siRNA后处理细胞, 检测细胞凋亡水平的变化。流式细胞术实验结果显示, 不同修饰的外泌体递送PLK1 siRNA至肝癌细胞都能不同程度地抑制PLK1的表达, 促进肝癌细胞Hepa1-6凋亡, 表明抑制PLK1的表达可以促进细胞凋亡。修饰后外泌体ExosSP94-siPLK1组和ExosSP94-CD47-siPLK1组的细胞凋亡率高于对照组, 说明靶向肽SP94修饰后外泌体的肝癌靶向性提高, 致使PLK1 siRNA递送效率提高、肝癌细胞凋亡率增加。CD47修饰的外泌体可以有效避免被巨噬细胞所吞噬, 从而提高了核酸递送的有效性。但本研究以肝癌细胞Hepa1-6作为模型, 缺少MPS的因素, 所以在体外细胞学实验中CD47修饰外泌体递送核酸与未修饰外泌体递送核酸在检测肝癌细胞凋亡水平上没有明显差异。本研究通过在小鼠体内过表达N-Ras和Akt基因并使2种基因相互作用, 成功诱导了小鼠PHC。本研究结果证实SP94和CD47双修饰外泌体在体内可以更好地提高治疗性核酸PLK1 siRNA的靶向性和递送效率, 有效抑制小鼠结节的生长, 提高对肝癌的治疗效果。但目前仍然缺少大规模量产外泌体的技术, 探索产生足够量外泌体的新技术将是我们未来的主要研究方向。
综上所述, 本研究构建了可以增强肝癌细胞靶向性、降低单核巨噬细胞吞噬作用的工程化外泌体, 通过靶向肽SP94修饰可以使外泌体精准靶向肝癌细胞, 通过CD47修饰可以防止外泌体被巨噬细胞吞噬, SP94和CD47双修饰外泌体加载PLK1 siRNA对小鼠PHC具有良好的治疗效果。此设计可以更好地发挥2种修饰方法组合的叠加效果, 为肝癌的精准治疗及增强药物疗效提供了新思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ANWANWAN D, SINGH S K, SINGH S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873(1): 188314. DOI:10.1016/j.bbcan.2019.188314 |
| [3] |
范芯铷, 刘铭佳, 王庆, 等. 原发性肝癌的发病机制及治疗进展[J]. 肝脏, 2023, 28(4): 391-392. DOI:10.3969/j.issn.1008-1704.2023.04.001 |
| [4] |
曹正聪, 王炜中, 贾博, 等. 靶向脑胶质瘤的Ang外泌体递送系统的构建[J]. 山西医科大学学报, 2023, 54(1): 24-31. DOI:10.13753/j.issn.1007-6611.2023.01.004 |
| [5] |
BARILE L, VASSALLI G. Exosomes: therapy delivery tools and biomarkers of diseases[J]. Pharmacol Ther, 2017, 174: 63-78. DOI:10.1016/j.pharmthera.2017.02.020 |
| [6] |
KALLURI R, LEBLEU V S. The biology, function, and biomedical applications of exosomes[J]. Science, 2020, 367(6478): eaau6977. DOI:10.1126/science.aau6977 |
| [7] |
TOITA R, MURATA M, ABE K, et al. A nanocarrier based on a genetically engineered protein cage to deliver doxorubicin to human hepatocellular carcinoma cells[J]. Chem Commun (Camb), 2013, 49(67): 7442-7444. DOI:10.1039/C3CC44508A |
| [8] |
JIANG Z, SUN H, YU J, et al. Targeting CD47 for cancer immunotherapy[J]. J Hematol Oncol, 2021, 14(1): 180. DOI:10.1186/s13045-021-01197-w |
| [9] |
ZHAO H, SONG S, MA J, et al. CD47 as a promising therapeutic target in oncology[J]. Front Immunol, 2022, 13: 757480. DOI:10.3389/fimmu.2022.757480 |
| [10] |
LIANG Y, DUAN L, LU J, et al. Engineering exosomes for targeted drug delivery[J]. Theranostics, 2021, 11(7): 3183-3195. DOI:10.7150/thno.52570 |
| [11] |
CHEN R, XU X, TAO Y, et al. Exosomes in hepatocellular carcinoma: a new horizon[J]. Cell Commun Signal, 2019, 17(1): 1. DOI:10.1186/s12964-018-0315-1 |
| [12] |
NIE X, LIU Y, LI M, et al. SP94 peptide-functionalized PEG-PLGA nanoparticle loading with cryptotanshinone for targeting therapy of hepatocellular carcinoma[J]. AAPS PharmSciTech, 2020, 21(4): 124. DOI:10.1208/s12249-020-01655-7 |
| [13] |
冯东林, 曹正聪, 何柳, 等. 外泌体包裹GDF15 siRNA靶向治疗肝癌的研究[J]. 山西医科大学学报, 2023, 54(5): 565-572. DOI:10.13753/j.issn.1007-6611.2023.05.001 |
| [14] |
ZHENG Y, JIA R, LI J, et al. Curcumin- and resveratrol-co-loaded nanoparticles in synergistic treatment of hepatocellular carcinoma[J]. J Nanobiotechnology, 2022, 20(1): 339. DOI:10.1186/s12951-022-01554-y |
| [15] |
JAISWAL S, JAMIESON C H M, PANG W W, et al. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009, 138(2): 271-285. DOI:10.1016/j.cell.2009.05.046 |
| [16] |
OLDENBORG P A, ZHELEZNYAK A, FANG Y F, et al. Role of CD47 as a marker of self on red blood cells[J]. Science, 2000, 288(5473): 2051-2054. DOI:10.1126/science.288.5473.2051 |
| [17] |
MATLUNG H L, SZILAGYI K, BARCLAY N A, et al. The CD47-SIRPα signaling axis as an innate immune checkpoint in cancer[J]. Immunol Rev, 2017, 276(1): 145-164. DOI:10.1111/imr.12527 |
| [18] |
DU J, WAN Z, WANG C, et al. Designer exosomes for targeted and efficient ferroptosis induction in cancer via chemo-photodynamic therapy[J]. Theranostics, 2021, 11(17): 8185-8196. DOI:10.7150/thno.59121 |
| [19] |
ILMA S, NEHA B, MUSTAFA H G, et al. Polo-like kinase 1 as an emerging drug target: structure, function and therapeutic implications[J]. J Drug Target, 2021, 29(2): 168-184. DOI:10.1080/1061186X.2020.1818760 |
| [20] |
HE Z, DENG W, JIANG B, et al. Hsa-let-7b inhibits cell proliferation by targeting PLK1 in HCC[J]. Gene, 2018, 673: 46-55. DOI:10.1016/j.gene.2018.06.047 |
| [21] |
CHENG M, YANG Q, LIU Y, et al. SETD3 methyltransferase regulates PLK1 expression to promote in situ hepatic carcinogenesis[J]. Front Oncol, 2022, 12: 882202. DOI:10.3389/fonc.2022.882202 |
| [22] |
WANG D, CHANG R, WANG G, et al. Polo-like kinase 1-targeting chitosan nanoparticles suppress the progression of hepatocellular carcinoma[J]. Anticancer Agents Med Chem, 2017, 17(7): 948-954. DOI:10.2174/1871520616666160926111911 |
 2023, Vol. 44
2023, Vol. 44


