颅内动脉粥样硬化性狭窄(intracranial atheroscleroticstenosis, ICAS)是导致缺血性脑卒中的重要原因之一, 其发病率在不同人种之间差异明显, 亚裔人种ICAS相关卒中患者占所有缺血性脑卒中患者的30%~50%[1-4], 欧美人群中仅占8%~10%[4-7]。颅内支架植入术与积极药物干预治疗颅内动脉狭窄试验(SAMMPRIS研究)和Vitesse颅内支架治疗缺血性脑卒中的研究(VISSIT研究)结果提示, 重度ICAS患者应用强化药物治疗的效果优于支架成形术联合药物治疗, 但该2项研究的术者经验、手术时机、病变特点等都存在异质性[8-9]。中国血管成形及支架植入术治疗症状性重度颅内动脉狭窄的研究(CASSISS研究)采用更加严格的纳入标准评估了Wingspan支架联合标准药物治疗与单独使用标准药物治疗的有效性, 结果显示接受支架联合药物治疗组和仅接受药物治疗组患者的30 d内卒中或死亡和30 d至1年动脉区域卒中发生率差异无统计学意义, 同时也提示支架植入在ICAS中的潜在优势似乎被围手术期的缺血和出血风险抵消[10]。因此, 如何降低ICAS患者围手术期并发症发生率对于提高疗效至关重要。我中心采用新型输送型球囊扩张导管(Fastunnel导管)治疗ICAS, 成功地简化了手术步骤, 取得了良好效果, 现报告如下。
1 资料和方法 1.1 病例资料纳入2022年11月至2023年2月于我院接受颅内动脉狭窄球囊扩张+支架成形术治疗的患者。纳入标准: (1)年龄为18~80岁; (2)经抗血小板治疗无效或脑侧支循环代偿不良、责任血管供血区域存在低灌注的症状性ICAS患者; (3)数字减影血管造影检查示颅内责任血管狭窄程度>70%且<99%;(4)最近1次短暂性脑缺血发作时间不限或最近1次缺血性脑卒中发病至治疗时间>2周。排除标准: (1)非动脉粥样硬化性狭窄; (2)有无法纠正的出血倾向; (3)对肝素、阿司匹林、造影剂、麻醉剂等过敏或可能过敏。本研究通过海军军医大学(第二军医大学)第一附属医院伦理委员会审批。
1.2 器械与材料术中采用Fastunnel®输送型球囊扩张导管(中国加奇生物科技有限公司), 该导管为远端末端处带有球囊的同轴导管, 中间部分的鲁尔腔内径有0.017英寸(1英寸=2.54 cm)及0.021英寸2种型号, 可适配于多款支架系统。支架采用目前国家药品监督管理局批准的颅内专用支架或获批进行临床研究的颅内支架。
1.3 手术过程与观察指标所有患者手术均在全身麻醉下进行。患者经桡动脉或股动脉置入动脉鞘, 全身肝素化。常规先行脑血管造影评估狭窄病变及其远近端血管情况、侧支代偿情况等。将6F导引导管沿导丝输送至病变血管近端。在路图下, 根据参考血管直径选择合适型号的Fastunnel导管, 在微导丝辅助下小心超选通过病变处至远端正常血管, 球囊部分覆盖病变部位; 缓慢充盈球囊, 泄压后即刻造影观察血管狭窄段血流改善情况; 撤出微导丝, 选择合适尺寸的支架通过Fastunnel导管输送至病变部位, 支架远近端完全覆盖病变, 回撤Fastunnel导管缓慢释放支架, 造影确认支架打开情况及残余狭窄程度, 必要时进行球囊后扩张。确认支架贴壁良好且无明显残余狭窄, 即撤出所有手术器械, 结束手术。
治疗的过程定义为导引导管到位至所有介入器械(包括Fastunnel导管与支架释放装置等)撤出导引导管, 记录手术时长(治疗过程的总时长)、治疗期间射线暴露时间、辐射剂量、剂量面积乘积(dose area product, DAP)等数据。
1.4 围手术期管理患者术前至少连续5 d接受双联抗血小板药物治疗, 并根据血栓弹力图或细胞色素P450家族成员2C19(cytochrome P450 family 2 subfamily C member 19, CYP2C19)基因检测结果调整抗血小板治疗方案。根据引起动脉粥样硬化的危险因素进行针对性药物治疗。
1.5 统计学处理应用SPSS 22.0软件进行数据分析。计量资料以范围和x±s表示, 计数资料以例数和百分数表示。
2 结果 2.1 患者基线资料共10例ICAS患者入组, 其中男6例, 女4例; 年龄为53~75岁, 平均年龄为(62.7±6.7)岁。脑卒中8例, 短暂性脑缺血发作2例。既往高血压病史6例, 糖尿病史4例, 高脂血症病史4例, 吸烟史5例, 饮酒史5例。
10例患者均存在症状性颅内动脉重度狭窄, 病变位于颈内动脉3例, 大脑中动脉4例, 椎动脉1例, 基底动脉2例。术前数字减影血管造影测量病变血管狭窄程度为70%~90%, 平均为(81.0±7.3)%; 病变血管长度为3.70~13.07 mm, 平均为(7.54±2.54)mm。患者临床资料详见表 1。
|
|
表 1 10例颅内动脉粥样硬化性狭窄患者的临床资料 Tab 1 Clinical data of 10 patients with intracranial atherosclerotic stenosis |
2.2 手术治疗情况及围手术期并发症情况
2例患者采用经桡动脉入路治疗, 8患者采用经股动脉入路治疗。所有患者均成功接受球囊扩张+支架成形术。术后残余狭窄程度为0~30%, 平均为(10.5±10.7)%。手术时长为16~65 min, 平均为(37.3±18.2)min; 治疗期间射线暴露时间为9~23 min, 平均为(15.9±4.7)min; 辐射剂量为1 381~4 901 mGy, 平均为(2 643.7±1 131.7)mGy; DAP为5 707~38 112 μGy·m2, 平均为(17 526.8±10 809.5)μGy·m2。所有患者均未发生围手术期缺血或出血相关并发症。典型病例手术过程及影像学资料见图 1。
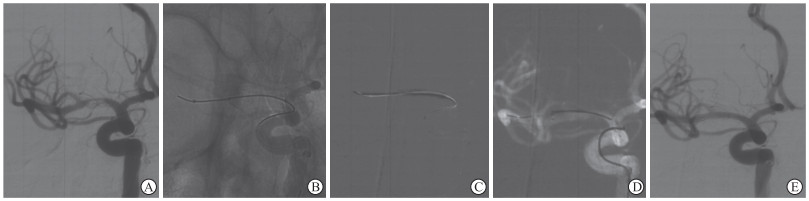
|
图 1 1例大脑中动脉M1段重度狭窄患者的影像学资料 Fig 1 Imaging data of a patient with severe stenosis of M1 segment of middle cerebral artery A 60-year-old male patient with sudden left limb weakness and slurred speech for 2 months. A: Digital subtraction angiography showed that severe stenosis was seen in the M1 segment of the right middle cerebral artery, with about 85% of stenosis severity; B: The balloon catheter was delivered to the correct location; C: The balloon was filled slowly; D: The stent was delivered to the correct location and successfully released; E: Postoperative angiography showed that the stent was well adhered to the wall without significant residual stenosis. |
3 讨论
既往文献报道ICAS围手术期并发症发生率为0~24.1%[10-13], 其中出血相关并发症中导丝导管穿孔(占45%~75%)[11, 13]、缺血相关并发症中远端栓塞和夹层(约占20%)[11, 14]与术中手术操作相关。传统的颅内狭窄球囊扩张+支架成形术, 需要通过反复7次使用交换技术(微导丝-交换导丝-微导管-球囊-微导管-交换导丝-颅内支架)进行球囊扩张和支架成形操作, 交换过程随着中间张力的变化, 导丝或导管头端容易损伤血管造成穿孔, 引起出血相关并发症, 或者导致夹层引起缺血相关并发症。同时器械反复通过病变部位可能导致斑块脱落造成远端栓塞, 引起缺血相关并发症。这些相关并发症常会造成永久性神经功能障碍, 甚至危及患者生命。Fastunnel导管将球囊导管和支架输送导管一体化整合, 减少了传统操作中的交换步骤, 无须进行导管交换操作即可完成治疗, 理论上可以降低因反复交换操作带来的并发症的发生风险。本研究入组的10例患者均无器械穿孔、夹层、远端栓塞等并发症发生, 提示Fastunnel导管具有较好的安全性, 但仍需要进一步通过对照研究验证。
介入治疗过程中临床医师和患者都处于射线辐射环境, 研究表明介入手术辐射暴露可使患者出现红斑、脱发等并发症, 严重者甚至出现DNA损伤[15-16], 且长时间的辐射暴露还会增加介入医师发生白内障、脑癌等疾病的风险[17-18]。因此, 减少医护人员及患者在手术期间的辐射暴露意义重大。使用Fastunnel导管, 通过简化手术操作步骤, 理论上可以缩短手术时长, 减少患者与医护人员的辐射暴露时间, 降低辐射损伤。本研究仅观察了10例患者的相关指标, 未设对照进行比较分析, 后期将扩大样本量、开展对照研究对实际效果进行验证。
本研究结果提示, 使用Fastunnel导管可以简化手术步骤, 也可能在缩短手术时间和减少医患辐射暴露方面存在优势, 同时Fastunnel导管具有较好的安全性, 但还需要前瞻性临床对照试验进一步证实。
| [1] |
WANG Y, ZHAO X, LIU L, et al. Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China: the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke, 2014, 45(3): 663-669. DOI:10.1161/STROKEAHA.113.003508 |
| [2] |
SHARMA V K, TSIVGOULIS G, TEOH H L, et al. Stroke risk factors and outcomes among various Asian ethnic groups in Singapore[J]. J Stroke Cerebrovasc Dis, 2012, 21(4): 299-304. DOI:10.1016/j.jstrokecerebrovasdis.2010.08.010 |
| [3] |
CHUNG J W, PARK S H, KIM N, et al. Trial of ORG 10172 in acute stroke treatment (TOAST) classification and vascular territory of ischemic stroke lesions diagnosed by diffusion-weighted imaging[J]. J Am Heart Assoc, 2014, 3(4): e001119. DOI:10.1161/JAHA.114.001119 |
| [4] |
QURESHI A I, CAPLAN L R. Intracranial atherosclerosis[J]. Lancet, 2014, 383(9921): 984-998. DOI:10.1016/S0140-6736(13)61088-0 |
| [5] |
SACCO R L, KARGMAN D E, GU Q, et al. Race-ethnicity and determinants of intracranial atherosclerotic cerebral infarction. The Northern Manhattan Stroke Study[J]. Stroke, 1995, 26(1): 14-20. DOI:10.1161/01.str.26.1.14 |
| [6] |
WONG L K S. Global burden of intracranial atherosclerosis[J]. Int J Stroke, 2006, 1(3): 158-159. DOI:10.1111/j.1747-4949.2006.00045.x |
| [7] |
WHITE H, BODEN-ALBALA B, WANG C, et al. Ischemic stroke subtype incidence among whites, blacks, and Hispanics: the Northern Manhattan Study[J]. Circulation, 2005, 111(10): 1327-1331. DOI:10.1161/01.CIR.0000157736.19739.D0 |
| [8] |
DERDEYN C P, CHIMOWITZ M I, LYNN M J, et al. Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis (SAMMPRIS): the final results of a randomised trial[J]. Lancet, 2014, 383(9914): 333-341. DOI:10.1016/S0140-6736(13)62038-3 |
| [9] |
PADALIA A, SAMBURSKY J A, SKINNER C, et al. Percutaneous transluminal angioplasty with stent placement versus best medical therapy alone in symptomatic intracranial arterial stenosis: a best evidence review[J]. Cureus, 2018, 10(7): e2988. DOI:10.7759/cureus.2988 |
| [10] |
GAO P, WANG T, WANG D, et al. Effect of stenting plus medical therapy vs medical therapy alone on risk of stroke and death in patients with symptomatic intracranial stenosis: the CASSISS randomized clinical trial[J]. JAMA, 2022, 328(6): 534-542. DOI:10.1001/jama.2022.12000 |
| [11] |
FIORELLA D, DERDEYN C P, LYNN M J, et al. Detailed analysis of periprocedural strokes in patients undergoing intracranial stenting in Stenting and Aggressive Medical Management for Preventing Recurrent Stroke in Intracranial Stenosis (SAMMPRIS)[J]. Stroke, 2012, 43(10): 2682-2688. DOI:10.1161/STROKEAHA.112.661173 |
| [12] |
KANG K, ZHANG Y, SHUAI J, et al. Balloon-mounted stenting for ICAS in a multicenter registry study in China: a comparison with the WEAVE/WOVEN trial[J]. J Neurointerv Surg, 2021, 13(10): 894-899. DOI:10.1136/neurintsurg-2020-016658 |
| [13] |
GAO P, ZHAO Z, WANG D, et al. China Angioplasty and Stenting for Symptomatic Intracranial Severe Stenosis (CASSISS): a new, prospective, multicenter, randomized controlled trial in China[J]. Interv Neuroradiol, 2015, 21(2): 196-204. DOI:10.1177/1591019915581778 |
| [14] |
KLAIL T, KURMANN C, KAESMACHER J, et al. Safety and efficacy of carotid artery stenting with the CGuard double-layer stent in acute ischemic stroke[J]. Clin Neuroradiol, 2023, 33(1): 237-244. DOI:10.1007/s00062-022-01209-3 |
| [15] |
IMANISHI Y, FUKUI A, NIIMI H, et al. Radiation-induced temporary hair loss as a radiation damage only occurring in patients who had the combination of MDCT and DSA[J]. Eur Radiol, 2005, 15(1): 41-46. DOI:10.1007/s00330-004-2459-1 |
| [16] |
VISWESWARAN S, JOSEPH S, VINAY HEGDE S, et al. DNA damage and gene expression changes in patients exposed to low-dose X-radiation during neuro-interventional radiology procedures[J]. Mutat Res Toxicol Environ Mutagen, 2019, 844: 54-61. DOI:10.1016/j.mrgentox.2019.05.011 |
| [17] |
WENZL T B. Increased brain cancer risk in physicians with high radiation exposure[J]. Radiology, 2005, 235(2): 709-711. DOI:10.1148/radiol.2352041787 |
| [18] |
ALHASAN A S, AALAM W A. Eye lens opacities and cataracts among physicians and healthcare workers occupationally exposed to radiation: a systematic review and meta-analysis[J]. Saudi Med J, 2022, 43(7): 665-677. DOI:10.15537/smj.2022.43.7.20220022 |
 2023, Vol. 44
2023, Vol. 44


