2. 海军海上防险救生第一支队, 青岛 266000;
3. 海军军医大学(第二军医大学)第一附属医院高压氧科, 上海 200433
2. No.1 Marine Rescue Detachment of PLA Navy, Qingdao 266000, Shandong, China;
3. Department of Hyperbaric Oxygen, The First Affiliated Hospital of Naval Medical University(Second Military Medical University), Shanghai 200433, China
减压病是限制潜水作业效率和威胁潜水作业人员生命安全的核心医学问题之一[1]。减压过程中体内形成的气泡一方面通过阻塞血管和挤压周围组织,造成组织缺血缺氧损伤和机械性损伤,另一方面由于气泡表面存在表面张力和电动力层,能传导机械力、使细胞外液蛋白在气-液界面聚集并引起其结构和功能改变、与细胞接触后造成细胞膜上蛋白结构改变并引起离子通道活性变化等,最终导致细胞发生一系列功能改变甚至死亡[1]。除减压病外,临床手术和静脉输液操作时气体通过血液循环进入体内形成气泡导致机体损伤的情况也时有发生[2-3]。离体细胞气泡触碰技术是开展气泡损伤相关疾病机制研究的重要技术手段,本研究设计了一种离体细胞气泡触碰装置,可按需生成目标大小的微气泡,并恰当地将其与离体培养细胞进行触碰,以模拟气泡在体内的致病条件,为深入研究气泡引起的相关疾病的发病机制和防治措施奠定基础。
1 材料和方法 1.1 主要设备与试剂酶标检测仪(美国BioTek公司),荧光显微镜(德国Leica公司);CCK-8检测试剂盒(货号CK04)购自日本同仁化学研究所,PI染色试剂盒(货号40711ES)购自上海翊圣生物科技有限公司,内皮细胞培养基(endothelial cell medium,ECM;货号1001)购自美国ScienCell公司。
1.2 原代大鼠肺微血管内皮细胞(pulmonary microvascular endothelial cell,PMVEC)的培养与鉴定体重70~80 g的清洁级雄性SD大鼠[上海必凯科翼生物科技有限公司,动物生产许可证号:SCXY(沪)2018-0006]经戊巴比妥钠腹腔注射麻醉后,用75%乙醇对其胸腹部进行消毒,共3次,每次2 min。沿腹中线开腹,剪断腹主动脉和静脉,减少循环血液。打开胸腔,充分暴露心肺,在左心房剪开一小口,经右心室注入含5 U肝素的预冷PBS 5 mL,冲洗肺血管内残余血细胞。分离肺并置于预冷的PBS中漂洗3次。将肺用0.25%胰酶37 ℃消化10 min,其间每隔3 min轻轻摇匀1次,然后加入适量FBS终止消化,并用PBS漂洗3次。沿肺叶边缘剪取宽约1 mm组织,并剪成1 mm3小块,将组织块均匀接种到培养皿,倒置培养皿培养10 min,弃除多余培养基,使组织块牢固吸附于培养皿上。然后沿培养皿边缘轻轻加入1 mL ECM,4 h后轻轻洗掉未贴壁组织块和培养基中细胞,48 h后冲掉所有组织块,加入新的ECM继续培养,之后每2 d换液1次,待细胞长满90%时可进行后续实验。在显微镜下观察24、48和96 h时细胞的生长情况。采用内皮细胞特异性抗原血管性血友病因子(von Willebrand factor,vWF)免疫荧光染色鉴定细胞纯度,镜下随机选取5个视野,计算阳性细胞百分比。
1.3 PMVEC气泡触碰方法使用自行研制的离体细胞气泡触碰装置及技术(ZL 201920274278.6)[4]建立细胞损伤模型。该装置包括气泡生成注射器、细胞培养皿和打孔装置(图 1),通过改变气泡生成注射器末端直径大小可以获得不同直径大小的气泡。将PMVEC接种到细胞培养皿的底部,待细胞长满后向皿内注满含10% FBS的培养基,然后盖好皿盖,并将皿倒置,此时细胞层位于顶部。利用打孔装置在皿侧壁上打孔,使用气泡生成注射器匀速向皿内注入不同直径的气泡,气泡在浮力作用下上浮与细胞层进行触碰。气泡注射结束后将细胞培养皿置于37 ℃继续培养,并计算触碰时间。触碰结束后弃去触碰培养基,换用正常ECM,置于细胞培养箱中培养,并进行后续检测。以直径为0.5、1.0、1.5、2.0 mm的气泡分别触碰1、2、3、4 h,触碰结束后2 h采用PI染色检测细胞损伤情况,采用CCK-8法检测细胞活力。

|
图 1 离体细胞气泡触碰装置 Fig 1 Cell bubble contact device A: Sketch of culture dish; B: Sketch of bubble injector; C: Sketch of punching device; D: Cell bubble contact (vertical view); E: Cell bubble contact (side view). |
1.4 细胞损伤检测
气泡触碰结束后2 h,使用质量浓度为5 μg/mL的PI工作液孵育10 min,在荧光显微镜下观察细胞染色情况。
1.5 细胞活力检测气泡触碰结束后2 h,向培养基中加入10% CCK-8试剂,置于细胞培养箱中避光孵育2 h后,用酶标仪检测各孔光密度(D)值。根据(D实验组-D空白组)/(D对照组-D空白组)×100%计算细胞存活率。
1.6 统计学处理应用SPSS 21.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析,多重比较采用最小显著性差异法(least significant difference,LSD)-t检验。检验水准(α)为0.05。
2 结果 2.1 大鼠PMVEC的培养及鉴定如图 2所示,培养24 h时大鼠肺组织块周围开始逐渐有短梭形或多角形贴壁细胞爬出;48 h时组织块周围爬出的细胞进一步增多;96 h时组织块周围已长满细胞,呈鹅卵石样镶嵌状排布,具有典型的“铺路石”样形态。使用vWF对细胞进行标记和鉴定,vWF阳性细胞占比超过95%。
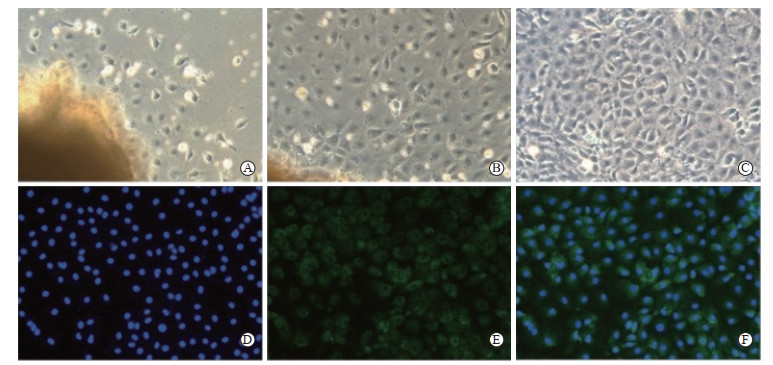
|
图 2 大鼠PMVEC的培养及鉴定(200×) Fig 2 Culture and identification of rat PMVEC (200×) A-C: Morphology of the cells cultured for 24, 48, and 96 h, respectively, which were observed by light microscopy; D-F: Cell identification with vWF staining (D: DAPI; E: vWF; F: Merged) by fluorescence microscopy. PMVEC: Pulmonary microvascular endothelial cell; vWF: von Willebrand factor; DAPI: 4', 6-diamidino-2-phenylindole. |
2.2 不同直径气泡触碰不同时间对大鼠PMVEC的损伤作用
PI染色(图 3)显示,0.5 mm直径的气泡触碰1、2、3、4 h均未导致PMVEC明显损伤,1.0、1.5和2.0 mm直径的气泡触碰1、2、3、4 h均能导致死亡的PMVEC(呈褐色荧光)明显增加,且气泡直径越大、触碰时间越长,死亡的PMVEC越多。

|
图 3 PI染色观察不同直径气泡触碰不同时间大鼠PMVEC的损伤情况 Fig 3 Rat PMVEC injuries after contacting with different diameter bubbles for different durations detected by PI staining PI: Propidium iodide; PMVEC: Pulmonary microvascular endothelial cell. |
2.3 不同直径气泡触碰不同时间对大鼠PMVEC活力的影响
CCK-8细胞活力检测结果(表 1)显示,0.5 mm直径的气泡触碰1、2、3、4 h后PMVEC的活力下降,但与对照组比较差异无统计学意义(P均>0.05);1.0、1.5和2.0 mm直径的气泡触碰1、2、3、4 h后PMVEC的活力均低于对照组,差异有统计学意义(P均<0.01),其中2.0 mm直径的气泡触碰时间>3 h对PMVEC的损伤较大,触碰3 h时的细胞存活率为(84.27±1.35)%。
|
|
表 1 不同直径气泡触碰不同时间后大鼠PMVEC活力的变化 Tab 1 Viability of rat PMVECs after contacting with different diameter bubbles for different durations |
3 讨论
离体细胞气泡触碰技术是开展气泡损伤机制相关研究的重要技术手段。利用适当的装置制备直径可控并能稳定存在的微气泡与离体培养细胞进行触碰,以及触碰后选择合适的指标评估气泡的损伤效果是该技术需要重点解决的问题。本研究采用注射法产生气泡,通过控制气泡生成注射器末端内径大小产生直径稳定的气泡,气泡直径与注射器末端内径大小呈正相关[4]。
气泡在液体中稳定存在需要液体中含有适当的表面活性物质,以降低气泡表面张力。血清中含有一定的表面活性物质,为明确血清浓度与气泡稳定性之间的关系,我们在前期研究中分别观察了纯培养基和分别含1%、5%、10%、20%血清的培养基中气泡的稳定性。结果发现,在纯培养基中注入气泡后,气泡迅速融合成一个大气泡,而在含1%、5%、10%、20%血清的培养基中气泡均能稳定存在且持续时间>4 h,提示只需在培养基中加入正常量的血清即可使气泡稳定存在。
为评估气泡触碰对PMVEC的损伤作用,研究中使用PI染色检测细胞死亡情况,用CCK-8法检测细胞活力。结果发现,气泡触碰后PI染色阳性PMVEC增加而细胞活力下降。鉴于2.0 mm直径气泡触碰3 h时PMVEC并未过度损伤,提示细胞凋亡可能未参与气泡触碰所致细胞损伤过程,气泡触碰导致PMVEC损伤的具体机制需要进一步探索。
血管内皮细胞是血液中各种成分直接接触的界面,也是减压病血管内气泡直接损伤的靶细胞[5]。血管内皮细胞损伤导致血管壁通透性升高、血管舒缩障碍、炎症反应激活和凝血异常,启动或加重减压病损伤[6]。肺是减压后体内形成气泡排出的部位,体内形成的气泡随血液循环进入右心系统后,随着右心室泵血以微气泡的形式进入肺部,并随着气体交换扩散进入肺泡后排出体外[7]。由于肺微血管直径较小,气泡在其内部流动时能充分与血管内皮细胞接触,并且血流状态的改变会直接对其造成损伤,研究发现患减压病的潜水员和动物均有肺部损伤症状[8-9],因此PMVEC也成为研究减压病气泡损伤血管内皮细胞最具代表性的细胞之一。
影响离体细胞气泡触碰损伤效果的关键因素是气泡直径和气泡触碰时间。本研究观察了0.5、1.0、1.5、2.0 mm直径气泡分别触碰1、2、3、4 h对PMVEC的损伤作用,结果表明,0.5 mm直径的气泡不能对PMVEC造成损伤,而1.0、1.5和2.0 mm直径的气泡触碰1、2、3、4 h均可导致PMVEC损伤(P均<0.01),并且2.0 mm直径的气泡触碰时间>3 h时损伤较大,触碰3 h时细胞存活率为(84.27±1.35)%,适于观察保护措施效果研究。
综上所述,本研究采用自制离体培养细胞气泡触碰装置,以大鼠PMVEC为研究对象系统观察了不同直径气泡触碰不同时间对PMVEC的损伤作用,为气泡损伤相关疾病发病机制的研究奠定了基础。
| [1] |
MITCHELL S J, BENNETT M H, MOON R E. Decompression sickness and arterial gas embolism[J]. N Engl J Med, 2022, 386(13): 1254-1264. DOI:10.1056/NEJMra2116554 |
| [2] |
SWENSON K E, SHALLER B D, DUONG K, et al. Systemic arterial gas embolism (SAGE) as a complication of bronchoscopic lung biopsy: a case report and systematic literature review[J]. J Thorac Dis, 2021, 13(11): 6439-6452. DOI:10.21037/jtd-21-717 |
| [3] |
VILOS G A, HUTSON J R, SINGH I S, et al. Venous gas embolism during hysteroscopic endometrial ablation: report of 5 cases and review of the literature[J]. J Minim Invasive Gynecol, 2020, 27(3): 748-754. DOI:10.1016/j.jmig.2019.05.003 |
| [4] |
黄国阳, 郑娟, 周田俊克, 等. 一种气泡生成注射器及包含其的离体细胞气泡触碰组件: 201920274278.6[P]. 2020-02-14.
|
| [5] |
ZHANG K, WANG D, JIANG Z, et al. Endothelial dysfunction correlates with decompression bubbles in rats[J]. Sci Rep, 2016, 6: 33390. DOI:10.1038/srep33390 |
| [6] |
FISHER M. Injuries to the vascular endothelium: vascular wall and endothelial dysfunction[J]. Rev Neurol Dis, 2008, 5(Suppl 1): S4-S11. |
| [7] |
RANDSØE T, HYLDEGAARD O. Treatment of micro air bubbles in rat adipose tissue at 25 kPa altitude exposures with perfluorocarbon emulsions and nitric oxide[J]. Eur J Appl Physiol, 2014, 114(1): 135-146. DOI:10.1007/s00421-013-2749-x |
| [8] |
YU X, XU J, LIU W, et al. Protective effects of pulmonary surfactant on decompression sickness in rats[J]. J Appl Physiol(1985), 2021, 130(2): 400-407. DOI:10.1152/japplphysiol.00807.2020 |
| [9] |
ARJOMAND A, HOLM J R, GERBINO A J. Severe decompression sickness associated with shock and acute respiratory failure[J]. Case Rep Crit Care, 2020, 2020: 8855060. DOI:10.1155/2020/8855060 |
 2023, Vol. 44
2023, Vol. 44


