患者男,54岁,因“恶心、呕吐2周,血肌酐升高4 d”于2022年8月12日收入我科治疗。2022年7月初患者因全身皮肤弥漫性红色丘疹、斑块,伴脱屑、瘙痒就诊于我院皮肤科门诊,诊断为斑块型银屑病(中重度),因既往激素等治疗无效,拟给予司库奇尤单抗(可善挺®,辉瑞制药有限公司)治疗,用药前肝肾功能和尿常规检查均未见异常,血肌酐72 μmol/L。因患者既往有肺结核病史,结核感染T细胞检测阳性,胸部CT示“两肺多发实性小结节,右上肺为著,右上肺索条影”,2022年7月18日上海市肺科医院肺结核科会诊后建议给予预防性抗结核治疗。患者于2022年7月18日开始注射司库奇尤单抗(300 mg,每周1次皮下注射),同时口服异烟肼(0.3 g,每日1次)、利福平(0.45 g,每日1次)预防性抗结核。首次用药后患者即感乏力,4 d后出现恶心、呕吐,呕吐物为胃液,并解酱油色尿1次,后尿色转清,7月24日患者自行停用异烟肼、利福平。7月25日和8月1日2次皮下注射司库奇尤单抗300 mg。患者恶心、纳差症状加重,并逐渐出现双下肢水肿、少尿。2022年8月9日就诊我院肾内科门诊,查血常规:白细胞计数9.37×109/L,中性粒细胞计数7.76×109/L,血红蛋白124 g/L,血小板计数258×109/L;血生化:白蛋白32 g/L,尿素36.3 mmol/L,肌酐1 812 μmol/L,尿酸748 mmol/L,钙1.81 mmol/L,磷1.63 mmol/L。诊断为“急性肾损伤(acute kidney injury,AKI)3期”,予血液透析治疗,8月12日收治入院。
1997年患者曾因肺结核行抗结核治疗,个人史、家族史无特殊。入院后体格检查:血压120/74 mmHg(1 mmHg=0.133 kPa),心率80 min-1,体温36.4 ℃,双下肢皮肤大片色素及散在陈旧性鳞屑样皮疹,皮肤巩膜无黄染,心律齐,双肺呼吸音清,腹软,无移动性浊音,双肾区无叩痛,双下肢轻度水肿。实验室检查血常规:白细胞计数7.77×109/L,中性粒细胞计数6.15×109/L,血红蛋白117 g/L,血小板计数372×109/L。尿常规:蛋白质(+),红细胞计数6.8/高倍镜视野,白细胞计数11.4/高倍镜视野,畸形红细胞0.2(<0.3),24 h尿蛋白定量269.5 mg(尿量500 mL),尿β2微球蛋白升高(27.41 mg/L),尿α1微球蛋白升高(37.7 mg/L),尿N-乙酰-β-D氨基葡萄糖苷酶升高(39.6 IU/L),尿纤维蛋白降解产物升高(5.32 mg/L)。血生化:白蛋白28 g/L,尿素23.5 mmol/L,肌酐1 317 μmol/L,尿酸460 μmol/L,二氧化碳结合力18 mmol/L,钙1.85 mmol/L,磷2.26 mmol/L,丙氨酸转氨酶17 U/L,天冬氨酸转氨酶13 U/L,乳酸脱氢酶225 U/L,总胆红素5.4 μmol/L,直接胆红素1.9 μmol/L,总胆固醇5.16 mmol/L,甘油三酯1.53 mmol/L,血清铁下降(4.947 μmol/L),转铁蛋白饱和度下降(18.5%),铁蛋白升高(333.39 μg/L)。脑钠肽123.33 pg/mL,超敏CRP 17.5 mg/L。甲状腺功能正常,甲状旁腺素187 pg/mL。凝血功能:凝血酶原时间14.8 s,活化部分凝血活酶时间39.8 s,国际标准化比值1.16,纤维蛋白原7.3 g/L,D-二聚体1.03 μg/mL。免疫学检查:IgG 7.30 g/L(正常参考值7.51~15.6 g/L),IgM 0.39 g/L(正常参考值0.46~3.04 g/L),IgE 244 IU/mL(正常值<165 IU/mL),血补体C3和C4、抗链球菌溶血素O、血清免疫固定电泳均未见异常,抗核抗体、抗可提取性核抗原多肽抗体谱、抗中性粒细胞胞质抗体、抗肾小球基底膜抗体均为阴性。结核感染T细胞检测阳性。超声检查示双肾大小、形态、位置均正常,包膜光整,皮质回声增强,皮髓质分界欠清,输尿管、膀胱未见异常。肾组织活检病理检查,光镜下见18~19个小球,未见球性硬化和节段硬化;肾小球系膜细胞增殖及系膜基质局灶节段性轻度增生,未见毛细血管内增生和炎细胞浸润;系膜区、上皮下及内皮下未见嗜复红蛋白沉积;毛细血管壁无增厚;近端肾小管刷状缘普遍消失、管腔轻度扩张,肾小管上皮细胞部分肿胀、部分扁平,部分肾小管上皮细胞坏死脱落,形成裸膜,少数可见上皮细胞再生,偶见小管炎;肾小管未见明显萎缩,可见较多球状、颗粒状、粉末状血红蛋白管型和少量上皮细胞管型(图 1A~1C);肾间质弥漫性水肿,数处灶性炎细胞浸润,面积约占5%,以单个核淋巴细胞为主,偶见嗜酸性粒细胞;小动脉未见明显异常。免疫荧光检查示IgG、IgA、IgM、C3、C4、C1q、κ轻链、λ轻链、IgG1、IgG2、IgG3、IgG4均为阴性。免疫组织化学染色检测结果(图 1D)示血红蛋白管型(┼┼)。电镜检查见肾小球基底膜无明显增厚,足突节段性融合,未见确切电子致密物沉积;肾小管上皮细胞空泡变性,偶见管型,其内可见大量高电子密度物质(图 1E、1F)。诊断:(1)AKI 3期、急性肾小管坏死、血红蛋白管型肾病;(2)斑块状银屑病;(3)陈旧性肺结核。治疗上予血液透析3次,碳酸氢钠碱化尿液及口服复方α酮酸片、金水宝片保肾支持治疗。当患者肾功能好转,尿量明显增加(每日可达3 000~4 000 mL)后遂停止血液透析。患者于2022年8月17日出院,规律门诊随访期间尿量恢复正常,肾功能明显改善。2022年9月14日复查血肌酐为132 μmol/L,11月9日复查血肌酐为100 μmol/L,尿常规未见异常。
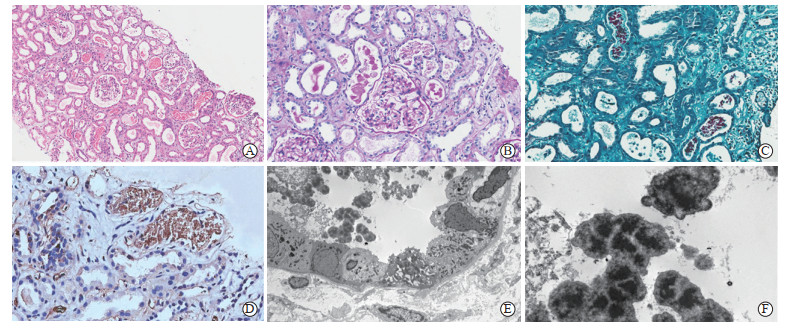
|
图 1 患者肾脏活检病理表现 A:近端肾小管刷状缘消失,管腔扩张,多处肾小管腔内可见血红蛋白管型(苏木精-伊红染色,100×);B:肾小球系膜细胞及基质轻度局灶节段增生,少数肾小管上皮细胞脱落,血红蛋白管型形态不一(过碘酸希夫染色,200×);C:肾间质水肿,肾小管腔内染色不一的血红蛋白管型(Masson染色,200×);D:血红蛋白免疫组织化学染色见管型阳性(400×);E:电镜见肾小管上皮细胞空泡变性,管腔内见管型(4 000×);F:电镜见管型内大量高电子密度物质(15 000×). |
2 讨论
本文报道了1例司库奇尤单抗联合预防性抗结核治疗斑块型银屑病致AKI的病例。患者注射司库奇尤单抗及预防性抗结核治疗的时间存在重叠,但司库奇尤单抗治疗时间长,而预防性抗结核6 d停药,故不能准确界定引起AKI的药物,司库奇尤单抗和抗结核药中的利福平均有可能导致AKI。
IL-17A主要由皮肤中激活的T17细胞产生,其下游介导的炎症反应是银屑病皮肤损害的主要原因,在其发病机制中起基石作用[1-2]。司库奇尤单抗是具有高亲和性的全人源单克隆抗体,可选择性结合人IL-17A并中和该细胞因子的生物活性[3],从而抑制炎症反应,负向调节表皮增生、T细胞浸润和致病基因的过表达[1]。司库奇尤单抗对斑块型银屑病具有良好的效果,并被广泛应用于免疫性疾病的治疗。虽然迄今尚没有司库奇尤单抗导致AKI的报道,但有研究显示IL-17A的预处理可以提升间充质干细胞对缺血再灌注AKI小鼠的肾功能及肾脏病理表现的改善作用,降低急性肾小管坏死评分,提高间充质干细胞诱导调节性T细胞的能力,并且抑制T细胞增殖[4],进一步的实验表明IL-17A对间充质干细胞的这种作用是通过上调环氧合酶2/前列腺素E2通路的表达实现的[4]。以上提示司库奇尤单抗阻断IL-17A发挥效应可能影响了调节性T细胞的分化,进而促进急性肾小管坏死的发生、发展。
利福平是抗结核治疗的常用药物,其介导的AKI较为罕见[5-6]。利福平引起的药物性肾损伤有多种病理类型,包括急性肾小管坏死、急性间质性肾炎、急进性肾小球肾炎、轻链型管型蛋白尿[7-9],亦有微小病变型肾病[10]的报道,其中以急性肾小管坏死最为常见。但急性肾小管坏死中可见血红蛋白管型者并不多,可能与血管内溶血有关[6]。利福平进入机体与血浆蛋白结合,诱发机体产生抗利福平抗体,引起免疫反应[11]。当利福平作为抗原再次进入体内,可刺激机体产生大量抗利福平抗体,这些抗体与吸附于红细胞表面的相应抗原结合形成免疫复合物,出现严重的血管内溶血。此免疫复合物与红细胞结合形成的松散抗体常自红细胞膜上脱落,游离于血中再与其他红细胞膜结合。故小剂量利福平即可在数日内引起突发溶血,溶血程度与药物剂量无关,可见血红蛋白尿。发生急性血管内溶血时,血清游离血红蛋白浓度急性升高,当高于1 000~2 000 mg/L时,超过肾小管的重吸收能力而出现血红蛋白尿。短期内大量血红蛋白尿可导致AKI。溶血相关的血红蛋白管型肾病比较罕见,占所有自体肾组织活检的0.062%[12]。血红蛋白导致的肾损伤目前认为涉及三方面机制:(1)血红蛋白结合一氧化氮后,由于血管收缩进而降低了肾脏灌注;(2)血红蛋白对近端肾小管上皮的直接毒性作用;(3)血红蛋白管型沉积于小管腔内堵塞了肾小管[12]。利福平抗体除破坏红细胞外,亦可导致血小板和粒细胞的减少[6]。因此,利福平导致的溶血相关的血红蛋白管型肾病一般发生于间歇性服用或中断治疗后再次服用该药的患者[11]。
本例患者于1997年首次服用利福平,2022年再次服用利福平6 d即发生了AKI,从临床表现和服药史分析符合利福平导致AKI的特点。该患者有过1次酱油色尿,提示可能合并血红蛋白尿,但该患者血胆红素、乳酸脱氢酶水平一直处于正常范围,血红蛋白下降不明显,没有明显的溶血证据。该患者病程中无血小板减少,受条件所限,未对患者行利福平抗体检测。利福平相关AKI通常为临床诊断,肾组织活检通常为急性间质性肾炎或急性肾小管坏死[13]。鉴别诊断可结合临床病史,通过对血红蛋白、肌红蛋白进行免疫组织化学染色及光镜下未见红细胞“鬼影”与肌红蛋白管型、变性的红细胞管型、轻链管型及细胞碎片管型引起的肾损伤相鉴别[12]。本例患者行肾组织活检示急性肾小管坏死,肾小管腔内可见较多形态不一的管型,免疫组织化学染色检测证实为血红蛋白管型。利福平所致的AKI预后良好,充分治疗后大多数患者的肾功能能够恢复至基线水平[6, 12],此特点与本例患者一致。
本例为司库奇尤单抗联合预防性抗结核治疗斑块型银屑病过程中引发急性肾小管坏死和血红蛋白管型肾病的病例。结合病史、实验室检查结果和病理学结果,该患者发生AKI的原因不能排除司库奇尤单抗继发。随着生物制剂在各类疾病中日益广泛的应用,同时我国作为结核病防治大国,隐匿性结核病在人群中的患病率仍然很高[14]。近年来,生物制剂被广泛应用于临床治疗,提高对此类药物与传统药物联用所带来不良反应的认识,有助于临床合理用药和及时处理相关并发症。
| [1] |
FRIEDER J, KIVELEVITCH D, MENTER A. Secukinumab: a review of the anti-IL-17A biologic for the treatment of psoriasis[J]. Ther Adv Chronic Dis, 2018, 9(1): 5-21. DOI:10.1177/2040622317738910 |
| [2] |
HAWKES J E, YAN B Y, CHAN T C, et al. Discovery of the IL-23/IL-17 signaling pathway and the treatment of psoriasis[J]. J Immunol, 2018, 201(6): 1605-1613. DOI:10.4049/jimmunol.1800013 |
| [3] |
LANGLEY R G, ELEWSKI B E, LEBWOHL M, et al. Secukinumab in plaque psoriasis: results of two phase 3 trials[J]. N Engl J Med, 2014, 371(4): 326-338. DOI:10.1056/NEJMoa1314258 |
| [4] |
BAI M, ZHANG L, FU B, et al. IL-17A improves the efficacy of mesenchymal stem cells in ischemic-reperfusion renal injury by increasing Treg percentages by the COX-2/PGE2 pathway[J]. Kidney Int, 2018, 93(4): 814-825. DOI:10.1016/j.kint.2017.08.030 |
| [5] |
COVIC A, GOLDSMITH D J, SEGALL L, et al. Rifampicin-induced acute renal failure: a series of 60 patients[J]. Nephrol Dial Transplant, 1998, 13(4): 924-929. DOI:10.1093/ndt/13.4.924 |
| [6] |
MUTHUKUMAR T, JAYAKUMAR M, FERNANDO E M, et al. Acute renal failure due to rifampicin: a study of 25 patients[J]. Am J Kidney Dis, 2002, 40(4): 690-696. DOI:10.1053/ajkd.2002.35675 |
| [7] |
DE VRIESE A S, ROBBRECHT D L, VANHOLDER R C, et al. Rifampicin-associated acute renal failure: pathophysiologic, immunologic, and clinical features[J]. Am J Kidney Dis, 1998, 31(1): 108-115. DOI:10.1053/ajkd.1998.v31.pm9428460 |
| [8] |
李晓玫, 王玉, 赵明辉, 等. 利福平致急性肾功能衰竭的临床病理特点及其机制初探[J]. 中华内科杂志, 2001, 40(6): 370-373. DOI:10.3760/j.issn:0578-1426.2001.06.005 |
| [9] |
盛爱芹, 李世军. 药物相关的肾小管-间质损伤[J]. 肾脏病与透析肾移植杂志, 2016, 25(4): 375-380. DOI:10.3969/cndt.j.issn.1006-298X.2016.04.016 |
| [10] |
PARK D H, LEE S A, JEONG H J, et al. Rifampicin-induced minimal change disease is improved after cessation of rifampicin without steroid therapy[J]. Yonsei Med J, 2015, 56(2): 582-585. DOI:10.3349/ymj.2015.56.2.582 |
| [11] |
COSTINIUK C, MCCARTHY A, TALREJA H, et al. Acute renal failure and disseminated intravascular coagulation associated with rifampin in tuberculosis treatment[J]. Int J Tuberc Lung Dis, 2011, 15(3): 421-424. |
| [12] |
DVANAJSCAK Z, WALKER P D, COSSEY L N, et al. Hemolysis-associated hemoglobin cast nephropathy results from a range of clinicopathologic disorders[J]. Kidney Int, 2019, 96(6): 1400-1407. DOI:10.1016/j.kint.2019.08.026 |
| [13] |
CHANG C H, CHEN Y F, WU V C, et al. Acute kidney injury due to anti-tuberculosis drugs: a five-year experience in an aging population[J]. BMC Infect Dis, 2014, 14: 23. DOI:10.1186/1471-2334-14-23 |
| [14] |
CHAKAYA J, KHAN M, NTOUMI F, et al. Global Tuberculosis Report 2020-reflections on the Global TB burden, treatment and prevention efforts[J]. Int J Infect Dis, 2021, 113(Suppl 1): S7-S12. DOI:10.1016/j.ijid.2021.02.107 |
 2023, Vol. 44
2023, Vol. 44


