2. 中国中医科学院研究生院, 北京 100700;
3. 陕西盘龙药业集团股份有限公司, 商洛 726000
2. Graduate School, China Academy of Traditional Chinese Medicine, Beijing 100700, China;
3. Shaanxi Panlong Pharmaceutical Group Co., Ltd, Shangluo 726000, Shaanxi, China
肝纤维化是由免疫功能紊乱、病毒感染、长期酗酒、胆汁淤积、自身免疫病等多种因素引起肝内结缔组织异常增生,导致肝内弥漫性细胞外基质(extracellular matrix,ECM)过度沉积的病理过程[1-2]。随着中医药治疗的发展,中药治疗肝纤维化获得了明确的临床疗效[3]。金茵利胆胶囊(Jinyin Lidan capsule,JYLD)由茵陈、郁金、金钱草、枳壳4味中药组成,具有清热利湿、舒肝利胆之功效,适用于肝郁气滞、肝胆湿热引起的胁痛、胃痛、食少纳呆等症状[4],临床上可用于胆囊炎和非酒精性脂肪肝[5]的治疗。本课题组的前期研究结果表明,JYLD中新绿原酸、绿原酸、隐绿原酸、1, 3-二咖啡酰奎宁酸、对羟基苯乙酮、柚皮苷和新橙皮苷等多个成分具有抗炎[6]和抗氧化[7]等药理活性,而炎症反应和氧化应激是肝纤维化发生的重要机制,因此推测JYLD对肝纤维化具有治疗作用。本实验拟通过四氯化碳(carbon tetrachloride,CCl4)诱导肝纤维化大鼠模型,研究JYLD对大鼠肝纤维化的保护作用,为扩展JYLD的临床应用提供依据。
1 材料和方法 1.1 实验动物SPF级雄性SD大鼠40只,体重(200±20)g,购于成都达硕实验动物有限公司[实验动物生产许可证号为SCXK(川)2020-030],饲养于陕西省中药资源产业化协同创新中心SPF级动物实验室[实验动物使用许可证号为SYXK(陕) 2022-008],饲养温度20~24 ℃,相对湿度55%~65%,饲养期间提供充足的洁净水和标准饲料。本研究获得陕西中医药大学实验动物伦理委员会审批(SUCMDL20220612001),严格按照动物伦理要求执行,动物实验操作程序均符合国家科学技术委员会颁布的《实验动物管理条例》。
1.2 药品、试剂与仪器JYLD(批号20201101,陕西盘龙药业集团股份有限公司);水飞蓟素(批号C16D10H05984,上海源叶生物科技有限公司);橄榄油(山东鲁花集团);CCl4(货号20210102,天津市天力化学试剂有限公司);丙氨酸转氨酶(alanine transaminase,ALT)检测试剂(货号140120014)、天冬氨酸转氨酶(aspartate transaminase,AST)检测试剂(货号140220008)、总胆汁酸(total bile acid,TBA)检测试剂(货号143222001)均购于深圳迈瑞生物医疗电子股份有限公司;4%多聚甲醛固定液(货号12J28C68,武汉博士德生物工程有限公司);超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(货号141720006,南京建成生物工程研究所);TNF-α ELISA检测试剂盒(货号R210708-102a)、IL-1β ELISA检测试剂盒(货号R210730-007a)、IL-6 ELISA检测试剂盒(货号R210723-003a)均购于深圳欣博盛生物科技有限公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(货号GB13044,武汉赛维尔生物科技有限公司);无菌无酶水(货号NR002)购于陕西中晖赫彩生物医药科技有限公司;TRIzol试剂(货号BCCF8996,美国Sigma公司);PrimeScriptTM反转录试剂盒(货号RR036B)、SYBR® Premix Ex TaqTMⅡ试剂盒(货号RR820A)均购于日本Takara公司。其余试剂均为分析纯,购于天津市科密欧化学试剂有限公司。
Micro17R型微量低温冷冻离心机(美国Thermo Scientific公司);UXFSTPRP-64型高速离心研磨机(德国Eppendorf公司);BS-330E型全自动血清生化仪(深圳迈瑞生物医疗电子有限公司);KQ-300DE型超声波清洗器(昆山市超声仪器有限公司);CPA225D型十万分之一电子天平(北京赛多利斯科学仪器有限公司);qTOWER2.2型实时荧光定量PCR仪(德国Analytik Jena公司)。
1.3 造模、分组及给药40只SD大鼠随机分为5组:空白对照组、模型组、水飞蓟素(阳性对照药)组、JYLD低剂量组和JYLD高剂量组,每组8只。除空白对照组外,其余各组大鼠给予腹腔注射40% CCl4(橄榄油配制,灌胃体积为2 mL/kg),每周2次,连续6周。选模期间水飞蓟素组和JYLD低、高剂量组分别给予水飞蓟素(0.1 g/kg)、JYLD(低剂量0.6 g/kg,高剂量1.2 g/kg)灌胃,空白对照组和模型组给予等量的橄榄油溶液灌胃,每天1次,连续6周。末次给药16 h后,采用0.3%戊巴比妥钠腹腔注射麻醉大鼠(10 mL/kg),腹主动脉采血,静置2 h后,4 ℃、1 360×g离心10 min,分离并分装血清,一部分血清用于生化指标测定,一部分用于相关指标的检测,剩余血清于-80 ℃冻存。采集血样后处死大鼠,取出肝脏、脾脏,生理盐水清洗后用滤纸吸干,拍照并称重,记录肝脏和脾脏湿重。计算脏器指数(脏器质量/体重×100%)。用4%多聚甲醛固定液固定肝脏左叶中部组织,剩余肝组织置于-80 ℃冰箱保存。
1.4 血清中ALT、AST和TBA含量的测定通过全自动生化仪检测大鼠血清中ALT、AST和TBA的含量。
1.5 肝组织病理学观察将大鼠肝脏置于4%多聚甲醛固定液中固定,肝脏组织经石蜡包埋并切片,厚5 μm,分别进行H-E染色和Masson染色,显微镜下观察肝组织纤维化程度。Masson染色阳性染色为蓝色,用ImageJ软件对胶原纤维进行定量分析。
1.6 血清SOD活性测定取一部分大鼠血清解冻至室温后,严格按照SOD检测试剂盒说明书操作,测定SOD活性。
1.7 ELISA法检测血清中IL-6、IL-1β和TNF-α的水平取一部分大鼠血清解冻至室温后,按照ELISA检测试剂盒说明书测定大鼠血清中IL-6、IL-1β和TNF-α水平。
1.8 免疫组织化学染色检测肝组织中α-SMA的表达对大鼠肝脏石蜡切片进行脱蜡、水化,枸橼酸缓冲液煮沸,用3%过氧化氢灭活内源性过氧化物酶,室温条件下3%牛血清白蛋白溶液封闭1 h;于4 ℃冰箱孵育α-SMA抗体(稀释比例1∶1 000),过夜;室温摇床上孵育二抗1 h(稀释比例1∶200);滴加显色液,反应一定时间后洗涤;使用苏木精染液复染;脱水封片。阳性表达呈棕色,用ImageJ软件进行阳性表达面积定量分析。
1.9 qPCR检测取大鼠肝脏特定部分,用生理盐水洗去血迹,滤纸吸干,在相同部位精确称取50 mg,采用TRIzol法提取肝组织总RNA,用NanoDrop One超微量分光光度计(型号:ND-ONE-W)检测总RNA的浓度及纯度。用PrimeScriptTM反转录试剂盒将总RNA反转录为cDNA,用SYBR® Premix Ex TaqTMⅡ试剂盒和实时荧光定量PCR仪进行qPCR扩增。反应体系总体积25 μL:cDNA 2 μL,正、反向引物各1 μL,TB Green Premix Ex Taq 12.5 μL,灭菌水8.5 μL。qPCR扩增条件:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,共40个循环。以β-肌动蛋白作为内参,采用2-ΔΔCt法计算目的基因相对表达量。引物序列见表 1。
|
|
表 1 引物序列(5' -3' ) Tab 1 Primer sequences (5' -3' ) |
1.10 统计学处理
应用SPSS 20.0和GraphPad Prism 8.0.1软件进行统计学分析。符合正态性分布且方差齐的计量资料以x±s表示,两组间比较使用独立样本t检验,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 JYLD对CCl4诱导的肝纤维化大鼠肝脾指数的影响如图 1所示,与空白对照组相比,模型组大鼠的肝、脾脏指数均升高(P均<0.01);与模型组相比,水飞蓟素组和JYLD低、高剂量组的肝脏指数均降低(P均<0.01),脾脏指数未见明显改变。
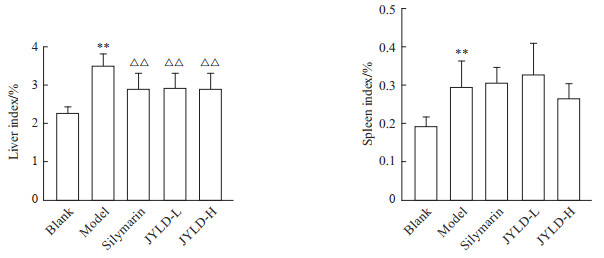
|
图 1 JYLD对CCl4诱导的肝纤维化大鼠肝脏指数和脾脏指数的影响 Fig 1 Effects of JYLD on liver index and spleen index of CCl4-induced hepatic fibrosis rats **P < 0.01 vs blank group; △△P < 0.01 vs model group. n=8, x±s. JYLD: Jinyin Lidan capsule; CCl4: Carbon tetrachloride; L: Low-dose; H: High-dose. |
2.2 JYLD对CCl4诱导的肝纤维化大鼠血清生化指标的影响
如图 2所示,与空白对照组相比,模型组大鼠血清中的ALT、AST和TBA含量均升高(P均<0.01)。与模型组相比,水飞蓟素组和JYLD低、高剂量组大鼠血清中的ALT、AST和TBA含量均降低(P<0.05,P<0.01)。

|
图 2 JYLD对CCl4诱导的肝纤维化大鼠血清中ALT、AST和TBA含量的影响 Fig 2 Effects of JYLD on serum contents of ALT, AST, and TBA in CCl4-induced hepatic fibrosis rats **P < 0.01 vs blank group; △P < 0.05, △△P < 0.01 vs model group. n=8, x± . JYLD: Jinyin Lidan capsule; CCl4: Carbon tetrachloride; ALT: Alanine transaminase; AST: Aspartate transaminase; TBA: Total bile acid; L: Low-dose; H: High-dose. |
2.3 JYLD对CCl4诱导的肝纤维化大鼠肝组织病理变化的影响
H-E染色结果(图 3)显示,空白对照组大鼠肝细胞由中央静脉向四周呈放射状排列,无明显病理变化;与空白对照组相比,模型组大鼠肝脏存在大范围的脂肪变性现象,肝小叶内炎症细胞增多,汇管区发生炎症细胞浸润,成纤维细胞增多;与模型组相比,水飞蓟素组和JYLD低、高剂量组大鼠的肝纤维化程度减轻,未出现肝小叶结构紊乱现象。
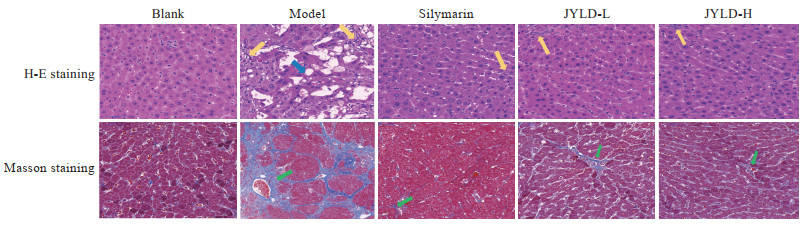
|
图 3 JYLD对CCl4诱导的肝纤维化大鼠肝组织病理变化的影响(200×) Fig 3 Effect of JYLD on pathological changes of liver tissue in CCl4-induced hepatic fibrosis rats (200×) Yellow arrows indicate inflammatory cells, blue arrow indicates steotosis, and green arrows indicate collagen deposition. JYLD: Jinyin Lidan capsule; CCl4: Carbon tetrachloride; L: Low-dose; H: High-dose; H-E: Hematoxylin-eosin. |
Masson染色结果(图 3)显示,空白对照组大鼠的肝脏结构正常,切片细胞结构完整,有少量的胶原纤维产生,胶原纤维面积百分比为(25.84±4.64)%;与空白对照组相比,模型组大鼠染色切片中可见汇管区纤维形成,胶原纤维面积百分比增加至(71.07±7.06)%(P<0.01),纤维间隔伴小叶结构紊乱;与模型组相比,水飞蓟素组和JYLD低、高剂量组大鼠的肝组织中炎症细胞浸润减轻,脂肪变性现象减少,胶原纤维面积百分比分别减少至(38.95±10.27)%、(46.58±10.92)%和(43.44±4.96)%(P均<0.01)。
2.4 JYLD对CCl4诱导的肝纤维化大鼠血清氧化和炎症指标的影响如图 4所示,与空白对照组相比,模型组大鼠血清中SOD活性降低(P<0.01);与模型组相比,水飞蓟素组和JYLD低、高剂量组大鼠血清SOD活性均升高(P均<0.01)。与空白对照组相比,模型组大鼠血清中IL-6、IL-1β和TNF-α水平均升高(P<0.05,P<0.01);与模型组相比,水飞蓟素组和JYLD低、高剂量组大鼠血清中IL-1β水平均降低(P<0.05,P<0.01),JYLD低、高剂量组IL-6和TNF-α水平均降低(P<0.05,P<0.01)。

|
图 4 YLD对CCl4诱导的肝纤维化大鼠血清中SOD、IL-6、IL-1β和TNF-α水平的影响 Fig 4 Effects of JYLD on serum levels of SOD, IL-6, IL-1β, and TNF-α in CCl4-induced hepatic fibrosis rats *P < 0.05, **P < 0.01 vs blank group; △P < 0.05, △△P < 0.01 vs model group. n=8, x±s. JYLD: Jinyin Lidan capsule; CCl4: Carbon tetrachloride; SOD: Superoxide dismutase; IL: Interleukin; TNF-α: Tumor necrosis factor α; L: Low-dose; H: High-dose. |
2.5 JYLD对CCl4诱导的肝纤维化大鼠肝组织中α-SMA表达的影响
免疫组织化学染色结果(图 5)显示,空白对照组大鼠肝组织中见少量棕黄色染色,α-SMA阳性表达面积比例为(0.56±0.37)%;与空白对照组相比,模型组大鼠肝组织中棕黄色染色增多,α-SMA阳性表达面积比例增加至(12.46±3.99)%(P<0.01);与模型组相比,水飞蓟素组和JYLD低、高剂量组棕黄色染色减少,α-SMA的阳性表达面积比例分别减少至(5.66±2.72)%、(3.92±1.71)%和(3.22±2.58)%(P<0.05,P<0.01)。
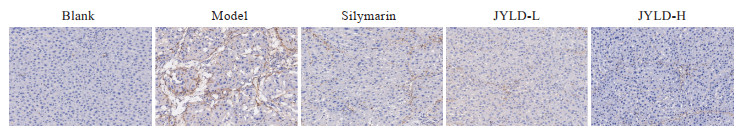
|
图 5 JYLD对CCl4诱导的肝纤维化大鼠肝组织中α-SMA表达的影响(200×) Fig 5 Effect of JYLD on α-SMA expression in liver tissue of CCl4-induced hepatic fibrosis rats (200×) Immunohistochemical staining. JYLD: Jinyin Lidan capsule; CCl4: Carbon tetrachloride; α-SMA: α-smooth muscle actin; L: Low-dose; H: High-dose. |
2.6 JYLD对CCl4诱导的肝纤维化大鼠肝脏相关基因表达的影响
如图 6所示,与空白对照组相比,模型组大鼠肝组织中胶原蛋白(collagen,Col)Ⅰ、ColⅢ、ColⅣ、NF-κB、基质金属蛋白酶(matrix metalloproteinase,MMP)-2、组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)-1、TGF-β1 mRNA的相对表达量均升高(P<0.05,P<0.01),MMP-2/TIMP-1比值增加(P<0.01);与模型组相比,水飞蓟素组和JYLD低、高剂量组大鼠肝组织中各相关基因mRNA的相对表达量均降低(P<0.05,P<0.01),JYLD低、高剂量组MMP-2/TIMP-1比值降低(P<0.05,P<0.01)。
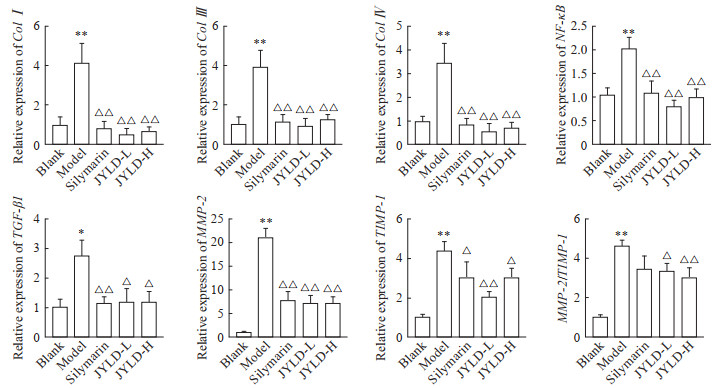
|
图 6 JYLD对CCl4诱导的肝纤维化大鼠肝脏相关基因表达的影响 Fig 6 Effects of JYLD on the expression of liver relative genes in CCl4-induced hepatic fibrosis rats *P < 0.05, **P < 0.01 vs blank group; △P < 0.05, △△P < 0.01 vs model group. n=8, x±s. JYLD: Jinyin Lidan capsule; CCl4: Carbon tetrachloride; L: Low-dose; H: High-dose; Col: Collagen; NF-κB: Nuclear factor κB; TGF-β1: Transforming growth factor β1; MMP-2: Matrix metalloproteinase 2; TIMP-1: Tissue inhibitor of metalloproteinase 1. |
3 讨论
肝纤维化是多种损伤因子持续作用下的创面愈合反应,以ECM沉积及瘢痕形成为特征[8-9],是严重危害人类健康的世界性问题[10-11]。连续给予CCl4可使肝细胞变性、坏死、产生炎症反应,在动物实验中容易复制,重复性好[12]。本实验通过CCl4诱导成功建立了大鼠肝纤维化模型,发现JYLD能降低肝纤维化大鼠血清中ALT、AST和TBA含量,减轻肝细胞水肿、坏死和炎症细胞浸润,说明JYLD对肝纤维化大鼠具有保护作用。
炎症反应和氧化应激参与大多数肝脏疾病的发病过程,长期的炎症是肝纤维化形成和发展的重要驱动因素,并且介导肝纤维化的发生与发展[13-14]。本实验发现CCl4诱导能引起血清中IL-1β、IL-6、TNF-α水平升高且SOD含量下降,JYLD低、高剂量组中IL-1β、IL-6和TNF-α的水平下降且SOD的含量升高,与JYLD体外抗炎、抗氧化结果相符,说明JYLD可能通过抗炎和抗氧化作用抑制肝纤维化形成和发展。NF-κB/TGF-β1信号通路是介导肝纤维化发展过程中肝脏炎症的重要组成部分[15-17],激活的炎症因子可分泌TGF-β1,且TGF-β1又受NF-κB调控[18],NF-κB被激活后迅速移位进入细胞核[19-20],调控基因的表达,并诱导炎症因子的分泌,参与机体对炎症及免疫反应的调控[21]。本研究结果显示,模型组的NF-κB、TGF-β1 mRNA的相对表达量升高,JYLD低、高剂量组中NF-κB、TGF-β1 mRNA的相对表达量下降,说明抑制NF-κB/TGF-β1信号通路可能是JYLD抗肝纤维化的作用机制之一。
α-SMA与肝纤维化的形成密切相关,是肝星状细胞(hepatic stellate cell,HSC)活化的标志,HSC活化后合成大量ECM沉积于肝脏,导致肝纤维化[22-23]。本研究结果显示,模型大鼠肝脏组织中α-SMA阳性表达面积比例增加,JYLD可抑制肝纤维化大鼠肝脏组织中α-SMA的表达,从而减少ECM的合成,抑制肝纤维化。HSC活化可促进肝细胞合成多种胶原蛋白,而在肝纤维化时Col Ⅰ、Col Ⅲ和Col Ⅳ合成增加[24-26]。由qPCR结果可知,模型组Col Ⅰ、Col Ⅲ和Col ⅣmRNA的相对表达量升高,促进Col Ⅰ、Col Ⅲ和Col Ⅳ的合成,抑制蛋白酶水解酶的合成及分泌,导致ECM沉积增加而降解减少[27]。JYLD低、高剂量组中Col Ⅰ、Col Ⅲ和Col ⅣmRNA的相对表达量降低,说明JYLD可以减少肝细胞中胶原蛋白合成。
MMP和TIMP参与了ECM的合成[28],两者之间的平衡与肝纤维化的病理生理学过程和进展有关[29]。MMP-2是一种明胶酶,具有降解ECM几乎所有成分的能力,由活化的HSC产生,并受TIMP-1调控[30-31]。TIMP-1是ECM改变组织重塑和细胞行为的重要调节因子[32],在肝纤维化的调控中起着重要作用,特别是抑制MMP-2和维护ECM的来源[33-34]。TIMP-1主要通过与MMP-2结合抑制胶原酶的活性,也能够阻止活化的HSC中前体MMP-2的激活。MMP-2/TIMP-1比值是维持ECM稳定和完整的因素,过量表达的TIMP-1经CCl4处理后表现出更加严重的纤维化症状[35-37]。本研究结果显示,与空白对照组相比,模型组MMP-2/TIMP-1比值增加,说明两者表达失衡,TIMP-1失去对MMP-2活性的抑制,ECM沉积加重,导致肝纤维化形成;与模型组相比,JYLD低、高剂量组MMP-2/TIMP-1比值降低,说明JYLD可以通过影响肝组织中MMP-2、TIMP-1的表达来减缓肝纤维化的进程,从而发挥抗肝纤维化的作用。
综上所述,JYLD可以降低大鼠肝脏指数,改善肝组织损伤和纤维化,降低血清肝功能指标含量、炎症因子水平,提高抗氧化能力,表明JYLD具有保护肝纤维化的作用。进一步的机制研究发现,JYLD可降低肝脏组织中α-SMA的表达,下调大鼠肝组织中Col Ⅰ、Col Ⅲ、Col Ⅳ、NF-κB、MMP-2、TIMP-1、TGF-β1 mRNA的表达,降低MMP-2/TIMP-1比值,表明JYLD保护肝纤维化的作用可能与抑制ECM沉积和HSC活化有关。
| [1] |
ROEHLEN N, CROUCHET E, BAUMERT T. Liver fibrosis: mechanistic concepts and therapeutic perspectives[J]. Cells, 2020, 9(4): 875. DOI:10.3390/cells9040875 |
| [2] |
YANG L, SEKI E. Toll-like receptors in liver fibrosis: cellular crosstalk and mechanisms[J]. Front Physiol, 2012, 3: 138. DOI:10.3389/fphys.2012.00138 |
| [3] |
ZHANG L, SCHUPPAN D. Traditional Chinese medicine (TCM) for fibrotic liver disease: hope and hype[J]. J Hepatol, 2014, 61(1): 166-168. DOI:10.1016/j.jhep.2014.03.009 |
| [4] |
蒋歆, 张涛, 陈圣开. 金茵利胆胶囊对肝内胆汁淤积大鼠PPARγ/NF-κB通路相关肝损伤影响[J]. 中西医结合肝病杂志, 2022, 32(8): 714-717. DOI:10.3969/j.issn.1005-0264.2022.08.010 |
| [5] |
王伟, 刘德宝. 金茵利胆胶囊治疗非酒精性脂肪肝50例[J]. 中国民间疗法, 2017, 25(12): 49. DOI:10.3969/j.issn.1007-5798.2017.12.043 |
| [6] |
曹凡, 宋忠兴, 陈琳, 等. 金茵利胆胶囊的体外抗炎活性评价及其谱效关系[J]. 海军军医大学学报, 2023, 44(4): 418-426. CAO F, SONG Z X, CHEN L, et al. Evaluation for in vitro anti-inflammatory activity of Jinyin Lidan capsule and its spectrum-effect relation[J]. Acad J Naval Med Univ, 2023, 44(4): 418-426. DOI:10.16781/j.cn31-2187/r.20220091 |
| [7] |
曹凡, 陈琳, 宋忠兴, 等. 金茵利胆胶囊的高效液相色谱指纹图谱及其抗氧化作用的灰色关联分析[J]. 中南药学, 2022, 20(3): 574-579. DOI:10.7539/j.issn.1672-2981.2022.03.016 |
| [8] |
秦利静, 张露, 侯鹏, 等. 肝纤维化发病机制的研究进展[J]. 吉林医药学院学报, 2021, 42(5): 369-371. DOI:10.13845/j.cnki.issn1673-2995.2021.05.019 |
| [9] |
SCHUPPAN D, KIM Y O. Evolving therapies for liver fibrosis[J]. J Clin Invest, 2013, 123(5): 1887-1901. DOI:10.1172/jci66028 |
| [10] |
李艳, 伊航, 蔡轶伦, 等. 黄芪总黄酮对四氯化碳诱导大鼠肝纤维化的影响[J]. 中成药, 2019, 41(7): 1710-1713. DOI:10.3969/j.issn.1001-1528.2019.07.045 |
| [11] |
WASSER S, HO J M S, ANG H K, et al. Salvia miltiorrhiza reduces experimentally-induced hepatic fibrosis in rats[J]. J Hepatol, 1998, 29(5): 760-771. DOI:10.1016/S0168-8278(98)80257-2 |
| [12] |
秦秀娟, 高家荣, 姜辉, 等. 疏肝健脾方醇水双提物对CCl4诱导的肝纤维化大鼠的保护作用[J]. 中成药, 2015, 37(8): 1646-1651. DOI:10.3969/j.issn.1001-1528.2015.08.003 |
| [13] |
CHUPRADIT S, BOKOV D, ZAMANIAN M Y, et al. Hepatoprotective and therapeutic effects of resveratrol: a focus on anti-inflammatory and antioxidative activities[J]. Fundam Clin Pharmacol, 2022, 36(3): 468-485. DOI:10.1111/fcp.12746 |
| [14] |
ALNUQAYDAN A M, ALMUTARY A G, ALSAHLI M A, et al. Tamarix articulata induced prevention of hepatotoxicity effects of in vivo carbon tetrachloride by modulating pro-inflammatory serum and antioxidant enzymes to reverse the liver fibrosis[J]. Antioxidants, 2022, 11(9): 1824. DOI:10.3390/antiox11091824 |
| [15] |
HASSAN A A, MOUSTAFA E M, EL-KHASHAB I H, et al. Mangosteen hinders gamma radiation-mediated oxidative stress and liver injury by down-regulating TNF-α/NF-κB and pro-fibrotic factor TGF-β1 inducing inflammatory signaling[J]. Dose Response, 2021, 19(2): 15593258211025190. DOI:10.1177/15593258211025190 |
| [16] |
徐涛. NLRC5通过NF-κB与TGF-β1/Smad通路调控肝星状细胞炎症因子分泌和纤维化的功能及其机制研究[D]. 合肥: 安徽医科大学, 2015.
|
| [17] |
SUN W, WU Y, GAO M, et al. C-reactive protein promotes inflammation through TLR4/NF-κB/TGF-β pathway in HL-1 cells[J]. Biosci Rep, 2019, 39(8). DOI:10.1042/bsr20190888 |
| [18] |
季国忠, 赵志泉, 缪林, 等. TGF-β1、TGF-β1RⅡ、NF-κB在肝细胞癌血管形成中的作用及机制探讨[J]. 中国实用内科杂志, 2002, 22(12): 729-731. DOI:10.3969/j.issn.1005-2194.2002.12.012 |
| [19] |
HEMMI H, TAKEUCHI O, SATO S, et al. The roles of two IκB kinase-related kinases in lipopolysaccharide and double stranded RNA signaling and viral infection[J]. J Exp Med, 2004, 199(12): 1641-1650. DOI:10.1084/jem.20040520 |
| [20] |
何佳, 邵继华, 王林园, 等. 黄芪多糖对溃疡性结肠炎大鼠的研究[J]. 中国临床药理学杂志, 2022, 38(14): 1678-1682. DOI:10.13699/j.cnki.1001-6821.2022.14.023 |
| [21] |
WU J, MENG Z, JIANG M, et al. Toll-like receptor-induced innate immune responses in non-parenchymal liver cells are cell type-specific[J]. Immunology, 2010, 129(3): 363-374. DOI:10.1111/j.1365-2567.2009.03179.x |
| [22] |
伍朝君, 朱舟, 邓志刚. 八味柔肝颗粒对肝纤维化大鼠肝组织TGF-β1, α-SMA及TIMP-1表达的影响[J]. 中国实验方剂学杂志, 2011, 17(12): 217-218. DOI:10.13422/j.cnki.syfjx.2011.12.026 |
| [23] |
HU N, WANG C, DAI X, et al. Phillygenin inhibits LPS-induced activation and inflammation of LX2 cells by TLR4/MyD88/NF-κB signaling pathway[J]. J Ethnopharmacol, 2020, 248: 112361. DOI:10.1016/j.jep.2019.112361 |
| [24] |
马婷, 邝晓岚, 蔡婉娜, 等. 黄酮类成分抗肝纤维化作用及其机制的研究进展[J]. 中草药, 2022, 53(13): 4146-4161. DOI:10.7501/j.issn.0253-2670.2022.13.028 |
| [25] |
韩云雪, 李丽梅, 石洁琼. 鸡血藤提取物对大鼠纤维化肝细胞中胶原蛋白表达及TGF-β1/p38MAPK信号通路的影响[J]. 中国免疫学杂志, 2020, 36(21): 2608-2612, 2618. DOI:10.3969/j.issn.1000-484X.2020.21.010 |
| [26] |
CHEN Y, QUE R, ZHANG N, et al. Saikosaponin-d alleviates hepatic fibrosis through regulating GPER1/autophagy signaling[J]. Mol Biol Rep, 2021, 48(12): 7853-7863. DOI:10.1007/s11033-021-06807-x |
| [27] |
BHATTACHARJEE S, HAMBERGER F, RAVICHANDRA A, et al. Tumor restriction by type Ⅰ collagen opposes tumor-promoting effects of cancer-associated fibroblasts[J]. J Clin Invest, 2021, 131(11): e146987. DOI:10.1172/JCI146987 |
| [28] |
WU L, ZHANG Q, MO W, et al. Quercetin prevents hepatic fibrosis by inhibiting hepatic stellate cell activation and reducing autophagy via the TGF-β1/Smads and PI3K/Akt pathways[J]. Sci Rep, 2017, 7(1): 9289. DOI:10.1038/s41598-017-09673-5 |
| [29] |
郭艳祥, 杨迎春, 李冬梅. MMPs及TIMPs在肝纤维化的作用机制及研究进展[J]. 贵州医药, 2015, 39(7): 663-665. DOI:10.3969/j.ISSN.1000-744X.2015.07.042 |
| [30] |
KURIYAMA N, DUARTE S, HAMADA T, et al. Tenascin-C: a novel mediator of hepatic ischemia and reperfusion injury[J]. Hepatology, 2011, 54(6): 2125-2136. DOI:10.1002/hep.24639 |
| [31] |
PENG J, LI X, FENG Q, et al. Anti-fibrotic effect of Cordyceps sinensis polysaccharide: inhibiting HSC activation, TGF-β1/Smad signalling, MMPs and TIMPs[J]. Exp Biol Med (Maywood), 2013, 238(6): 668-677. DOI:10.1177/1535370213480741 |
| [32] |
CABRAL-PACHECO G A, GARZA-VELOZ I, CASTRUITA-DE LA ROSA C, et al. The roles of matrix metalloproteinases and their inhibitors in human diseases[J]. Int J Mol Sci, 2020, 21(24): 9739. DOI:10.3390/ijms21249739 |
| [33] |
CHENG Q, LI C, YANG C F, et al. Methyl ferulic acid attenuates liver fibrosis and hepatic stellate cell activation through the TGF-β1/Smad and NOX4/ROS pathways[J]. Chem Biol Interact, 2019, 299: 131-139. DOI:10.1016/j.cbi.2018.12.006 |
| [34] |
ZHOU M, ZHAO X, LIAO L, et al. Forsythiaside A regulates activation of hepatic stellate cells by inhibiting NOX4-dependent ROS[J]. Oxid Med Cell Longev, 2022, 2022: 9938392. DOI:10.1155/2022/9938392 |
| [35] |
MASHAYEKHI F, SABERI A, MASHAYEKHI S. Serum TIMP1 and TIMP2 concentration in patients with different grades of meningioma[J]. Clin Neurol Neurosurg, 2018, 170: 84-87. DOI:10.1016/j.clineuro.2018.05.001 |
| [36] |
WANG K, LIN B, BREMS J J, et al. Hepatic apoptosis can modulate liver fibrosis through TIMP1 pathway[J]. Apoptosis, 2013, 18(5): 566-577. DOI:10.1007/s10495-013-0827-5 |
| [37] |
黄倩, 杨燕, 曾锐, 等. 基质金属蛋白酶/基质金属蛋白酶水解酶对肝纤维化的调控及相关治疗药物研究进展[J]. 临床肝胆病杂志, 2022, 38(6): 1420-1425. DOI:10.3969/j.issn.1001-5256.2022.06.042 |
 2023, Vol. 44
2023, Vol. 44


