2. 浙江数字内容研究院数字医疗与人工智能实验室, 绍兴 312366
2. Laboratory of Digital Health and Artificial Intelligence, Zhejiang Digital Content Research Institute, Shaoxing 312366, Zhejiang, China
癌症是全球最难解决的健康问题之一,据估计,到2035年全球癌症病例数将从1 500万增加至2 400万[1]。作为一个发病率和死亡率都极高的疾病,目前癌症的临床治疗包括手术治疗、化疗和放疗[2]。临床治疗的局限性及不良反应的发生常常导致癌症的治愈率较低。化疗虽然对于肿瘤的进展起到了一定的靶向治疗作用,但其风险和并发症不容忽视,如疲劳、恶心呕吐、脱发、外渗损伤和血细胞减少等[3]。
化疗药物外渗性损伤是静脉输入化疗药物过程中因意外出现化疗药物进入静脉管腔外导致的静脉穿刺点周围的皮下及真皮组织坏死和蜂窝组织炎[4]。对于化疗药物外渗性损伤,临床治疗包括一般护理、局部外敷、药物治疗及对坏死组织清创植皮等[5]。如果损伤严重或治疗延误,最终可能会导致周围组织坏死、溃烂甚至功能丧失[6]。目前研究证实的解毒剂包括DMSO[7]、透明质酸酶[8]、地塞米松[9]、大体积生理盐水[10]、肝素和皮质类固醇[11]。中医药也在化疗药物外渗性损伤的治疗上占据着一定地位[12]。研究发现复方大黄制剂联用治疗能够有效治疗化疗药物外渗引起的皮肤毒性反应[13],芦荟凝胶可以通过调控TNF-α、IL-1β和IL-8的表达防治化疗药物外渗性损伤[14]。这些药物的效果具有一定的局限性,外渗性损伤的临床治疗仍然缺乏有效的药物。
本研究通过建立小鼠表柔比星(epirubicin,EPI)外渗性损伤模型,探讨海洋中药氢化珊瑚钙对于化疗药物外渗性损伤的疗效,为海洋中药氢化珊瑚钙的临床应用提供依据,同时为治疗化疗药物外渗性损伤提供更多的选择。
1 材料和方法 1.1 实验动物SPF级6周龄雌性C57小鼠14只购于上海南方模式生物科技股份有限公司[动物生产许可证号:SCXK(沪)2017-0010],体重(19.65±0.54)g,环境温度(22±2)℃,湿度60%~70%,自由进食、饮水,适应性饲养7 d。
1.2 药品及试剂海洋中药氢化珊瑚钙由上海全人生物科技有限公司提供(375 mg/粒,生产批号:20200417,注册编号:CJPN24082203240092);注射用盐酸EPI(10 mg/支)由浙江海正药业股份有限公司提供。SP免疫组织化学染色试剂盒(货号:KIT-9720)及Ki-67抗体(货号:MAB-0672)购自福州迈新生物技术开发有限公司。
1.3 小鼠化疗药物外渗性损伤模型的建立13只小鼠用于造模,1只作为空白对照。小鼠腹腔注射2%的戊巴比妥纳(45 mg/kg)麻醉后,背部脱毛备皮,直径约3 cm,剃毛时手法轻柔,以保证皮肤完好无损,皮下注射0.25 mg/mL EPI 0.1 mL,尽可能保证小鼠损伤模型的部位、大小及深度基本一致。模型建立的第1、3、5天各取1只模型小鼠观察溃疡组织病理形态改变,空白组小鼠作为对照。
1.4 动物模型评估按病变的程度从轻到重将溃疡愈合分为0、1、2、3级。0级:肉眼观察,溃疡表面假膜消失,上皮完整;病理观察,溃疡局部出现复层扁平上皮细胞覆盖整个创口,溃疡深部无炎症细胞浸润,无小血管扩张和充血,为完全愈合。1级:肉眼观察,溃疡表面有少量假膜,上皮近于完整;病理观察,局部的复层扁平上皮细胞几乎覆盖创口,溃疡深部可见少量炎症细胞浸润,有不明显的小血管扩张和充血,为基本愈合。2级:肉眼观察,溃疡表面有较大假膜,上皮不完整;病理观察,溃疡表面未被复层上皮细胞覆盖,溃疡深部可见较多炎症细胞浸润,血管明显扩张和充血,为部分愈合。3级:肉眼观察,整个溃疡表面均被假膜覆盖,上皮破坏脱落;病理观察,局部无复层上皮细胞覆盖,溃疡深部可见大量炎症细胞浸润,血管显著扩张和充血,为完全未愈合。
1.5 实验动物分组及处理造模成功后,将剩余10只化疗药物外渗性损伤模型小鼠随机分成两组,每组5只。对照组小鼠的外渗创口予以基础处理(避免患处局部受压,保持清洁干燥,局部肿胀严重时可用50%硫酸镁湿敷)及生理盐水冲洗;实验组小鼠的外渗创口除基础处理及生理盐水冲洗外,另予以早、中、晚氢化珊瑚钙局部均匀涂抹创口各1次,用药量为0.375 g/cm2。
1.6 观察指标及取样根据小鼠的疼痛评级,观察并记录各组小鼠的体重变化、外观、临床症状及有无刺激的反应等。观察两组小鼠药物外渗后每天的创口面积、周围充血及愈合情况,并拍照记录,应用ImageJ软件测定创面面积。连续用药15 d后吸入一氧化碳(体积分数为0.5%)处死小鼠,切取外渗性损伤部位长5 mm、宽3 mm、深达肌层的组织,用无菌生理盐水冲去表面的血液后置于10%甲醛固定液中,所有标本瓶均用胶布密封瓶口,并置于4 ℃冰箱中保存备用。
1.7 病理组织H-E染色样本经过乙醇梯度脱水,二甲苯透明,浸蜡,常规石蜡包埋,切片。石蜡切片经二甲苯脱蜡、乙醇梯度脱水各5 min后,自来水漂洗;苏木精染色5 min,自来水漂洗;1%稀氨水返蓝30 s,自来水漂洗;伊红染色5 min,自来水漂洗;乙醇梯度脱水,二甲苯透明,中性树胶封片。切片扫描图像予以数字化,观察组织学变化。
1.8 免疫组织化学染色及结果判定采用SP法进行免疫组织化学染色,兔抗血红素加氧酶1(heme oxygenase 1,HO-1)多克隆抗体(货号:A1346)、兔抗诱导型一氧化氮合酶2(inducible nitric oxide synthase 2,iNOS2)多克隆抗体(货号:A14031)、兔抗烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(nicotinamide adenine dinucleotide phosphate oxidase 2,NOX2)多克隆抗体(货号:A1636)和兔抗超氧化物歧化酶1(superoxide dismutase 1,SOD1)多克隆抗体(货号:A0274)购自于武汉爱博泰克生物科技有限公司,染色流程根据说明书执行和调整。Ki-67阳性染色为淡黄色或深褐色,主要定位于细胞核。其他抗体染色为淡黄色或深褐色,主要定位于细胞质。结果判定采用二级计分法,根据阳性细胞占比将阳性细胞数量分为0~100;根据染色强度分类:淡黄色为1分,黄或深黄色为2分,褐或棕褐色为3分。两者计分相乘得出最终结果,总分为0~300分。
1.9 统计学处理应用SPSS 21.0和GraphPad Prism 8软件对数据进行统计分析和作图。计量资料用x±s表示。若计量资料符合正态分布且方差齐时,两样本间比较采用最小显著性差异法(least significant difference,LSD)-t检验。
2 结果 2.1 化疗药物外渗损伤小鼠模型成功建立如图 1,模型建立第1天,小鼠注射部位皮肤表面未见明显异常结构紊乱,皮下结缔组织局部水肿。第3天小鼠注射部位皮肤表面出现边界不清的红肿隆起,镜下观察注射部位皮肤结构消失、坏死,大量炎症细胞浸润结缔组织和小血管扩张(2级)。第5天小鼠注射部位皮肤表面坏死组织脱落,出现边界不清的溃疡,并有脓液渗出,同时伴有炎症细胞浸润、小血管扩张和增生情况(3级)。结合肉眼所见皮肤表面变化和显微镜下组织病理形态变化,表明造模成功。
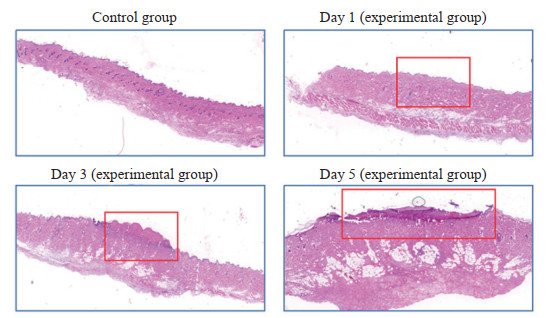
|
图 1 化疗药物外渗性损伤模型小鼠注射部位的病理形态学改变 Fig 1 Pathomorphological changes of injection site in chemotherapy-extravasated injury model mice Hematoxylin-eosin staining (40×). Control group: Normal tissue; Day 1 (experimental group): Local edema of the subcutaneous connective tissue was observed; Day 3 (experimental group): A significant influx of inflammatory cells began to infiltrate the connective tissue, accompanied by dilation of small blood vessels; Day 5 (experimental group): Infiltration of inflammatory cells persisted, along with small blood vessel dilation, tissue necrosis and ulcer formation. The red boxes indicate the injured area. |
2.2 海洋中药氢化珊瑚钙对小鼠化疗药物外渗性损伤愈合效果评估
对照组小鼠溃疡的发生率为100.0%(5/5),而实验组小鼠溃疡的发生率为60.0%(3/5)。对照组和实验组小鼠化疗药物外渗性溃疡第1天到第15天的变化如图 2所示。肉眼观察和ImageJ软件定量分析均发现对照组小鼠皮肤溃疡范围先变大后逐步恢复,但恢复速度较慢;实验组予以海洋中药干预后小鼠皮肤溃疡较为稳定,范围没有明显变大,且恢复速度较快。
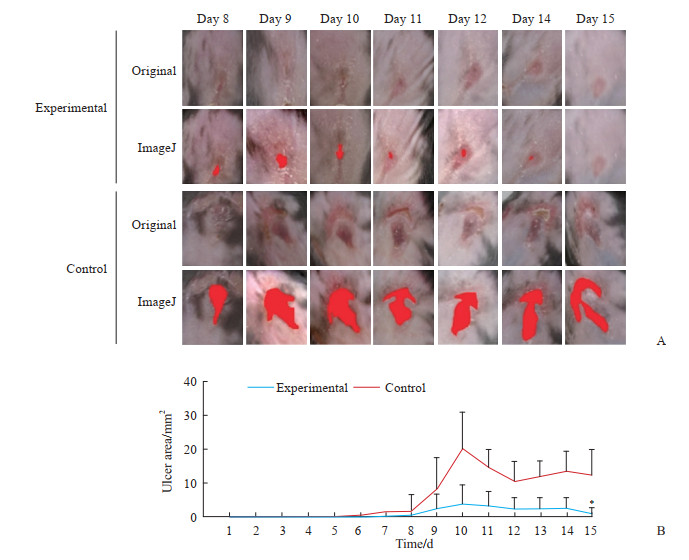
|
图 2 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠创口的疗效评估 Fig 2 Efficacy evaluation of marine traditional Chinese medicine coral calcium hydride on wound of chemotherapy-extravasated injury model mice A: The healing process of chemotherapy-extravasated injury in the control group and experimental group and the ulcer area identified by ImageJ software, the red part indicates the ulcer area; B: The effect of marine traditional Chinese medicine coral calcium hydride on the ulcer area of chemotherapy-extravasated injury in mice. *P < 0.05 vs contrl group. n=5, x±s. |
2.3 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠体征表现的影响
相较于实验组,对照组小鼠疼痛症状更为强烈,且由于实验组恢复更为迅速,体征反应改善明显,实验组小鼠在第10天即表现比较活泼。
2.4 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠损伤组织病理形态的影响H-E染色结果显示,对照组小鼠的药物注射部位表现为溃疡后期症状,包括结缔组织增生和上皮变化等,皮肤表层为增厚的鳞状上皮细胞覆盖,组织结构紊乱,大量的结缔组织增生,大量毛囊扩张明显;实验组小鼠的药物注射部位有40%的局部皮肤与正常皮肤组织完全一致,另外60%局部皮肤表层由一层稍微增厚的鳞状上皮细胞覆盖,组织结构稍显紊乱,少量结缔组织增生,个别毛囊扩张。见图 3A。

|
图 3 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠损伤组织病理形态和细胞增殖的影响 Fig 3 Effects of marine traditional Chinese medicine coral calcium hydride on histopathology and cell proliferation of the injured tissue in chemotherapy-extravasated injury model mice A: Hematoxylin-eosin staining; B: Ki-67 immunohistochemical staining (each image represents 1 mouse). |
2.5 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠损伤组织细胞增殖的影响
免疫组织化学染色检测细胞增殖结果表明,对照组小鼠Ki-67阳性表达强度较低,在扩张的毛囊细胞中基本不表达;实验组小鼠Ki-67阳性表达强度较高,在毛囊细胞中表达较高(图 3B)。
2.6 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠损伤组织氧化应激相关指标的影响免疫组织化学染色检测HO-1、iNOS2、NOX2和SOD1等氧化应激相关指标在皮肤损伤部位的表达,结果显示其主要表达于细胞质,呈淡黄色或深褐色(图 4)。它们在对照组小鼠皮肤组织中的表达强度分别为52.0±17.9、65.0±19.4、83.0±43.0和84.0±20.7,而在实验组小鼠皮肤组织中的表达强度分别为85.8±45.6、48.0±40.9、25.0±27.8和154.0±46.7。iNOS2、NOX2在对照组中的表达高于实验组(P<0.05),HO-1、SOD1在对照组中的表达低于实验组(P<0.05)。
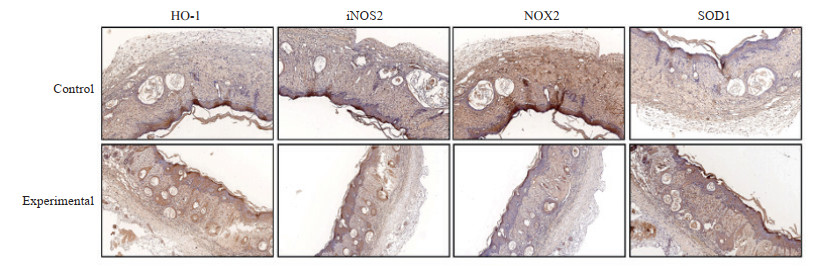
|
图 4 海洋中药氢化珊瑚钙对化疗药物外渗性损伤模型小鼠损伤组织氧化应激相关指标表达的影响 Fig 4 Effect of marine traditional Chinese medicine coral calcium hydride on oxidative stress-related indicators in chemotherapy-extravasated injury model mice Immunohistochemical staining (100×). HO-1: Heme oxygenase 1; iNOS2: Inducible nitric oxide synthase 2; NOX2: Nicotinamide adenine dinucleotide phosphate oxidase 2; SOD1: Superoxide dismutase 1. |
3 讨论
本研究发现,EPI外渗引起的化疗性溃疡损伤面积及疼痛等反应在海洋中药氢化珊瑚钙的作用下有效缓解。
动物模型对于疾病的机制研究和治疗方案探索至关重要[15],建立可靠的动物模型对于疾病的研究起到事半功倍的效果。临床上肿瘤患者在发生EPI外渗后,症状由红斑逐渐演变为外渗部位进行性溃疡,甚至出现浅表皮肤坏死等[16]。本实验建立的化疗药物外渗性损伤小鼠模型尽可能再现了临床药物外渗性损伤的情况,保证了建模的相似性原则,为后续实验奠定了基础。
皮肤愈合是一个复杂的过程,发生在3个不同但重叠且高度协调的阶段,即炎症、增殖和重塑[17]。当皮肤受损后会引发大规模的炎症反应,免疫细胞会清除该区域的细菌及碎片,随后结缔组织细胞及内皮细胞增殖形成肉芽瘢痕组织,最后表皮再生和新生组织重建[18]。本实验结果表明,实验组小鼠的皮肤创面面积小于对照组,且愈合速度明显快于对照组,提示海洋中药可以有效减轻药物外渗性损伤。Ki-67是反映细胞增殖活性的重要指标,本研究实验组中化疗药物外渗性损伤的Ki-67阳性表达区域明显增多,提示海洋中药氢化珊瑚钙可能促进了组织细胞的修复,进而加速溃疡的愈合。
海洋中药氢化珊瑚钙是一种由珊瑚钙与氢在高温下反应而成的多孔粉末,当暴露在水中时会产生氢[19]。其化学基础是氢化钙,食品安全基础是根据珊瑚钙可作为食品添加剂获得批准。在5~10 g/L氢化珊瑚钙悬浮液中产生的最大氢浓度接近6×10-7,而且这种氢可以稳定释放至少24 h,然后产生逐渐减少。研究表明氢化珊瑚钙可以直接清除活性氧及激活多种内源性氧化酶,促进氧自由基被还原[20],且氢分子能够选择性地降低羟基和过氧亚硝酸盐(ONOO-)的水平,是一种有效的抗氧化剂,但不会干扰代谢细胞的氧化还原反应[21]。而羟基和过氧亚硝酸盐会产生细胞毒性,抑制细胞增殖[22]。这与本实验结果一致,氢化珊瑚钙干预后氧化应激相关指标iNOS2和NOX2表达下降,而保护细胞免受氧化应激损伤的指标HO-1和SOD1表达上升,表明氢化珊瑚钙的作用机制可能是平衡体内的氧化还原反应,从而促进溃疡组织细胞增殖,加速损伤愈合。
本研究存在一定的局限性,如海洋中药氢化珊瑚钙改善化疗性溃疡的作用机制尚不明确,实验过程中存在由人为因素所致的损伤模型大小不一致的情况,且缺乏阳性对照组(临床用药治疗组),在后续研究中将进一步改进完善。
| [1] |
CORNEN S, VIVIER E. Chemotherapy and tumor immunity[J]. Science, 2018, 362(6421): 1355-1356. DOI:10.1126/science.aav7871 |
| [2] |
The Lancet Global Health. Lifting the veil on cancer treatment[J]. Lancet Glob Health, 2019, 7(3): e281. DOI:10.1016/S2214-109X(19)30014-2 |
| [3] |
MUTH C C. Chemotherapy and hair loss[J]. JAMA, 2017, 317(6): 656. DOI:10.1001/jama.2016.21266 |
| [4] |
BOSCHI R, ROSTAGNO E. Extravasation of antineoplastic agents: prevention and treatments[J]. Pediatr Rep, 2012, 4(3): e28. DOI:10.4081/pr.2012.e28 |
| [5] |
刘婷. 化疗药物外渗的预防及处理[J]. 当代护士(下旬刊), 2019, 26(3): 6-8. |
| [6] |
DI COSTANZO G, LOQUERCIO G, MARCACCI G, et al. Use of allogeneic platelet gel in the management of chemotherapy extravasation injuries: a case report[J]. Onco Targets Ther, 2015, 8: 401-404. DOI:10.2147/OTT.S68469 |
| [7] |
BERTELLI G, GOZZA A, FORNO G B, et al. Topical dimethylsulfoxide for the prevention of soft tissue injury after extravasation of vesicant cytotoxic drugs: a prospective clinical study[J]. J Clin Oncol, 1995, 13(11): 2851-2855. DOI:10.1200/JCO.1995.13.11.2851 |
| [8] |
DISA J J, CHANG R R, MUCCI S J, et al. Prevention of adriamycin-induced full-thickness skin loss using hyaluronidase infiltration[J]. Plast Reconstr Surg, 1998, 101(2): 370-374. DOI:10.1097/00006534-199802000-00016 |
| [9] |
MASLOVSKY I. Extravasation injury as a result of VAD chemotherapy[J]. J Wound Ostomy Cont Nurs, 2007, 34(3): 297-298. DOI:10.1097/01.won.0000270825.14566.a1 |
| [10] |
MAS V, SIMON A L, PRESEDO A, et al. Upper limb extravasation of cytotoxic drugs: results of the saline washout technique in children[J]. J Child Orthop, 2020, 14(3): 230-235. DOI:10.1302/1863-2548.14.200020 |
| [11] |
REEVES D. Management of anthracycline extravasation injuries[J]. Ann Pharmacother, 2007, 41(7/8): 1238-1242. DOI:10.1345/aph.1H700 |
| [12] |
袁霞, 巫玉兰, 范微. 化疗药物外渗的中医治疗与护理[C]//《临床心身疾病杂志》 2015年10月综合刊. 2015: 173.
|
| [13] |
唐文田. 探讨复方大黄制剂联用治疗化疗药物外渗引起的皮肤毒性反应的临床治疗效果[J]. 全科口腔医学电子杂志, 2016, 3(20): 103. DOI:10.16269/j.cnki.cn11-9337/r.2016.20.064 |
| [14] |
刘新福, 张辉, 尹婵, 等. 芦荟凝胶促进多柔比星外渗性损伤修复及其机制的探讨[J]. 中华肿瘤防治杂志, 2012, 19(12): 896-898, 912. DOI:10.16073/j.cnki.cjcpt.2012.12.001 |
| [15] |
YIN P, LI S, LI X J, et al. New pathogenic insights from large animal models of neurodegenerative diseases[J]. Protein Cell, 2022, 13(10): 707-720. DOI:10.1007/s13238-022-00912-8 |
| [16] |
VANO-GALVAN S, JAEN P. Images in clinical medicine. Extravasation of epirubicin[J]. N Engl J Med, 2009, 360(20): 2117. DOI:10.1056/nejmicm0800614 |
| [17] |
SINGER A J. Healing mechanisms in cutaneous wounds: tipping the balance[J]. Tissue Eng Part B Rev, 2022, 28(5): 1151-1167. DOI:10.1089/ten.TEB.2021.0114 |
| [18] |
WILLYARD C. Unlocking the secrets of scar-free skin healing[J]. Nature, 2018, 563(7732): S86-S88. DOI:10.1038/d41586-018-07430-w |
| [19] |
HOU C, WANG Y, ZHU E, et al. Coral calcium hydride prevents hepatic steatosis in high fat diet-induced obese rats: a potent mitochondrial nutrient and phase Ⅱ enzyme inducer[J]. Biochem Pharmacol, 2016, 103: 85-97. DOI:10.1016/j.bcp.2015.12.020 |
| [20] |
曹烨骏, 殷文哲, 及川胤昭, 等. 氢化珊瑚钙对衰老小鼠的抗氧化作用的影响[J]. 中国老年学杂志, 2014, 34(4): 982-984. DOI:10.3969/j.issn.1005-9202.2014.04.055 |
| [21] |
YANG Y, ZHU Y, XI X. Anti-inflammatory and antitumor action of hydrogen via reactive oxygen species[J]. Oncol Lett, 2018, 16(3): 2771-2776. DOI:10.3892/ol.2018.9023 |
| [22] |
LI Q, JIAO Y, YU Y, et al. Hydrogen-rich medium alleviates high glucose-induced oxidative stress and parthanatos in rat Schwann cells in vitro[J]. Mol Med Report, 2019, 19(1): 338-344. DOI:10.3892/mmr.2018.9631 |
 2023, Vol. 44
2023, Vol. 44


