2. 中国人民解放军总医院京中医疗区, 北京 100141;
3. 中国人民解放军联勤保障部队第九〇三医院心内科, 杭州 310013
2. Central Beijing Medical Sector, PLA General Hospital, Beijing 100141, China;
3. Department of Cardiology, No. 903 Hospital of Joint Logistics Support Force of PLA, Hangzhou 310013, Zhejiang, China
过氧化物酶体是由单个脂质双分子层构成的球状细胞器,根据其参与的代谢过程不同,内部可能装载有多种不同的相关酶。过氧化物酶体利用过氧化氢的产生和分解来代谢脂肪及中和细胞中的有害分子,它分布在细胞质中,与其他细胞器相互作用[1-2]。有研究表明,细胞器的动态接触和相互作用在调节代谢底物转运和调节过氧化物酶体的生物发生、生长、分裂及周转中起重要作用[3-4]。过氧化物酶体参与多种生理生化过程,也在多种疾病的发展中扮演重要角色。过氧化物酶体基因突变引起的各类细胞器(尤其是线粒体)损伤常与致命的遗传疾病有关,如Zellweger综合征[5-6]。过氧化物酶体除具备代谢相关的功能外,还充当细胞信号转导的枢纽[7]。同时,定位于过氧化物酶体的线粒体抗病毒信号蛋白参与Ⅲ型干扰素反应的启动[8]。
腺病毒是被广泛运用的外源基因转录载体,具有载体基因组大小适中、易于基因重组操作、繁殖滴度高、宿主范围广、安全性好等诸多特点,因此这种基因导入方式往往比其他非病毒转移方式更加有效。同时,腺病毒作为载体可感染多种组织细胞包括高度分化的组织细胞,并复制产生子代病毒。随着免疫原性降低、靶向性改造、包装方法的改进等一系列进展,这种工具性载体正被更加广泛地用于生物医学工程的研究。
为了研究过氧化物酶体在心脏疾病中的作用机制,我们尝试构建了一种特异性标记过氧化物酶体的GFP腺病毒载体,借助腺病毒载体将GFP导入细胞标记并显示可能存在的过氧化物酶体,以期为后续实验搭建稳定的技术平台。
1 材料和方法 1.1 主要试剂与仪器50×TAE缓冲液[生工生物工程(上海)股份有限公司],琼脂糖粉(武汉赛维尔生物科技有限公司),100 bp DNA分子量标准(北京全式金生物技术股份有限公司),0.25%胰蛋白酶(南京杜莱生物技术有限公司),反转录试剂盒ReverTra Ace®qPCR RT Kit、荧光定量PCR试剂盒(日本Toyobo公司),T4多聚核苷酸激酶、pMD-18T载体系统(日本Takara公司),DH5α感受态大肠埃希菌(上海唯地生物技术有限公司),BJ5183感受态细胞[宝日医生物技术(北京)有限公司],5-溴-2-脱氧尿苷(美国Sigma公司),限制性内切酶PmeⅠ、PacⅠ(美国NEB公司),4%多聚甲醛固定液(上海碧云天生物技术有限公司),TRIzol试剂、Hoechst染液(美国ThermoFisher公司)。
TP350型PCR仪(日本Takara公司),6600型双通道实时荧光定量PCR仪(澳大利亚RotorGene公司),低温离心机(日本Hitachi公司),LSM510型激光扫描共聚焦显微镜(德国Carl Zeiss公司),琼脂糖凝胶电泳仪、CO2细胞培养箱、无菌超净工作台(美国ThermoFisher公司)。
1.2 含过氧化物酶体信号肽的GFP序列合成通过美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)官网查询过氧化物酶体信号肽序列,加入GFP序列下游。过氧化物酶体信号肽引物序列由苏州金维智生物科技有限公司合成,正向引物:5'-TAGAAGCTTAGAGG-CGGGACTTGTACAGCTCGTCCATGC-3',反向引物:5'-CCGCTCGAGATGGTGAGCAAGGGCG-AG-3'。经PCR扩增得到含有过氧化物酶体信号肽的GFP序列,行琼脂糖凝胶电泳后割胶回收,并送苏州金维智生物科技有限公司进行Sanger法测序验证。
1.3 含过氧化物酶体信号肽的GFP腺病毒载体的构建将扩增得到的含过氧化物酶体信号肽的GFP片段与腺病毒穿梭质粒载体pAdTrack(上海碧云天生物技术有限公司)连接,将连接产物转化到大肠埃希菌DH5α感受态细胞中获得重组质粒,并进行基因测序确定插入片段是否正确。测序结果正确的重组质粒经限制性内切酶PmeⅠ酶切线性化,然后转化到含腺病毒骨架质粒pAd-Easy-1(上海碧云天生物技术有限公司)的BJ5183感受态细胞中进行重组,获得的重组质粒经PacⅠ酶切后进行琼脂糖凝胶电泳鉴定。
1.4 腺病毒的扩增将293A细胞按1.5×105/mL密度接种于6 cm的细胞培养皿中,待细胞长满培养皿的70%左右,采用脂质体LipofectamineTM 2000介导PacⅠ线性化后的重组含过氧化物酶体信号肽的GFP序列质粒转染细胞,培养7~9 d,当出现细胞病变效应的细胞达到细胞总量的80%以上并出现片状葡萄串珠样时收集细胞,反复冻融,循环3次,收取原始病毒液,获得的病毒颗粒命名为Ad-GFP-Peroxi。将原始病毒液按感染复数(multiplicity of infection,MOI)=10的滴度多次感染293A细胞,获得较高滴度的病毒液,经氯化铯密度梯度离心纯化。将纯化后的病毒液稀释10 000倍,然后按10倍浓度梯度稀释,感染293T细胞(美国ATCC细胞库),37 ℃孵育48 h,荧光显微镜下观察,确定病毒滴度和最佳感染滴度。
1.5 心肌细胞H9C2培养与腺病毒感染大鼠来源的心肌细胞H9C2由海军军医大学(第二军医大学)第一附属医院心血管内科实验室提供。细胞培养采用DMEM培养基,培养条件为37 ℃、5% CO2。分别用Ad-GFP-Peroxi腺病毒和不含过氧化物酶体信号肽的Ad-GFP腺病毒按50 MOI滴度感染培养的H9C2细胞,于37 ℃培养箱孵育。培养48 h后于荧光显微镜下观察绿色荧光强弱。
1.6 心肌细胞H9C2的缺氧培养用Ad-GFP-peioxi腺病毒按50 MOI滴度感染H9C2细胞后,将细胞分为两组:常氧组和低氧组。将低氧组细胞置于37 ℃恒温箱内, 持续通入94% N2、5% CO2、1% O2的混合气体, 维持饱和湿度。常氧组置于37 ℃、5% CO2、饱和湿度的培养箱中。常氧组细胞和低氧组细胞在培养箱中培养24 h后于共聚焦显微镜下观察。
1.7 细胞核荧光染色取细胞吸弃培养基,以PBS洗涤2遍。加入恰好覆盖全部细胞的适量4%多聚甲醛溶液进行固定,15 min后弃去多聚甲醛溶液,用PBS洗涤2遍,加入100 μL Hoechst染液,摇床上缓慢摇晃4 min。随后吸弃染液,以PBS洗涤2遍,加入5 μL抗荧光淬灭封片剂,置于阴暗处保存。
1.8 荧光信号聚集情况分析从常氧及缺氧培养细胞的荧光图中各选择6个H9C2细胞,通过ImageJ软件计算图中荧光点的质心坐标,利用RStudio R-4.2-3软件计算各质心坐标间的距离矩阵,导出各点间欧式距离的平均值。通过欧式距离的变化量化荧光标记间聚集情况。
1.9 统计学处理应用GraphPad Prism 8.0软件进行统计学分析。实验至少独立重复3次,数据以x±s表示,两组间比较采用非配对双尾t检验。检验水准(α)为0.05。
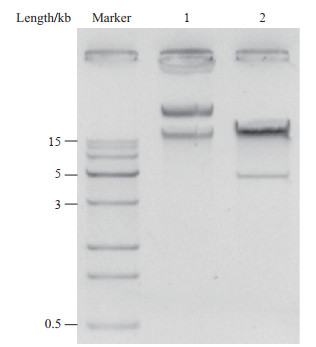
2 结果 2.1 含过氧化物酶体信号肽的GFP腺病毒载体的鉴定获得的重组质粒用PacⅠ酶切线性化后行琼脂糖凝胶电泳鉴定,得到长为4 500 kb的片段(图 1),提示重组含过氧化物酶体信号肽GFP腺病毒载体构建成功。
|
图 1 含过氧化物酶体信号肽的GFP腺病毒载体经PacⅠ酶切后行琼脂糖凝胶电泳鉴定 Fig 1 Agarose gel electrophoresis identification of PacⅠ enzyme-digested linearized adenovirus vector with peroxisome signaling peptide 1: pAd-Easy-1; 2: pAd-Easy-1 with peroxisome signaling peptide digested by Pac Ⅰ; GFP: Green fluorescence protein. |
2.2 腺病毒扩增结果
以293A细胞扩增病毒,采用氯化铯梯度离心法纯化病毒。按10倍浓度梯度稀释病毒液后感染293T细胞,48 h后观察绿色荧光强弱,确定重组腺病毒滴度约为1.0×109 PFU/mL(PFU为空斑形成单位)。
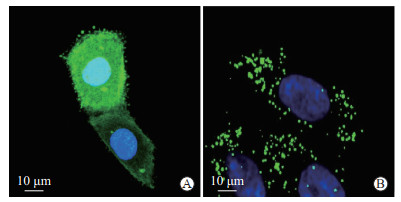
2.3 含过氧化物酶体信号肽的GFP腺病毒对心肌细胞的感染效率及对其过氧化物酶体的标记结果实验结果显示重组腺病毒对培养的H9C2细胞有较高的感染效率。感染后共聚焦显微镜下观察可见,与Ad-GFP腺病毒相比,Ad-GFP-Peroxi腺病毒能够特异性显示大鼠心肌细胞内过氧化物酶体的分布情况(图 2)。
|
图 2 腺病毒感染大鼠心肌细胞的共聚焦显微镜观察 Fig 2 Confocal microscopy observation of adenovirus infected rat cardiomyocytes A: Ad-GFP adenovirus infected cardiomyocytes H9C2; B: Ad-GFP-Peroxi adenovirus infected cardiomyocytes H9C2. GFP: Green fluorescence protein; Peroxi: Peroxisome. |
2.4 缺氧培养下心肌细胞H9C2内过氧化物酶体分布的变化
结果显示,与正常培养的H9C2细胞相比,缺氧培养下细胞内过氧化物酶体出现明显聚集。见图 3。荧光信号聚集情况分析结果显示,低氧组H9C2细胞内过氧化物酶体之间的欧氏距离明显短于常氧组[(0.57±0.06)μm vs(1.00±0.24)μm,P<0.01],提示细胞内过氧化物酶体出现聚集。

|
图 3 共聚焦显微镜观察过氧化物酶体在大鼠心肌细胞内分布的变化 Fig 3 Changes of peroxisome distribution in rat cardiomyocytes observed by confocal microscopy A, C: Cardiomyocytes H9C2 cultured under normal conditions for 24 h; B, D: Cardiomyocytes H9C2 cultured under hypoxia condition (1% O2 concentration) for 24 h. |
3 讨论
过氧化物酶体是一种存在于所有真核生物的单层膜细胞器,在多种底物的分解代谢中发挥作用,如脂肪酸、D-氨基酸、L-α-羟基酸、尿酸和多胺。为了更好地探讨过氧化物酶体在心肌缺血缺氧过程中的功能及作用机制,实现对心肌细胞的高效感染,我们尝试构建了含有过氧化物酶体信号肽的GFP腺病毒载体。蛋白质在细胞内通常由各种标签引导其运输与加工,这些标签包括信号肽、线粒体定向肽、核定位信号及过氧化物酶体信号肽等。最常见的过氧化物酶体信号肽是过氧化物酶体信号肽1(peroxisomal targeting signal 1,PTS1),它是羧基末端的丝氨酸-赖氨酸-亮氨酸三肽。大多数过氧化物酶体基质蛋白具有PTS1型信号肽。过氧化物酶体中所有的酶都由核基因编码,在细胞质基质中合成,在信号肽及信号肽的引导下进入过氧化物酶体[9]。本实验利用PTS1型信号肽将GFP定位于H9C2细胞的过氧化物酶体中,从而对其进行特异性标记。
越来越多的证据表明,脂质代谢与铁死亡之间关系密切[10-12]。铁死亡是梗死区心肌细胞死亡的重要模式,可能在缺血性心脏病病理过程中发挥重要作用,寻找新的铁死亡分子靶点正逐渐成为心血管研究领域的焦点。定量蛋白质组学分析表明,心肌梗死发生时谷胱甘肽过氧化物酶4的下调会促进心肌细胞的铁死亡[13]。葛根素可通过诱导铁蛋白产生、减少活性氧和还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4的表达缓解心肌细胞铁死亡并预防心力衰竭[14]。然而,尚未有充足的研究将过氧化物酶体及其参与的脂质代谢过程与铁死亡在心血管疾病中的作用建立联系。而监测某种分子或微小细胞结构在不同时相中的变化并对其进行定性、定量检测,对于各类相关实验设计而言一直都是较为重要也较难突破的实验方法。因此,我们希望通过对心肌细胞中过氧化物酶体的特异性荧光标记,为细胞中过氧化物酶体的定性、定量检测与分布、定位观察提供一种可能性,使研究者可以更为精确有效地获取相关数据,并为进一步研究过氧化物酶体是否参与缺血性心脏病或其他疾病的发生、发展,以及进一步了解其具体的作用机制提供新思路和可靠的方法。
我们探讨了过氧化物酶体特异性GFP腺病毒载体的构建方法,以期实现对心肌细胞较高的感染效率。本研究利用过氧化物酶体信号肽构建了GFP重组腺病毒,该法具有可以简单快捷构建筛选重组体的优点,实现了对培养的大鼠心肌细胞的较高感染效率。我们将腺病毒Ad-GFP-Peroxi按50 MOI滴度感染大鼠心肌细胞,通过荧光显微镜观察发现,感染后24 h可见绿色荧光。通过共聚焦显微镜发现,Ad-GFP-Peroxi感染大鼠心肌细胞在缺氧条件下过氧化物酶体出现明显聚集。
腺病毒属于线性双链DNA无包膜病毒,病毒基因组较少发生重排,比较稳定,多被用于表达各种细胞和病毒的基因[15]。重组腺病毒表达载体是以腺病毒为基础发展起来的工具病毒载体,其免疫原性强、基因容量大,不会整合到染色体中,仅瞬间表达,故安全性高,同时具有高感染效率、高蛋白表达水平等特点,感染后的数小时,基因表达便可被检测到。此外,腺病毒表达载体具有广泛的宿主范围,对分裂细胞和非分裂细胞均具有感染能力,故重组腺病毒表达载体是研究原代非增殖细胞基因表达的最佳工具。
对于传统应用的荧光素标记法,本研究使用的是GFP。相比其他已有方法,GFP对于靶细胞器具有更强的特异性且荧光更为稳定[16],亮度高、可辨识性较好。由于腺病毒载体的特点,本方法也适宜在活体成像中应用,且相对而言更为经济,对实验设备要求也更低,在各类实验中的适用性较为广泛[17-19]。此外,相比诸如以碘标记和生物合成法标记为主的核素标记法,本方法更具有安全性和易操作性,且在量化评价时我们通过荧光信号间欧氏距离评估其相对位置变化,结果更为直观。
综上所述,本研究探讨了过氧化物酶体特异性GFP腺病毒的制备过程,并证实利用同源重组方法构建的过氧化物酶体特异性GFP腺病毒能够成功标记大鼠心肌细胞内过氧化物酶体、显示其在细胞内的分布,为进一步研究过氧化物酶体对心血管疾病的影响及寻找其潜在作用机制搭建了稳定的技术平台。
| [1] |
LAZAROW P B, FUJIKI Y. Biogenesis of peroxisomes[J]. Annu Rev Cell Biol, 1985, 1: 489-530. DOI:10.1146/annurev.cb.01.110185.002421 |
| [2] |
SMITH J J, AITCHISON J D. Peroxisomes take shape[J]. Nat Rev Mol Cell Biol, 2013, 14(12): 803-817. DOI:10.1038/nrm3700 |
| [3] |
PLATTA H W, ERDMANN R. Peroxisomal dynamics[J]. Trends Cell Biol, 2007, 17(10): 474-484. DOI:10.1016/j.tcb.2007.06.009 |
| [4] |
SHAI N, SCHULDINER M, ZALCKVAR E. No peroxisome is an island-peroxisome contact sites[J]. BiochimBiophys Acta, 2016, 1863(5): 1061-1069. DOI:10.1016/j.bbamcr.2015.09.016 |
| [5] |
WATERHAM H R, FERDINANDUSSE S, WANDERS R J A. Human disorders of peroxisome metabolism and biogenesis[J]. BiochimBiophys Acta, 2016, 1863(5): 922-933. DOI:10.1016/j.bbamcr.2015.11.015 |
| [6] |
SALPIETRO V, PHADKE R, SAGGAR A, et al. Zellweger syndrome and secondary mitochondrial myopathy[J]. Eur J Pediatr, 2015, 174(4): 557-563. DOI:10.1007/s00431-014-2431-2 |
| [7] |
ZHANG J, KIM J, ALEXANDER A, et al. A tuberous sclerosis complex signalling node at the peroxisome regulates mTORC1 and autophagy in response to ROS[J]. Nat Cell Biol, 2013, 15(10): 1186-1196. DOI:10.1038/ncb2822 |
| [8] |
DIXIT E, BOULANT S, ZHANG Y, et al. Peroxisomes are signaling platforms for antiviral innate immunity[J]. Cell, 2010, 141(4): 668-681. DOI:10.1016/j.cell.2010.04.018 |
| [9] |
WALTER T, ERDMANN R. Current advances in protein import into peroxisomes[J]. Protein J, 2019, 38(3): 351-362. DOI:10.1007/s10930-019-09835-6 |
| [10] |
LEE H, ZANDKARIMI F, ZHANG Y, et al. Energy-stress-mediated AMPK activation inhibits ferroptosis[J]. Nat Cell Biol, 2020, 22(2): 225-234. DOI:10.1038/s41556-020-0461-8 |
| [11] |
DOLL S, PRONETH B, TYURINA Y Y, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13(1): 91-98. DOI:10.1038/nchembio.2239 |
| [12] |
陈奕婷, 王培. 非凋亡程序性细胞死亡在代谢相关脂肪性肝病中的作用[J]. 海军军医大学学报, 2023, 44(6): 657-665. CHEN Y, WANG P. Roles of non-apoptotic programmed cell death in metabolic-associated fatty liver disease[J]. Acad J Naval Med Univ, 2023, 44(6): 657-665. DOI:10.16781/j.CN31-2187/R.20220745 |
| [13] |
PARK T J, PARK J H, LEE G S, et al. Quantitative proteomic analyses reveal that GPX4 downregulation during myocardial infarction contributes to ferroptosis in cardiomyocytes[J]. Cell Death Dis, 2019, 10(11): 835. DOI:10.1038/s41419-019-2061-8 |
| [14] |
LIU B, ZHAO C, LI H, et al. Puerarin protects against heart failure induced by pressure overload through mitigation of ferroptosis[J]. BiochemBiophys Res Commun, 2018, 497(1): 233-240. DOI:10.1016/j.bbrc.2018.02.061 |
| [15] |
林洁, 袁镜皓, 麻献华, 等. ZBTB20基因干扰腺病毒的制备及功能鉴定[J]. 海军军医大学学报, 2023, 44(3): 292-297. LIN J, YUAN J, MA X, et al. Preparation and functional characterization of ZBTB20-interfering adenovirus[J]. Acad J Naval Med Univ, 2023, 44(3): 292-297. DOI:10.16781/j.CN31-2187/R.20220891 |
| [16] |
LIU C Y, ZHU J, XIE Z. Visualizing yeast organelles with fluorescent protein markers[J]. J Vis Exp, 2022(182): e63846. DOI:10.3791/63846 |
| [17] |
METZ J, CASTRO I, SCHRADER M. Peroxisome motility measurement and quantification assay[J]. Bio Protoc, 2017, 7(17): e2536. DOI:10.21769/bioprotoc.2536 |
| [18] |
STELLMACH H, HOSE R, RÄDE A, et al. A new set of golden-gate-based organelle marker plasmids for colocalization studies in plants[J]. Plants, 2022, 11(19): 2620. DOI:10.3390/plants11192620 |
| [19] |
MILDNER K, ZEUSCHNER D. Cryo-immuno electron microscopy of peroxisomal marker proteins[J]. Methods Mol Biol, 2017, 1595: 101-111. DOI:10.1007/978-1-4939-6937-1_11 |
 2023, Vol. 44
2023, Vol. 44


