经椎间孔腰椎椎体间融合术(transforaminal lumbar interbody fusion,TLIF)是一种常用于治疗脊柱疾病的手术技术。研究表明,微创(minimally invasive,MIS)-TLIF较开放式TLIF有诸多优势[1-5]。当前脊柱外科进展的趋势为逐渐微创化,包括内窥镜的使用、机器人辅助和导航引导下的螺钉安置[6-7]。为了进一步改善患者预后和加速康复,脊椎麻醉在脊柱手术中的应用越来越受到关注。脊椎麻醉是临床常用的一种麻醉方法,将局麻药注入到蛛网膜下腔,作用于脊神经根而使相应部位产生麻醉作用,又称蛛网膜下腔麻醉,俗称腰麻。脊椎麻醉尤其适用于腰椎椎板减压术和椎间盘摘除术,适用于脊柱围手术期加速康复外科(enhanced recovery after surgery,ERAS)治疗理念[8-12]。
目前全身麻醉和脊椎麻醉均已运用于开放式腰椎疾病的手术治疗,但全身麻醉的应用更为广泛。局部区域麻醉作为加速患者康复的重要组成部分[13],在骨科手术中脊椎麻醉被广泛用于治疗下肢创伤和关节置换术,但该麻醉方式在MIS-TLIF中尚未被广泛运用。研究发现,在开放式行腰椎椎板减压和椎间盘切除术中,脊椎麻醉能减少药物消耗和止痛剂的使用、缩短麻醉和手术时间、减少失血及患者术后恶心和呕吐情况,从而降低了围手术期的成本[14-19]。
目前尚无相关研究探讨在MIS-TLIF中脊椎麻醉与全身麻醉的围手术期疗效和潜在益处。本研究通过回顾性队列研究分析2019年1月至2021年12月于成都大学附属医院行MIS-TLIF治疗患者的资料,比较脊椎麻醉与全身麻醉下患者的围手术期疗效。由于长期疗效和疼痛缓解更多地依赖于患者腰椎间盘突出症神经压迫程度和手术减压融合的有效性,而较少依赖于麻醉类型,本研究将观察指标重点放在围术期和术中结果,以确定这2种麻醉方式在MIS-TLIF中的潜在好处和风险,为MIS-TLIF患者麻醉方式的选择提供参考。
1 对象和方法 1.1 研究对象 1.1.1 纳入标准(1)诊断为因腰椎退行性椎间盘疾病、椎管狭窄、腰椎Ⅰ°或Ⅱ°退行性滑脱,存在下肢放射痛、麻木、间歇性跛行,经保守治疗3个月无效而行MIS-TLIF治疗的患者;(2)病历资料完整,影像学及围手术期资料完整;(3)无其他手术禁忌。
1.1.2 排除标准(1)合并其他脊柱疾病(如结核、肿瘤、感染等);(2)有癫痫或颅内高压病史;(3)穿刺部位感染;(4)有严重凝血功能障碍;(5)脊髓造影显示蛛网膜炎;(6)无法俯卧位者;(7)无法耐受手术者。
依据纳入和排除标准,选择2019年1月至2021年12月于成都大学附属医院行MIS-TLIF的40例患者作为研究对象。40例患者中男19例、女21例,年龄36~78岁,平均年龄(63.78±11.94)岁。包括肥胖(BMI>28 kg/m2)者16例,2型糖尿病7例,高血压病25例,阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)6例,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅱ级19例、Ⅲ级21例。
根据麻醉方式的不同将患者分为脊椎麻醉组和全身麻醉组,每组20例。对两组患者的一般资料进行比较,包括合并症(肥胖、高血压、糖尿病和OSAHS)、ASA级别,以验证其同质性。麻醉科、手术团队医师成员在本研究期间保持不变。术前麻醉医师随访患者并检查病历,与患者及手术团队医师确认内科、外科和麻醉史,以确定最合适的麻醉方案。具体麻醉药物的选择由麻醉医师自行决定,所有患者均采用ASA标准监测。
1.2 麻醉方法 1.2.1 全身麻醉患者术前一般给予咪达唑仑(1~2 mg)和/或芬太尼(25~150 μg)静脉注射。在100%氧气预充氧后,异丙酚(1.5~2.0 mg/kg)静脉联合利多卡因(20-100 mg)和芬太尼(50~250 μg)诱导全身麻醉。在静脉注射罗库溴铵(0.6~1.2 mg/kg)或琥珀胆碱(1 mg/kg)实现充分的肌肉松弛后,通过直接或可视喉镜进行气管插管。患者取俯卧位,头部置于泡沫枕头中。以异丙酚(75~200 mg/(kg·min)或七氟醚(含40%~70%氧气,1.0%~2.0%)维持全身麻醉。手术完成后,将患者从俯卧位置于仰卧位,停止麻醉。充分逆转非去极化肌肉松弛剂后,在患者清醒、自主呼吸并听从指令后拔管。椎间孔镜下融合手术完成切口关闭后,手术切口处予以0.375%罗哌卡因10 mL局部浸润麻醉。
1.2.2 脊椎麻醉患者术前一般给予咪达唑仑(1~2 mg)和/或芬太尼(25~150 μg)静脉注射。在手术室患者取坐位,身体微前倾,用局部洗必泰溶液清洗背部。予以2%利多卡因(0.5~2 mL)皮下局部麻醉后,在无菌条件下(经术者确认高于或低于手术区域节段)椎间隙间引入脊髓穿刺针。确认针尖在蛛网膜下腔,有流动的脑脊液存在。等压布比卡因(0.5%,2.5 mL)、2 μg芬太尼和0.2 mg肾上腺素在蛛网膜下腔缓慢注射。然后患者俯卧在Wilson框架上,头部放置于有足够通风的泡沫枕头中,以防止二氧化碳循环再呼吸。给予轻度镇静,包括静脉注射右美托咪定[(0.2~0.7 μg/(kg·h)]和/或异丙酚[(10~50 μg/(kg·min)]。确定手术麻醉平面及麻醉深度后进行手术,术中通常不安置导尿管。手术完成后,将患者置于仰卧位,停止麻醉。所有患者均接受标准化围手术期多模式镇痛(术前等待区开始,每6 h口服对乙酰氨基酚1 000 mg)并予以恶心、呕吐预防(苏醒前静脉注射恩丹司琼4 mg)。术后每4 h给予氢可酮对乙酰氨基酚(10~325 mg)止痛;对于严重疼痛,部分患者给予氢吗啡酮(0.2 mg,静脉注射)。一旦脊髓阻滞消失,患者就被动员起来,并监测尿潴留。手术结束时,手术切口处予以0.375%罗哌卡因10 mL,提供长效局部麻醉[20]。
1.3 围手术期统计指标从电子医疗记录系统收集数据,包括:(1)总手术室时间,指患者从进入手术室至离开手术室的时间。(2)总手术时间,指从手术切开皮肤时间至贴附手术切口敷料后的时间。(3)离开手术室时间,指从手术切口贴附敷料后至患者离开手术室的时间。(4)术中估计失血量采用称重法,检测吸引器储液罐中的血量并对沾血纱布进行称重,浸湿32 cm×20 cm大小的纱布计失血30 mL,浸湿36 cm×36 cm大小的纱布计失血50 mL;对无菌巾及地板上可见的血液进行估算。(5)术后住院时间,指手术后至出院时的时间;(6)麻醉后监测治疗室(post-anesthesia care unit,PACU)中3 h内接受的所有止痛药物的需求量。弱阿片类药物如曲马多、布桂嗪等;强阿片类药物吗啡、羟考酮、芬太尼等。为了分析术后麻醉需求,麻醉医师计算弱阿片类药物与强阿片类如吗啡等镇痛剂剂量的转换。该计算方式中等效镇痛的转换基于美国疼痛协会发布的指南[21-22]。(7)在PACU中3 h内所有的数值评定量表(numeric rating scale,NRS)疼痛评分(0~10分)。0分为无疼痛;1~3分为轻度疼痛;4~6分为中度疼痛;7~10分为重度疼痛。(8)初次下床时间,即患者从离开手术室到第1次下床的时间。(9)患者术后第1次接受镇痛药物的时间。(10)在PACU观察期间患者恶心或实际呕吐发作情况。
1.4 围手术期镇痛及止吐方案两组患者在到达手术室前均接受术前多模式镇痛药物,包括口服对乙酰氨基酚(1 000 mg)、塞来昔布(200 mg)和羟考酮(10 mg)。术中为预防恶心和呕吐予静脉注射地塞米松(10 mg)和恩丹司琼(4 mg)。术后中度疼痛的患者给予口服羟考酮(5~10 mg),重度疼痛的给予静脉注射氢吗啡酮(0.2~0.5 mg)。
1.5 术中血流动力学参数包括患者首次进入手术室时记录平均心率和平均动脉血压,随后监测每分钟的平均心率和每5 min的平均动脉血压。
1.6 术后并发症(1)全身麻醉苏醒延迟:手术麻醉结束后患者苏醒时间>90 min;(2)循环系统并发症:持续低血压、高血压、心律失常、心肌缺血。(3)呼吸系统并发症:呼吸道梗阻、通气不足、低氧血症、术后肺部感染等;(4)持续性低体温;(5)术后持续性寒战,出现不自主的肌肉收缩抽动;(6)术后持续性躁动及烦躁不安;(7)脑脊液漏及持续性术后头疼;(8)穿刺部位持续性不可缓解疼痛;(9)严重尿潴留:膀胱平滑肌舒张过度造成的严重尿液潴留。(10)穿刺部位不当引起神经根的损伤,出现腰痛或下肢局部运动、感觉异常。
1.7 统计学处理应用SPSS 24.0软件对数据进行统计分析。符合正态分布且方差齐的计量资料以x±s表示,两组间比较采用独立样本t检验。计数资料以例数和百分数表示,组间比较采用χ2检验,若1≤理论频数<5则采用校正χ2检验,理论频数<1时采用Fisher确切概率法。检验水准(α)取双侧0.05。
2 结果 2.1 一般资料比较脊椎麻醉组与全身麻醉组患者的年龄、性别、BMI、合并症(肥胖、高血压、糖尿病和OSAHS)、ASA分级、减压固定节段的差异均无统计学意义(P均>0.05),见表 1。手术均顺利完成,无脊椎麻醉失败后转行全身麻醉的患者,无术中不良事件发生,无术中脑脊液漏及气道并发症发生。全身麻醉组有1例患者术后并发肺部感染,遵呼吸科会诊意见予以头孢曲松抗感染,雾化祛痰后症状缓解。
|
|
表 1 两组行微创经椎间孔腰椎椎体间融合术患者的一般资料比较 Tab 1 General data of patients undergoing minimally invasive transforaminal lumbar interbody fusion in 2 groups |
2.2 围手术期指标比较
脊椎麻醉组患者的总手术室时间较全身麻醉组减少约14.00%(约31 min),两组间差异有统计学意义[(192.18±18.09)minvs(223.22±19.54)min,P<0.001]。相较于全身麻醉组,脊椎麻醉组离开手术室时间短[(5.44±1.95)min vs(9.94±1.28)min,P<0.001],术中平均心率低[(67.39±7.44)min-1 vs(72.94±8.61)min-1,P=0.035],术中平均动脉压低[(78.38±9.88)mmHg vs(84.47±8.30)mmHg,P=0.041](1 mmHg=0.133 kPa),PACU 3 h内NRS疼痛评分低[(3.81±1.87)分vs(5.43±2.24)分,P=0.017],PACU 3 h内阿片类镇痛药物(硫酸吗啡)需求量少[(5.36±1.71)mg vs(7.22±2.01)mg,P=0.003],术后第1次使用止痛药时间晚[(58.11±20.19)min vs(45.58±17.16)min,P=0.041],术后初次下床时间早[(430.77±122.38)min vs(843.86±95.44)min,P<0.001]。两组的总手术时间、术中出血量、术后住院时间的差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 两组行微创经椎间孔腰椎椎体间融合术患者的围手术期相关指标比较 Tab 2 Perioperative indexes of patients undergoing minimally invasive transforaminal lumbar interbody fusion in 2 groups |
2.3 典型病例影像学资料
脊椎麻醉组与全身麻醉组典型病例手术检查及治疗情况的影像资料见图 1、图 2。

|
图 1 脊椎麻醉下行微创经椎间孔腰椎椎体间融合术患者术前、术中及术后影像学资料 Fig 1 Preoperative, intraoperative, and postoperative imaging data of patients undergoing minimally invasive transforaminal lumbar interbody fusion under spinal anesthesia The patient (69 years old, female) underwent endoscopic L4-5 disc removal, spinal nerve root decompression and release, cage interbody fusion, and percutaneous pedicle screw fixation under spinal anesthesia. The operation was successful. A: X-ray, CT and MRI examinations showed lumbar degenerative changed; the posterior center of the L4-5 disc was prolapsed to the left, the dural sac was clearly compressed, and the spinal canal was narrow. B: After spinal anesthesia, the disc was removed under endoscope, the endplate was treated, the fusion device was placed, and the incision was sutured. C: Postoperative X-ray review showed that the screw and fusion device were in good position. CT: Computed tomography; MRI: Magnetic resonance imaging. |
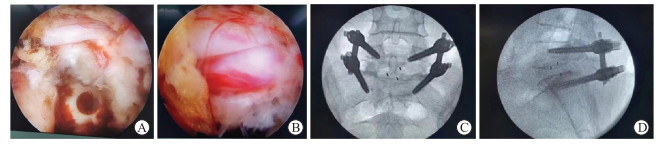
|
图 2 全身麻醉下行微创经椎间孔腰椎椎体间融合术患者术中及术后影像学资料 Fig 2 Intraoperative and postoperative imaging data of patients undergoing minimally invasive transforaminal lumbar interbody fusion under general anesthesia The patient (72 years old, female) with L5-S1 disc herniation, lumbar spondylolysis of L5 pedicle with true spondylolisthesis, lumbago with right lower limb pain and numbness underwent minimally invasive transforaminal lumbar interbody fusion decompression and fusion fixation under general anesthesia. A: For disc removal under general anesthesia, a cage interbody fusion cage was placed in the L5-S1 intervertebral space for bone graft fusion; B: For intraoperative endoscopic disc removal, hyperemia and edema after decompression of the right nerve root of S1; C, D: Anteroposterior and lateral positions of the C-arm lumbar spine under general anesthesia. |
3 讨论
脊椎麻醉作为全身麻醉在脊柱外科手术中的替代选择越来越受关注[23]。本研究为回顾性病例对照研究,以同一围手术期团队(包括主刀医师、麻醉医师、护士)的治疗护理,比较脊椎麻醉和全身麻醉在MIS-TLIF中的应用情况。既往研究中,Wang等[24]报道了局部麻醉下脊柱内镜TLIF减压融合经皮螺钉固定的有效性和安全性。本研究结果显示,脊椎麻醉组的总手术室时间和离开手术室时间均短于全身麻醉组,两组均无术中麻醉失败事件发生。由于术中接受脊椎麻醉时无需气管插管,术后大大节省了拔管时间、麻醉复苏时间、呼吸功能恢复时间,从而缩短了总手术室时间及离开手术室时间[8]。两组麻醉方式不同,血流动力学特征不同,脊椎麻醉组患者的术中平均心率较全身麻醉组患者的低。研究证实脊椎麻醉相较于全身麻醉血流动力学参数更优,当患者被允许自主呼吸时胸腔内压力降低,并结合交感神经阻滞,可有效控制心室率[9]。多项研究表明,脊椎麻醉组患者的心率和血压较全身麻醉组患者的低[25],脊椎麻醉较全身麻醉血流动力学稳定性的改善可能是由于术中抑制了应激激素的释放,导致平均动脉压、心率的升高和波动较低[26]。本研究结果显示,对于MIS-TLIF,2种麻醉方法之间平均心率及平均动脉压差异有统计学意义。本研究发现,在给予脊椎麻醉后接受MIS-TLIF治疗患者术后疼痛更少,与给予全身麻醉后接受MIS-TLIF治疗患者相比,在PACU中3 h内的平均NRS疼痛评分更低、阿片类镇痛药品需求量更少,术后第1次使用止痛药时间更晚,表明接受脊椎麻醉手术的患者术后疼痛控制相对更好。采用脊椎麻醉相较于全身麻醉进行MIS-TLIF的患者术后初次下床时间提前,脊椎麻醉组患者有可能更快恢复并减少并发症的发生。
全身麻醉是目前脊柱手术的首选技术[1]。研究表明,高危患者可能无法耐受全身麻醉的并发症或不良反应[27]。如控制不良的糖尿病、心脏或冠状动脉疾病、无法控制的高血压、慢性阻塞性肺疾病、过敏和甲状腺肿,均被认为是高危患者。高危患者全身麻醉可能的并发症有头痛、背痛、恶心呕吐、牙齿损伤、喉咙痛和喉部损伤或痉挛、麻醉药继发的过敏反应、心血管意外、呼吸抑制、吸入性肺炎、体温过低、缺氧脑损伤、因体位引起的视神经损伤、栓塞(空气或血栓)和死亡等。脊椎麻醉更适合高危患者,用高压氧或等压局部麻醉药更容易达到适合腰椎手术所需的麻醉程度。在脊椎麻醉行MIS-TLIF时需十分明确手术所需的麻醉平面,术中需及时有效避免手术刺激引起的血流动力学变化[28]。一般情况下,L1~L5手术需要至少T6~T8皮肤感觉水平,坐位行脊椎麻醉后于俯卧位进行手术将更有利于成功麻醉。尽管所需的麻醉平面高于手术部位的水平,但较高的水平的麻醉平面将尽可能提高脊椎麻醉的成功率,保证手术顺利进行,并根据局部麻醉药的选择,允许手术麻醉覆盖范围的缓慢消退[24]。布比卡因被认为是首选的脊椎麻醉药剂,因为它可以提供足够的覆盖时间[29]。此外,也有一些麻醉医师选择在局部麻醉药中添加其他药物,如阿片类药物、肾上腺素、去甲肾上腺素、新斯的明和可乐定等。在本研究中使用了等压布比卡因(0.5%,2.5 mL)、2 μg芬太尼和0.2 mg的肾上腺素用于脊椎麻醉。镇静剂用于脊椎麻醉可以减轻焦虑,提高患者的舒适度和配合力[22]。虽然脊椎麻醉仅提供手术部位的麻醉便可完成手术,但若术中未辅助镇静药物,患者将仍然存在自主意识,由于患者术中不得不长时间保持在同一个位置及手术室的环境噪音,将会使患者感觉不适,所以脊椎麻醉术中辅助少量镇静药物是行之有效的[30]。然而,镇静剂可能会导致气道阻塞,镇静过度后老年患者可能表现出精神运动恢复延迟。但在本组患者的术中辅助小剂量镇静剂后未出现如延迟患者术后复苏、气道阻塞、缺氧、低血压等并发症。
本研究存在一定局限性:研究设计为回顾性病例对照研究,样本量相对较小且随访时间较短,未观察到长期的术后并发症情况。脊椎麻醉组与全身麻醉组患者一般资料比较结果提示,两组的同质性尚可,所有患有影响麻醉方法选择的疾病者尽可能排除在本研究之外。未来仍需要进行前瞻性、大样本随机对照试验进一步验证。
| [1] |
ATTARI M A, MIRHOSSEINI S A, HONARMAND A, et al. Spinal anesthesia versus general anesthesia for elective lumbar spine surgery: a randomized clinical trial[J]. J Res Med Sci, 2011, 16(4): 524-529. |
| [2] |
MOBBS R J, PHAN K, MALHAM G, et al. Lumbar interbody fusion: techniques, indications and comparison of interbody fusion options including PLIF, TLIF, MI-TLIF, OLIF/ATP, LLIF and ALIF[J]. J Spine Surg, 2015, 1(1): 2-18. DOI:10.3978/j.issn.2414-469X.2015.10.05 |
| [3] |
DE BIASE G, CHEN S, AKINDURO O, et al. Awake robotic minimally invasive L4-5 transforaminal lumbar interbody fusion[J]. World Neurosurg, 2021, 148: 93. DOI:10.1016/j.wneu.2021.01.005 |
| [4] |
PARKER S L, MENDENHALL S K, SHAU D N, et al. Minimally invasive versus open transforaminal lumbar interbody fusion for degenerative spondylolisthesis: comparative effectiveness and cost-utility analysis[J]. World Neurosurg, 2014, 82(1/2): 230-238. DOI:10.1016/j.wneu.2013.01.041 |
| [5] |
AGARWAL P, PIERCE J, WELCH W C. Cost analysis of spinal versus general anesthesia for lumbar diskectomy and laminectomy spine surgery[J]. World Neurosurg, 2016, 89: 266-271. DOI:10.1016/j.wneu.2016.02.022 |
| [6] |
JELLISH W S, EDELSTEIN S. Spinal anesthesia for lower level spine surgery [M/OL]//WHIZAR-LUGO V M. Topics in spinal anaesthesia. InTech, 2014: 19-38(2014-09-08) [2022-04-01]. https://www.intechopen.com/chapters/47182.
|
| [7] |
PHAN K, RAO P J, KAM A C, et al. Minimally invasive versus open transforaminal lumbar interbody fusion for treatment of degenerative lumbar disease: systematic review and meta-analysis[J]. Eur Spine J, 2015, 24(5): 1017-1030. DOI:10.1007/s00586-015-3903-4 |
| [8] |
YOON J W, WANDERMAN N R, KEREZOUDIS P, et al. Enterobacter infection after spine surgery: an institutional experience[J]. World Neurosurg, 2019, 123: e330-e337. DOI:10.1016/j.wneu.2018.11.169 |
| [9] |
DE BIASE G, GASSIE K, GARCIA D, et al. Perioperative comparison of robotic-assisted versus fluoroscopically guided minimally invasive transforaminal lumbar interbody fusion[J]. World Neurosurg, 2021, 149: e570-e575. DOI:10.1016/j.wneu.2021.01.133 |
| [10] |
LIU B, LIU S, WANG Y, et al. Neurosurgical enhanced recovery after surgery (ERAS) programme for elective craniotomies: are patients satisfied with their experiences? A quantitative and qualitative analysis[J]. BMJ Open, 2019, 9(11): e028706. DOI:10.1136/bmjopen-2018-028706 |
| [11] |
DENG H, COUMANS J V, ANDERSON R, et al. Spinal anesthesia for lumbar spine surgery correlates with fewer total medications and less frequent use of vasoactive agents: a single center experience[J]. PLoS One, 2019, 14(6): e0217939. DOI:10.1371/journal.pone.0217939 |
| [12] |
BIASE G D, CHEN S, BYDON M, et al. Postoperative restrictions after anterior cervical discectomy and fusion[J]. Cureus, 2020, 12(8): e9532. DOI:10.7759/cureus.9532 |
| [13] |
DE BIASE G, BECHTLE P, LEONE B, et al. Awake minimally invasive transforaminal lumbar interbody fusion with a pedicle-based retraction system[J]. Clin Neurol Neurosurg, 2021, 200: 106313. DOI:10.1016/j.clineuro.2020.106313 |
| [14] |
DONAUER K, BOMBERG H, WAGENPFEIL S, et al. Regional vs general anesthesia for total knee and hip replacement: an analysis of postoperative pain perception from the international PAIN OUT registry[J]. Pain Pract, 2018, 18(8): 1036-1047. DOI:10.1111/papr.12708 |
| [15] |
LESSING N L, EDWARDS C C Ⅱ, BROWN C H Ⅳ, et al. Spinal anesthesia in elderly patients undergoing lumbar spine surgery[J]. Orthopedics, 2017, 40(2): e317-e322. DOI:10.3928/01477447-20161219-01 |
| [16] |
MENG T, ZHONG Z, MENG L. Impact of spinal anaesthesia vs general anaesthesia on peri-operative outcome in lumbar spine surgery: a systematic review and meta-analysis of randomised, controlled trials[J]. Anaesthesia, 2017, 72(3): 391-401. DOI:10.1111/anae.13702 |
| [17] |
KOLCUN JOHN PAUL G, DAMIAN B G, BASIL GREGORY W, et al. Endoscopic transforaminal lumbar interbody fusion without general anesthesia: operative and clinical outcomes in 100 consecutive patients with a minimum 1-year follow-up[J]. Neurosurg Focus, 2019, 46(4): E14. DOI:10.3171/2018.12.FOCUS18701 |
| [18] |
BASARANOGLU G, ERKALP K, SAIDOGLU L, et al. Selective spinal anesthesia for limb amputation above knee level[J]. J Clin Anesth, 2011, 23(2): 169. DOI:10.1016/j.jclinane.2010.03.008 |
| [19] |
WALCOTT B P, KHANNA A, YANAMADALA V, et al. Cost analysis of spinal and general anesthesia for the surgical treatment of lumbar spondylosis[J]. J Clin Neurosci, 2015, 22(3): 539-543. DOI:10.1016/j.jocn.2014.08.024 |
| [20] |
VURAL C, YORUKOGLU D. Comparison of patient satisfaction and cost in spinal and general anesthesia for lumbar disc surgery[J]. Turk Neurosurg, 2014, 24(3): 380-384. DOI:10.5137/1019-5149.JTN.8575-13.0 |
| [21] |
DAVIS F M, LAURENSON V G, LEWIS J, et al. Metabolic response to total hip arthroplasty under hypobaric subarachnoid or general anaesthesia[J]. Br J Anaesth, 1987, 59(6): 725-729. DOI:10.1093/bja/59.6.725 |
| [22] |
MCLAIN R F, KALFAS I, BELL G R, et al. Comparison of spinal and general anesthesia in lumbar laminectomy surgery: a case-controlled analysis of 400 patients[J]. J Neurosurg Spine, 2005, 2(1): 17-22. DOI:10.3171/spi.2005.2.1.0017 |
| [23] |
KAI-HONG CHAN A, CHOY W, MILLER C A, et al. A novel technique for awake, minimally invasive transforaminal lumbar interbody fusion: technical note[J]. Neurosurg Focus, 2019, 46(4): E16. DOI:10.3171/2019.1.focus18510 |
| [24] |
WANG M Y, GROSSMAN J. Endoscopic minimally invasive transforaminal interbody fusion without general anesthesia: initial clinical experience with 1-year follow-up[J]. Neurosurg Focus, 2016, 40(2): E13. DOI:10.3171/2015.11.FOCUS15435 |
| [25] |
Principles of analgesic use in the treatment of acute pain and chronic cancer pain, 2nd edition. American Pain Society[J]. Clin Pharm, 1990, 9(8): 601-612. |
| [26] |
ANDERSON R, SAIERS J H, ABRAM S, et al. Accuracy in equianalgesic dosing[J]. J Pain Symptom Manag, 2001, 21(5): 397-406. DOI:10.1016/S0885-3924(01)00271-8 |
| [27] |
KARA I, CELIK J B, OC B, et al. Comparison of spinal and general anesthesia in lumbar disc surgery[J]. J Neurol Sci, 2011, 28(4): 487-496. DOI:10.4236/ojanes.2015.57031 |
| [28] |
SADROLSADAT S H, MAHDAVI A R, MOHARARI R S, et al. A prospective randomized trial comparing the technique of spinal and general anesthesia for lumbar disk surgery: a study of 100 cases[J]. Surg Neurol, 2009, 71(1): 60-65. DOI:10.1016/j.surneu.2008.08.003 |
| [29] |
EDGCOMBE H, CARTER K, YARROW S. Anaesthesia in the prone position[J]. Br J Anaesth, 2008, 100(2): 165-183. DOI:10.1093/bja/aem380 |
| [30] |
PARKER S L, ADOGWA O, BYDON A, et al. Costeffectiveness of minimally invasive versus open transforaminal lumbar interbody fusion for degenerative spondylolisthesis associated low-back and leg pain over two years[J]. World Neurosurg, 2012, 78(1/2): 178-184. DOI:10.1016/j.wneu.2011.09.013 |
 2023, Vol. 44
2023, Vol. 44


