2. 海军军医大学(第二军医大学)海军特色医学中心潜水与高气压医学研究室, 上海 200433
2. Department of Diving and Hyperbaric Medical Research, Naval Medical Center, Naval Medical University (Second Military Medical University), Shanghai 200433, China
减压病(decompression sickness,DCS)是由于潜水减压过程中发生不安全脱饱和,使溶解在组织和血液内的惰性气体溢出形成气泡所致,主要症状包括皮肤瘙痒、关节疼痛、神经功能异常、瘫痪甚至死亡等[1]。DCS是潜水作业中的核心医学问题,病情重、救治困难,预防是关键。研究表明,炎症和氧化应激损伤在DCS发病过程中发挥重要作用[1]。具有抗炎、抗氧化功效的药物如迈之灵、乌司他丁等在动物研究中均已被证明具有较好的抗DCS损伤作用[2-3]。芦丁是从云香叶、槐花米和荞麦花等植物中提取的黄酮类化合物,具有较好的抗炎、抗氧化作用[4]。本研究以SD大鼠为研究对象,观察芦丁对DCS模型大鼠脊髓和肺损伤的影响,探讨其对模型大鼠的保护作用。
1 材料和方法 1.1 主要试剂与设备DWC150型小动物加压舱(上海701所杨园医用氧舱厂),酶标检测仪(美国Bio-Tek公司)。芦丁(货号:S2350)购自美国Selleck公司,DMSO(货号:ST038)和BCA蛋白质定量检测试剂盒(货号:P0012)购自江苏碧云天生物科技有限公司,TNF-α(货号:H052-1-2)和IL-1β(货号:H002-1-2)ELISA检测试剂盒购自南京建成生物工程研究所,丙二醛(malondialdehyde,MDA)检测试剂盒(货号:BPE30266)购自上海朗顿生物科技有限公司。
1.2 实验动物分组清洁级雄性SD大鼠购于上海必凯科翼生物科技有限公司[动物生产许可证号:SCXY(沪)2018-0006],饲养于温度为(24±1)℃、湿度为(55±5)%、每12 h昼夜光照循环的动物房内,自由饮食。将80只成年SD大鼠(体重300~310 g)随机分为正常对照组(n=12)、DCS模型组(n=34)、芦丁+DCS模型组(n=34),正常对照组不作任何处理,芦丁+DCS模型组大鼠在进行DCS建模前30 min腹腔注射给予芦丁(溶于DMSO)50 mg/kg,DCS模型组大鼠在进行DCS建模前30 min腹腔注射同等剂量的DMSO。
1.3 大鼠DCS模型构建大鼠DCS模型构建采用空气加压模拟潜水方式进行。将大鼠放置于小动物加压舱内,用高压空气在5 min内匀速加压至700 kPa,并在此压强下暴露100 min,暴露结束后以200 kPa/min速率快速减至常压。减压结束后10 min将大鼠置于电控转笼中进行跑步运动,转速为5 m/min,观察30 min内大鼠DCS发病情况,如出现呼吸急促、呼吸困难、前肢/后肢瘫痪、惊厥、死亡等症状中的任意一种则判定为发生了DCS。
1.4 脊髓和肺损伤病理学检测减压结束后2 h,大鼠经腹腔注射3%戊巴比妥钠(1.5 mL/kg)进行麻醉。固定大鼠后打开腹腔,剪断腹主动脉放血处死大鼠。取右肺下叶和T10~L4节段胸腰椎脊髓样本,使用吸水纸吸净表面血渍并浸泡于4%多聚甲醛溶液中固定。病理学检测由上海茹创生物科技有限公司完成。
1.5 脊髓组织炎症因子和氧化应激指标检测大鼠麻醉处死后,取T10~L4节段胸腰椎脊髓样本,采用ELISA方法检测脊髓组织中TNF-α、IL-1β、MDA含量,按照试剂盒说明书进行操作。
1.6 肺泡灌洗液蛋白质含量测定大鼠麻醉处死后,打开胸腔,结扎右肺,然后用预冷的1.5 mL生理盐水经气管进行肺泡灌洗3次。收集肺泡灌洗液,以1 800×g离心5 min,收集上清,利用BCA蛋白质定量检测试剂盒检测蛋白质含量。
1.7 肺湿/干比检测大鼠处死后取左肺,用滤纸吸干表面水分后精确称重(湿重);然后将肺组织置于60 ℃烘箱烘烤48 h至重量不再变化,再次称重(干重)。肺湿/干比=湿重/干重。
1.8 统计学处理采用SPSS 21.0软件进行统计学分析。计量资料以x±s表示,组间比较采用单因素方差分析,多重比较采用最小显著性差异法;计数资料以频数和百分率表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 芦丁对大鼠DCS发病率的影响空气模拟潜水后DCS模型组的34只大鼠中共有16只(47.06%)发生了DCS,其中2只(5.9%)死亡;芦丁+DCS模型组的34只大鼠中共有9只(26.47%)发生了DCS,至实验取材时均未死亡。芦丁+DCS模型组DCS的发病率和死亡率均低于DCS模型组,但差异均无统计学意义(P=0.078、P=0.493)。
2.2 芦丁对大鼠DCS发病起始时间的影响DCS模型组和芦丁+DCS模型组大鼠均在转笼运动后13 min内发生DCS。其中芦丁+DCS模型组DCS发病起始时间为(9.53±1.88)min,较DCS模型组的发病起始时间[(6.27±2.64)min]延迟,差异有统计学意义(P<0.05)。
2.3 芦丁对大鼠DCS脊髓损伤的保护效应3组大鼠脊髓组织病理学检测均未发现有明显的病理学改变(图 1)。与正常对照组相比,DCS模型组大鼠脊髓组织中TNF-α、IL-1β和MDA含量均升高,差异均有统计学意义(P均<0.05);与DCS模型组比较,芦丁+DCS模型组大鼠脊髓组织TNF-α、IL-1β和MDA含量均降低,差异均有统计学意义(P均<0.05,表 1)。
|
图 1 各组大鼠脊髓组织的病理变化 Fig 1 Pathological changes in spinal cord tissue of rats in each group A: Normal control group; B: DCS group; C: Rutin+DCS group. Hematoxylin-eosin staining. DCS: Decompression sickness. |
|
|
表 1 各组大鼠脊髓和肺组织相关指标的比较 Tab 1 Comparison of related indexes of spinal cord and lung tissues of rats in each group |
2.4 芦丁对DCS模型大鼠肺损伤的保护效应
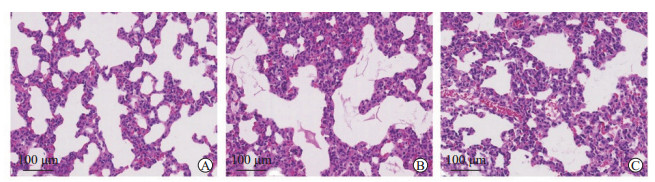
与正常对照组相比,DCS组大鼠肺泡间隔明显增宽、肺组织红细胞漏出明显增加、肺泡内渗出液明显增多,芦丁+DCS模型组上述病理改变明显减轻(图 2)。与正常对照组相比,DCS模型组大鼠肺泡灌洗液蛋白质含量和肺湿/干比均升高,差异有统计学意义(P均<0.05);与DCS模型组比较,大鼠肺泡灌洗液蛋白质含量和肺湿/干比均降低,差异均有统计学意义(P均<0.05)。见表 1。
|
图 2 各组大鼠肺组织的病理变化 Fig 2 Pathological changes of lung tissue of rats in each group A: Normal control group; B: DCS group; C: Rutin+DCS group. Hematoxylin-eosin staining. DCS: Decompression sickness. |
3 讨论
研究表明,减压过程中形成的气泡是DCS发生的根本原因[1]。气泡形成后一方面会阻塞血管引起远端组织缺血缺氧损伤,另一方面还会压迫周围组织导致组织机械性损伤,此外,气泡表面存在的电荷可以激活凝血酶和引起蛋白质变性等[5-6]。本研究针对DCS的炎症和氧化应激损伤机制,观察了具有抗炎和抗氧化作用的芦丁对DCS模型大鼠的保护作用。模型组大鼠DCS发病率为47.06%(16/34),芦丁处理后大鼠DCS的发病率降低至26.47%(9/34),但是两者差异无统计学意义(P=0.078)。
脊髓由于富含脂质,在高气压暴露过程中会溶解较多的惰性气体,从而导致减压过程中形成的气泡也相对较多[1, 7]。由于椎管是一个不可扩张的骨性管道,脊髓组织内气泡形成后不但会阻塞血管,同时还会引起脊髓组织张力增加,挤压周围脊髓组织,导致缺血缺氧损伤的发生[8-9]。据报道,DCS的发病率约为0.01%~0.03%,约20%~40%的病例存在神经系统症状,其中约77%的患者存在脊髓损伤,即使进行积极救治也有超过20%的患者有严重后遗症,给患者家庭及社会带来沉重负担[1, 10-11]。因此,DCS脊髓损伤的预防也成为DCS防治的重点工作之一。本研究结果表明,DCS模型组大鼠脊髓组织内炎症因子TNF-α和IL-1β及脂质氧化产物MDA含量均较正常对照组升高,而芦丁处理则能减轻这些指标的变化,表明芦丁可以减轻DCS大鼠脊髓组织炎症和氧化应激损伤。本研究在DCS模型大鼠脊髓病理切片上并未见到明显的气泡生成,这可能与所切取的脊髓组织内生成的气泡直径较小不易被观察、气泡内气体经扩散排出脊髓组织或病理检测过程中脂质溶解后脊髓组织本身出现微小腔隙导致无法辨别有关。
减压过程中形成的气泡主要存在于压强较低的静脉血管内,随着血流经右心系统进入肺部血管并最终在肺泡部位排出体外,所以肺也是DCS损伤的另一个重要部位[12-13]。DCS肺损伤主要表现为肺毛细血管壁破坏、肺水肿、肺出血及炎症细胞浸润等。本研究结果表明,与正常对照组相比,DCS模型组大鼠肺泡间隔明显增宽,肺组织红细胞漏出、肺泡内渗出液明显增多,肺湿/干比和肺泡灌洗液蛋白质含量升高,芦丁处理后上述变化均明显改善,说明芦丁对DCS大鼠肺损伤也有较好的保护效果。
综上所述,本研究发现提前给予芦丁可以减轻脊髓组织炎症和氧化应激损伤,改善肺组织病理变化,降低肺泡灌洗液蛋白质含量和肺湿/干比,提示芦丁可能是一种潜在预防DCS损伤的药物。
| [1] |
MITCHELL S J, BENNETT M H, MOON R E. Decompression sickness and arterial gas embolism[J]. N Engl J Med, 2022, 386: 1254-1264. DOI:10.1056/NEJMra2116554 |
| [2] |
MENG W T, QING L, LI C Z, ZHANG K, YI H J, ZHAO X P, et al. Ulinastatin: a potential alternative to glucocorticoid in the treatment of severe decompression sickness[J/OL]. Front Physiol, 2020, 11: 273. DOI: 10.3389/fphys.2020.00273.
|
| [3] |
ZHANG K, JIANG Z X, NING X W, YU X H, XU J J, BUZZACOTT P, et al. Endothelia-targeting protection by escin in decompression sickness rats[J/OL]. Sci Rep, 2017, 7: 41288. DOI: 10.1038/srep41288.
|
| [4] |
MUVHULAWA N, DLUDLA P V, ZIQUBU K, MTHEMBU S X H, MTHIYANE F, NKAMBULE B B, et al. Rutin ameliorates inflammation and improves metabolic function: a comprehensive analysis of scientific literature[J/OL]. Pharmacol Res, 2022, 178: 106163. DOI: 10.1016/j.phrs.2022.106163.
|
| [5] |
HILL L, MACLEOD J J. The influence of compressed air and oxygen on the gases of the blood[J]. J Physiol, 1903, 29: 382-387. DOI:10.1113/jphysiol.1903.sp000964 |
| [6] |
SCHIRATO S R, SILVA V, IADOCICCO K, MARONNI A, PIERI M, CIALONI D, et al. Post-decompression bubble and inflammation interactions: a non-extensive dynamical system model[J]. Undersea Hyperb Med, 2022, 49: 207-226. DOI:10.22462/03.04.2022.6 |
| [7] |
MANABE Y, SAKAI K, KASHIHARA K, SHOHMORI T. Presumed venous infarction in spinal decompression sickness[J]. AJNR Am J Neuroradiol, 1998, 19: 1578-1580. |
| [8] |
HALLENBECK J M, BOVE A A, ELLIOTT D H. Mechanisms underlying spinal cord damage in decompression sickness[J]. Neurology, 1975, 25: 308-316. DOI:10.1212/WNL.25.4.308 |
| [9] |
HILLS B A, JAMES P B. Spinal decompression sickness: mechanical studies and a model[J]. Undersea Biomed Res, 1982, 9: 185-201. |
| [10] |
MAHON R T, REGIS D P. Decompression and decompression sickness[J]. Compr Physiol, 2014, 4: 1157-1175. |
| [11] |
BLATTEAU J E, GEMPP E, SIMON O, COULANGE M, DELAFOSSE B, SOUDAY V, et al. Prognostic factors of spinal cord decompression sickness in recreational diving: retrospective and multicentric analysis of 279 cases[J]. Neurocrit Care, 2011, 15: 120-127. DOI:10.1007/s12028-010-9370-1 |
| [12] |
徐伟刚. 潜水医学[M]. 北京: 科学出版社, 2016: 100.
|
| [13] |
YU X H, XU J J, LIU W W, ZHANG Z, HE C Y, XU W G. Protective effects of pulmonary surfactant on decompression sickness in rats[J]. J Appl Physiol (1985), 2021, 130: 400-407. DOI:10.1152/japplphysiol.00807.2020 |
 2023, Vol. 44
2023, Vol. 44


