2. 上海交通大学医学院附属第一人民医院麻醉科, 上海 200080;
3. 海军军医大学(第二军医大学)卫生勤务学系军队卫生统计学教研室, 上海 200433;
4. 海军军医大学(第二军医大学)第三附属医院重症诊疗科, 上海 200438;
5. 海军军医大学(第二军医大学)第三附属医院肾内科, 上海 200438;
6. 海军军医大学(第二军医大学)第三附属医院特需诊疗科, 上海 200438
2. Department of Anesthesiology, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200080, China;
3. Department of Military Health Statistics, Faculty of Health Services, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
4. Department of Critical Care, The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200438, China;
5. Department of Nephrology, The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200438, China;
6. Department of VIP Medicine, The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200438, China
肝切除术仍是当前绝大多数肝脏肿瘤最常用和最有效的治疗手段。肝脏是人体内最大的消化器官,其位置较深,内部血管丰富、解剖结构复杂,因此在行肝切除术时容易出现肝断面大量出血,尤其在行大范围肝切除术(切除范围主要包括左半肝、右半肝、三叶切除及涉及更多肝叶的联合切除)及侵及第一、第二肝门等特殊位置肝脏肿瘤切除术时,手术操作较为困难、复杂,容易发生致命性大出血[1-2]。我国原发性肝癌患者多合并不同程度的肝硬化,许多严重肝硬化患者术中更易发生不可控制的致命性大出血。及时、有效地控制出血是决定肝切除术成功与否最为关键的因素之一。损伤控制性手术(damage control surgery,DCS)既往多应用于严重创伤患者的紧急救治,主张分阶段的治疗原则,采用快捷、简单的操作及时防止患者伤情的进一步恶化,提高治愈率并降低手术死亡率[3-5]。在复杂性肝切除术中,患者会出现不同程度的凝血功能障碍,肝脏创面广泛性渗血,从而影响有效缝合及对拢止血,此时采取纱布填塞压迫肝创面止血十分有效、安全,该方法能够减少进一步出血,成为挽救患者生命、降低手术死亡率的重要手段之一[6-10]。本研究回顾性分析了海军军医大学(第二军医大学)第三附属医院肝胆外科120例行复杂肝切除术且术中同期行止血纱布填塞患者的临床资料,探讨并总结止血纱布填塞治疗肝切除术中难以控制性大出血的经验与体会。
1 资料和方法 1.1 研究对象本研究为回顾性研究。选择2011年11月至2021年5月海军军医大学(第二军医大学)第三附属医院肝胆外科收治的行复杂肝切除术(大范围肝切除术及特殊位置肝脏肿瘤切除术)且术中同期行止血纱布填塞的患者120例。本组患者中,男87例、女33例;年龄10~81岁,平均(52.45±11.98)岁,中位年龄52岁。其中,肝恶性肿瘤(包含肝细胞癌、胆管细胞癌、腺癌、低分化癌等)97例,肝良性肿瘤(包含巨大海绵状血管瘤、平滑肌脂肪瘤、局灶性结节增生等)21例,肝内外胆管结石2例。
1.2 肝切除术中纱布填塞止血术中肝脏病灶切除后,肝创面经缝合止血,但仍出现难以控制的大量出血或广泛渗血,经术者综合评估后认为单纯依靠缝扎难以完全性确切止血,遂同期行纱布填塞压迫止血。首先尽可能吸尽肝创面积血、血块及腹腔内积血、积液,再针对较大的出血点或血管破损进行缝合止血修补,力争消除能够导致明显快速失血的血管破损。紧接着于肝创面处快速铺覆可吸收止血材料(明胶海绵等),再使用大盐纱铺盖其上进行压迫填塞。可用多块大盐纱交错堆叠,使整体填塞纱布对于肝创面的压迫强度足以起到肝创面止血效果。最后,于肝周低位处放置腹腔引流管(单腔管或双套管等),逐层缝合关闭腹腔,将填塞纱布一端经手术切口引出体外并根据填塞层次做好顺序标记,后期待患者病情平稳后由浅及深按序行一次或分次纱布拔除术。
1.3 观察指标(1)围手术期情况:包括术前一般资料、手术方式、肝门阻断方式及时间、术中出血量、术中输血量及术后病理类型。(2)肝功能:包括术前和术后第1天的血常规、肝功能、凝血功能。(3)术后并发症:包括出血、脏器功能衰竭等。(4)治疗结局:是否发生院内死亡。
1.4 统计学处理采用SAS 9.4和R 4.1.2软件进行统计学分析。服从正态分布和方差齐性的计量资料以x±s描述,两组间比较采用独立样本t检验;不服从正态分布或方差不齐的计量资料以中位数(下四分位数,上四分位数)描述,两组间比较采用秩和检验。计数资料以例数和百分数描述,两组间比较采用χ2检验或Fisher确切概率法。将单因素分析中P<0.2的因素纳入多因素logistic回归分析,采用后退法进行变量筛选,由于死亡例数少,变量剔除水准(α剔除)设为0.1。基于logistic回归分析结果建立院内死亡预测模型,并建立列线图,采用校准曲线、Hosmer-Lemeshow拟合优度检验、ROC曲线进行模型评价,并采用1 000次Bootstrap重抽样法进行内部验证。检验水准(α)为0.05。
2 结果 2.1 手术情况及院内死亡率120例行复杂肝切除术且术中同期行止血纱布填塞的患者术中行全肝入肝血流阻断0~7次,阻断时间为26.0(16.5,44.0)min,全组术中出血量为100~10 000 mL,纱布填塞止血成功率为91.67%(110/120)。根据术中出血及创面情况填入纱布1~5块,根据术后恢复情况于填塞术后3~9 d开始外拔纱布,一次或分次拔除,拔除纱布于病房内或在手术室内全身麻醉下进行。其中1例患者因肝癌肿瘤破裂出血于外院行经导管肝动脉栓塞术(transcatheter arterial embolization,TAE)及止血纱布填塞术后转入海军军医大学(第二军医大学)第三附属医院治疗,于TAE后21 d行右肝肿瘤及子灶切除术、胆囊切除术合并腹腔纱布拔除术,术后患者恢复顺利,行保肝等综合治疗2周后出院。
共有10例患者发生院内死亡,死亡率为8.33%,其中3例因术后继续出血于术后当日及术后2 d内死亡,1例因术后第4天行第1次止血纱布拔除后再出血、再次剖腹止血效果不佳于次日死亡,6例死于肝功能衰竭(合并多器官功能衰竭)。分析患者术后死亡时间点发现,术后持续性大量出血或拔除纱布后再出血相关性死亡多集中于术后1~3 d,而肝功能衰竭伴或不伴多器官功能衰竭相关性死亡则多集中于术后1~2周内。
2.2 院内死亡的影响因素分析将120例患者根据是否发生院内死亡分为未死亡组和死亡组,两组患者的基本情况和围手术期情况差异均无统计学意义(P均>0.05,表 1)。实验室检查结果(表 2)显示,术前两组患者的各项指标差异均无统计学意义(P均>0.05);术后第1天,死亡组患者的白蛋白、红细胞、血红蛋白、血小板、γ谷氨酰转肽酶低于未死亡组,肌酐、国际标准化比值(international normalized ratio,INR)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)高于未死亡组,差异均有统计学意义(P均<0.05)。
|
|
表 1 行复杂肝切除术且术中同期行止血纱布填塞患者的一般资料和围手术期情况 Tab 1 General information and perioperative situation of patients undergoing complicated hepatectomy with hemostatic gauze packing |
|
|
表 2 行复杂肝切除术且术中同期行止血纱布填塞患者的实验室检查结果 Tab 2 Laboratory test results of patients undergoing complicated hepatectomy with hemostatic gauze packing |
将单因素分析中P<0.2的因素纳入多因素logistic回归模型进行变量筛选,结果显示年龄、术后第1天PT、术后第1天APTT为患者院内死亡的独立影响因素,这3个变量数值升高可能增加患者院内死亡风险(年龄:OR=1.098,95% CI 0.995~1.210,P=0.062;术后第1天PT:OR=1.304,95% CI 0.971~1.753,P=0.078;术后第1天APTT:OR=1.061,95% CI 1.022~1.102,P=0.002)。
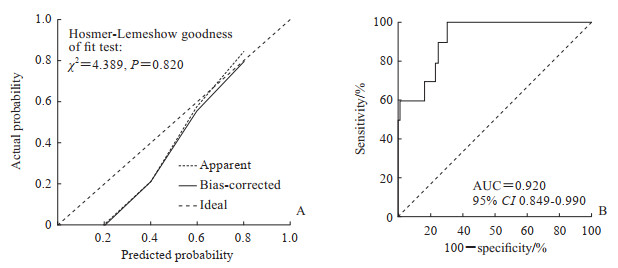
以年龄、术后第1天PT、术后第1天APTT作为自变量构建行复杂肝切除术且术中同期行止血纱布填塞患者的院内死亡风险预测模型,其一致性指数(C-index)为0.920,风险模型采用列线图进行展示(图 1)。Hosmer-Lemeshow拟合优度检验和校准曲线结果显示预测模型拟合尚可(P=0.820,图 2A),采用1 000次Bootstrap验证显示模型较为稳定,ROC曲线的AUC为0.900(95% CI 0.825~0.981)。利用列线图对每例患者计算评分后进行ROC曲线分析,结果显示AUC为0.920(95% CI 0.849~0.990),提示模型具有较好的预测效果(图 2B)。

|
图 1 行复杂肝切除术且术中同期行止血纱布填塞患者院内死亡预测列线图 Fig 1 Nomogram for the prediction model of in-hospital mortality of patients undergoing complicated hepatectomy with hemostatic gauze packing PT: Prothrombin time; APTT: Activated partial thromboplastin time. |
|
图 2 行复杂肝切除术且术中同期行止血纱布填塞患者院内死亡预测模型校准曲线和ROC曲线分析 Fig 2 Calibration plots and ROC curve for the prediction model of in-hospital mortality of patients undergoing complicated hepatectomy with hemostatic gauze packing A: Calibration plots with Bootstrap of 1 000 repetitions; B: ROC curve analysis. ROC: Receiver operating characteristic; AUC: Area under curve; CI: Confidence interval. |
3 讨论
DCS理念最早由美国医师在1983年提出,应用原则是尽量采用简单、快速并且创伤较小的应急手术处理方式快速控制不可控制性大出血等一系列致命性创伤,术后经过持续进一步支持治疗,维护患者生命体征稳定[11-12]。既往DCS多应用于严重肝外伤患者的急诊手术处理,随着肝胆肿瘤外科的发展逐渐用于肝切除术中不可控制性出血创面的处理[13-16]。我们的临床实际应用表明大多数患者都可取得较为满意的效果。
肝切除术中不可控制性出血的原因主要有:(1)肿瘤体积较大或位置刁钻,紧邻第一、第二肝门及下腔静脉等重要脉管结构,肝创面较大且经缝扎止血后仍出现广泛性渗血,继续行缝扎止血较为困难,抑或是勉强继续缝合易造成重要血管、胆管损伤;(2)手术后复发性肿瘤及术前肿瘤经过TAE、射频微波或靶向免疫等综合治疗,肝切除创面或肿瘤与周围组织粘连严重,彻底性缝扎止血困难;(3)肝硬化较重、肝功能差或术中大量失血、输血导致凝血功能异常,致肝切除创面出现广泛性出汗样渗血,术中通过缝合止血难以确切止血。
手术医师术前应当综合分析患者病情,提前做好相关术中处理预案,一旦面临以上术中情况,基于DCS理念果断应用止血纱布填塞技术进行肝切除创面及肝周填塞压迫止血。术中决断应当迅速、坚决,不宜犹豫或片面坚持追求完美的一期手术,同时需要同台的麻醉医师与手术护士密切配合。
通过本研究结果可以看出,针对肝切除术中不可控制性出血创面采用止血纱布填塞技术能够取得令人满意的手术成功率。我们认为在填塞纱布的操作过程中需要密切注意以下要点:(1)针对肝创面上较大、出血迅速的明显出血点,仍建议尽可能通过仔细缝扎进行止血;(2)在填塞纱布及肝创面之间建议铺覆一层可吸收止血材料(明胶海绵等),尽可能使肝创面与填塞纱布不直接接触,目的是降低后期行填塞纱布拔除时因创面血痂撕脱引起的再次出血,这类情况下部分患者需行再次手术止血或再次止血纱布填塞;(3)纱布填塞时要对创面施以一个合适的压力,使创面受力均匀且有效控制出血,防止压力过大导致肝组织缺血坏死、下腔静脉及肝静脉回流受阻或空腔脏器梗阻;(4)如填塞空间用多块纱布,需在引出体外的纱布一侧按照填塞顺序做好标记,利于后续由浅及深按序拔除纱布;(5)在低位及肝周放置1根或多根腹腔引流管(单腔管,双套管或SB引流管),可帮助判断术后是否有效止血及是否发生膈下积液、感染、胆漏等相关并发症;(6)因填塞纱布一端引出腹壁外,切口处可出现大量渗液,需每日多次换药,切口处可采用乙醇湿敷,降低逆行感染发生率;(7)填塞纱布可根据术后患者全身情况及引流情况综合判断拔除时机,一般初次拔除不超过术后1周,多于术后3~6 d行第1次填塞纱布拔除。过早拔除填塞纱布易导致止血不够充分而引发再次出血,另一方面也不建议填塞纱布留置时间过长,以免增加感染的发生。填塞纱布可一次全部拔除,也可按序间隔2~4 d由浅入深分次拔除。
体内凝血系统的平衡与肝脏功能之间存在密切的相关性,肝脏合成了大多数的凝血因子及纤溶系统的相关蛋白。本研究中行肝切除术且术中同期行止血纱布填塞的患者手术复杂,手术切除涉及多个肝叶的联合切除或是肿瘤位置刁钻特殊,肝脏游离及断肝过程中大量失血,加上液体复苏导致的凝血因子消耗稀释,最终引发严重全身凝血功能障碍。PT及APTT是外源性和内源性凝血系统较为灵敏和最常用的评价指标。本研究结果提示,行复杂肝切除术且术中同期行止血纱布填塞时,术后显著的凝血功能障碍异常与患者短期预后生存不佳密切相关,应当更加重视此类手术患者术后凝血功能的密切监测及早期干预治疗。
肝切除术中行止血纱布填塞患者多数手术创伤较大、术中失血较多,术后应该立即开展综合支持治疗,重点纠正体内酸碱平衡紊乱并保持患者血流动力学稳定,积极行抗感染、保肝及其他脏器支持等综合治疗方案。此外,应密切关注腹腔引流情况及生命体征变化,一旦患者病情加重可积极组织多学科联合会诊处理。
本研究入组患者未严格区分肝胆良恶性肿瘤病因。肝胆良恶性肿瘤手术治疗中的创面止血处理存在一些共性,同时也存在一些区别。在我国肝癌患者中相当大比例的患者有多年乙型肝炎病史,伴有不同程度的肝硬化及肝功能障碍。尽管肝创面出血多数情况下通过彻底结扎、缝扎肝创面的血管和/或褥式缝合肝创面可得到止血的效果,但是不乏经各种努力仍难以止血的情况。我们总结临床经验发现,当患者由于肝硬化、肝功能较差、凝血因子的合成不足和术中出血较多引起凝血功能下降,导致肝创面广泛渗血,如果一味坚持一边行常规缝扎止血一边输血的方式,结果往往功能更为恶化,陷入出血越多、输血越多、凝血功能更差的恶性循环之中。面对这种情况应当及时采用纱布填塞,力争快速控制出血。区别于肝脏恶性肿瘤,肝脏良性肿瘤往往生长时间较长、增长速度较慢。如肝海绵状血管瘤,一般认为当直径<5 cm时可定期观察,每间隔半年行超声检查随访[17-18]。肝血管瘤在渐进性生长过程中可与周围组织形成广泛的交通血管,这些交通血管与肝内外脉管重要结构(第一、第二肝门,下腔静脉,肝静脉及膈静脉等)之间往往失去正常的解剖走行。当手术中面临肝巨大海绵状血管瘤(直径>10 cm)或是一些特殊部位的血管瘤(如紧邻肝门区)时,不仅需要小心处理广泛的交通血管,还需密切注意异常的脉管解剖走行,手术切除的难度及危险性较大。尽管绝大多数肝脏良性肿瘤患者残肝组织正常且不合并肝硬化,但仍存在肝切除创面不可控制性出血、依靠单纯缝扎止血困难的情况。例如本组1例肝海绵状血管瘤患者既往有腹部手术史,肿瘤直径约30 cm,瘤体紧邻肝中、肝右静脉及下腔静脉,并与膈肌形成广泛粘连,肿瘤切除过程中出血量为5 000 mL,切除后膈肌及肝创面出现广泛性发汗样出血,术者果断采用止血纱布填塞,使出血情况得以控制,患者术后恢复良好。值得注意的是,无论是肝胆良性肿瘤或恶性肿瘤,当术中发现患者合并凝血机制异常时,还需要及时输注纤维蛋白原、凝血酶原复合物、冷沉淀、新鲜血浆、血小板等予以积极纠正。
本研究纳入了120例符合研究条件的患者信息,其中死亡患者仅为10例,表明止血纱布填塞技术的止血效果良好,但因死亡例数少也对相关影响因素的探索造成一定的影响。本研究发现年龄和2个术后凝血相关指标(PT和APTT)与院内死亡有关,符合临床实践观察到的结果。本研究所构建的院内死亡预测模型未来将进一步通过更多的病例收集进行完善。
综上所述,当行肝切除术中面对不可控制性出血创面的处理时应当牢记DCS理念,果断采用止血纱布填塞于肝创面及肝周。此技术操作简单,止血效果明显,不仅在既往严重肝外伤的急诊手术中发挥重要作用,同时通过临床实践证实在肝胆肿瘤行肝切除术中也是一种实用、有效的处理复杂性出血的关键止血技术。
| [1] |
洪益平. 严重肝损伤的手术方式分析[J]. 中华普通外科杂志, 2016, 31: 662-665. DOI:10.3760/cma.j.issn.1007-631X.2016.08.015 |
| [2] |
陈孝平, 裘法祖, 吴在德, 张志伟, 陈义发, 张必翔. 肝切除术中大出血的原因及防治[J]. 中华外科杂志, 2003, 41: 172-174. DOI:10.3760/j:issn:0529-5815.2003.03.005 |
| [3] |
ETIENNE J H, MASSALOU D. Damage control surgery: management of severe abdominal trauma (with video)[J]. J Visc Surg, 2019, 156: 64-66. DOI:10.1016/j.jviscsurg.2018.08.005 |
| [4] |
KANG B H, JUNG K, CHOI D, KWON J. Early re-laparotomy for patients with high-grade liver injury after damage-control surgery and perihepatic packing[J]. Surg Today, 2021, 51: 891-896. DOI:10.1007/s00595-020-02178-1 |
| [5] |
HALTMEIER T, FALKE M, QUAILE O, CANDINAS D, SCHNÜRIGER B. Damage-control surgery in patients with nontraumatic abdominal emergencies: a systematic review and meta-analysis[J]. J Trauma Acute Care Surg, 2022, 92: 1075-1085. DOI:10.1097/TA.0000000000003488 |
| [6] |
PATRONO D, ROMAGNOLI R, TANDOI F, MAROSO F, BERTOLOTTI G, BERCHIALLA P, et al. Peri-hepatic gauze packing for the control of haemorrhage during liver transplantation: a retrospective study[J]. Dig Liver Dis, 2016, 48: 414-422. DOI:10.1016/j.dld.2015.11.018 |
| [7] |
HAGIWARA M, IWATA Y, TAKAHASHI H, IMAI K, YOKOO H, ISHITOYA S, et al. Severe liver injury with traumatic cardiac arrest successfully treated by damage control surgery and transcatheter arterial embolization in the hybrid operating room: a case report[J/OL]. Surg Case Rep, 2021, 7: 234. DOI: 10.1186/s40792-021-01317-1.
|
| [8] |
SOMA J, ISHII D, MIYAGI H, ISHII S, MOTOKI K, KAWABATA H, et al. Damage control surgery for grade Ⅳ blunt hepatic injury with multiple organ damage in a child: a case report[J/OL]. Surg Case Rep, 2021, 7: 269. DOI: 10.1186/s40792-021-01348-8.
|
| [9] |
严以群, 杨甲梅, 徐峰, 郑梁, 吴建卫, 陈汉, 等. 肝肿瘤术中大出血纱布填塞止血成功17例报告[J]. 中国实用外科杂志, 1997, 17: 31-32. DOI:10.3321/j.issn:1005-2208.1997.01.022 |
| [10] |
杨甲梅, 严以群, 吴孟超, 陈汉, 温增庆, 徐峰, 等. 原发性肝癌行肝切除后肝脏创面的处理(附628例报告)[J]. 中国实用外科杂志, 1997, 17: 228-229. DOI:10.3321/j.issn:1005-2208.1997.04.018 |
| [11] |
ROBERTS D J, BOBROVITZ N, ZYGUN D A, KIRKPATRICK A W, BALL C G, FARIS P D, et al. Evidence for use of damage control surgery and damage control interventions in civilian trauma patients: a systematic review[J/OL]. World J Emerg Surg, 2021, 16: 10. DOI: 10.1186/s13017-021-00352-5.
|
| [12] |
GODAT L, KOBAYASHI L, COSTANTINI T, COIMBRA R. Abdominal damage control surgery and reconstruction: world society of emergency surgery position paper[J/OL]. World J Emerg Surg, 2013, 8: 53. DOI: 10.1186/1749-7922-8-53.
|
| [13] |
蒋扬, 方兴保. 损伤控制手术在肝胆外科疾病治疗中的应用效果分析[J]. 中外医疗, 2021, 40: 40-42. |
| [14] |
林洋. 控制性手术治疗肝胆外科损伤患者的疗效研究[J]. 中国医药指南, 2018, 16: 152-153. |
| [15] |
刘建, 李权, 王松, 何行昌. 重症肝胆外伤患者采用损伤控制性手术在肝胆外科治疗中的临床效果[J]. 医药论坛杂志, 2021, 42: 16-19. |
| [16] |
卢玉龙. 肝胆外科损伤控制性手术临床应用疗效研究[J]. 临床研究, 2019, 27: 39-41. |
| [17] |
贾昌俊, 戴朝六, 卜献民, 徐锋, 彭松林, 许永庆, 等. 复杂巨大肝血管瘤的手术治疗[J]. 中国普外基础与临床杂志, 2016, 23: 151-155. |
| [18] |
田开亮, 朱立新, 耿小平, 赵义军, 赵红川, 刘付宝. 肝切除术治疗肝血管瘤72例临床分析[J/CD]. 中华普通外科学文献(电子版), 2013, 7: 121-124.
|
 2023, Vol. 44
2023, Vol. 44


