根据目前普遍使用的WHO诊断标准,肌内血管瘤是骨与软组织肿瘤分类中的一种血管瘤类型,包括毛细血管型、海绵状血管型及混合型,可发生于身体任意部位的横纹肌。但大多数肌内血管瘤可能为血管畸形,而非真正的血管瘤[1-2]。由于血管瘤及血管畸形在临床处理、预后评估等方面存在差异,国际血管瘤和脉管畸形研究学会(International Society for the Study of Vascular Anomalies,ISSVA)标准将血管性病变进一步细分为血管瘤和血管畸形,并从多学科病因学角度将良性血管病变分为以血管增殖为特点的血管瘤和胚胎血管形成缺陷引起的血管畸形[3]。本研究收集新疆医科大学第一附属医院2013年10月至2021年5月间依据第5版WHO骨与软组织肿瘤诊断标准确诊的40例肌内血管瘤患者资料,将患者根据ISSVA标准重新进行分类,并从临床表现、病理形态和预后等方面对经ISSVA标准分类后的病例进行比较分析。
1 资料和方法 1.1 临床资料收集并整理新疆医科大学第一附属医院2013年10月至2021年5月间诊断为肌内血管瘤并行手术切除的40例病例资料。所有病例均有随访记录,诊断均经过软组织肿瘤专科病理医师确认。
1.2 诊断分类所有病例依据WHO骨与软组织肿瘤诊断标准[4]进行组织病理学复诊,同时按ISSVA标准[3]重新进行诊断分类。
1.3 病理特征分析手术切除标本均经4%甲醛水溶液固定,常规石蜡包埋,切片厚度4 μm,用光学显微镜观察。免疫组织化学染色采用EnVision二步法,人源葡萄糖转运蛋白1(glucose transporter 1,GLUT-1)抗体购于英国Abcam公司,CD31抗体、CD34抗体、D2-40抗体、二抗、DAB显色试剂盒均购于基因科技(上海)有限公司,稀释度及操作步骤按说明书进行。GLUT-1染色结果判读时,以鳞状上皮为阳性对照,着色部位为细胞膜。CD34、CD31、D2-40阳性结果为脉管内皮膜/质棕色着色。
2 结果 2.1 依据ISSVA诊断标准的分类结果共纳入依据WHO骨与软组织肿瘤标准诊断为肌内血管瘤的患者40例,男20例、女20例,年龄为4~70岁,中位年龄为24.5岁。根据ISSVA标准重新分类后,血管畸形36例,血管瘤4例。36例血管畸形患者中,22例为静脉畸形、1例为动静脉畸形、13例为混合型血管畸形,混合型血管畸形中包括12例静脉畸形与动静脉畸形混合及1例静脉畸形与淋巴管畸形混合。
2.2 血管畸形和血管瘤的临床特征及预后4例血管瘤患者年龄为33~70岁,男1例、女3例,病程1个月至28年,均发生于面部。36例血管畸形患者年龄为4~64岁,男19例、女17例,病程1 d至15年;19例发生于下肢,10例发生于上肢,4例发生于躯干,3例发生于面部。随访9个月至8年,4例血管瘤患者均未复发,36例血管畸形患者中有8例复发(复发率为22.2%)。
2.3 血管畸形和血管瘤的病理特征4例血管瘤患者的H-E染色结果均表现为毛细血管型肌内血管瘤形态(图 1A),血管增生呈小叶状分布,小叶间纤维组织增生;血管内皮肥胖,呈卵圆形、上皮样,部分管腔形成不明显,核分裂象为1/50高倍视野(图 1B);间质可见散在肥大细胞,未见明显淋巴细胞、浆细胞浸润。免疫组织化学染色显示,4例血管瘤患者血管内皮CD31、CD34均呈阳性表达,GLUT-1均呈阴性表达(图 1C)。
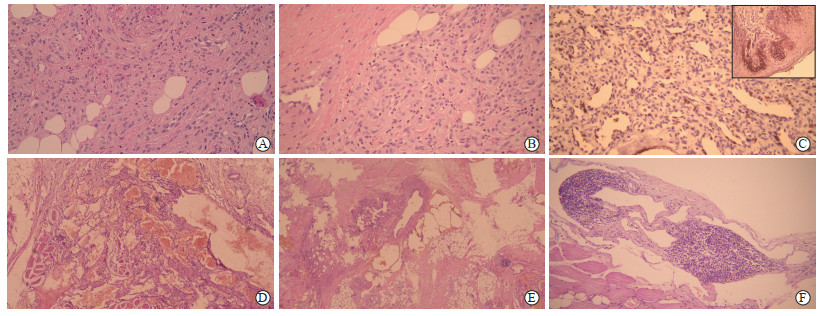
|
图 1 血管瘤和血管畸形的病理特征 A:血管瘤以血管增生为主要特点(苏木精-伊红染色,100×);B:血管瘤的血管内皮肥胖,呈上皮样,可见核分裂象(苏木精-伊红染色,400×);C:血管瘤的血管内皮细胞葡萄糖转运蛋白1阴性(免疫组织化学染色,200×),右上角小框为鳞状上皮及管腔内红细胞阳性对照(400×);D:静脉畸形(苏木精-伊红染色,100×);E:动静脉畸形(苏木精-伊红染色,100×);F:淋巴管畸形(苏木精-伊红染色,200×). |
36例血管畸形患者的免疫组织化学染色示CD31、CD34血管内皮均呈阳性表达,GLUT-1均呈阴性表达。H-E染色结果中,仅1例动静脉畸形患者未见静脉畸形,余35例均见簇状、扩张、薄壁静脉(图 1D),血管内皮细胞扁平,未见核分裂象,合并静脉血栓18例、静脉石6例。其中1例动静脉畸形和12例静脉畸形与动静脉畸形混合型血管畸形均可见壁厚薄不一的厚壁血管,间质纤维、平滑肌呈束状增生,排列杂乱、无规则(图 1E);1例淋巴管畸形由薄壁、扩张、不规则管腔组成,腔内可见淡嗜伊红淋巴液,管腔周围间簇状淋巴细胞聚集(图 1F),免疫组织化学染色示淋巴管内皮细胞膜质D2-40阳性。血管畸形中有6例间质可见簇状淋巴细胞、浆细胞浸润。聚类分析结果表明,根据ISSVA标准不同分类间镜下病理特征差异明显(图 2)。

|
图 2 40例患者ISSVA标准不同分类间镜下病理特征的聚类分析 ISSVA:国际血管瘤和脉管畸形研究学会. |
3 讨论
肌内血管瘤发病率在血管瘤中占比不足1%,是一种可以发生于任意部位横纹肌内的良性血管增生性病变,以下肢为最常见[5]。肌内血管瘤的典型临床表现为不伴有皮肤颜色改变的、不断扩大的软组织肿块,由于不能自行消退且可能对周围组织造成压力性损伤,故常伴局部持续性软组织疼痛[6]。1972年Allen和Enzinger[7]根据病理形态提出“肌内血管瘤”概念,并将其分为毛细血管型、海绵状型及混合型,后被WHO引用并广泛应用至今。统计数据显示,大多数肌内血管瘤可能为血管畸形,而非真正的血管瘤[8-9]。ISSVA依据多学科病因学将良性血管病变分为以血管增殖为特点的血管瘤及胚胎血管形成缺陷引起的血管畸形,2018年ISSVA分类更新中将肌内血管瘤列为暂时未分类血管病变[3, 10]。由于肌内血管瘤存在血管瘤和血管畸形特征,本研究根据ISSVA血管瘤和血管畸形的分类原则将新疆医科大学第一附属医院2013年10月至2021年5月40例肌内血管瘤分类为血管瘤4例及血管畸形36例,发现两类患者在临床表现、病理形态、预后方面均存在差异。
血管瘤可能随年龄增长而退化,而血管畸形会随年龄增长而增大且不可自行消退[11-12]。血管瘤分为婴儿血管瘤、先天性血管瘤、梭形细胞血管瘤、上皮样血管瘤、分叶状毛细血管瘤、簇状血管瘤等。胚胎发育第17天时共同毛细血管丛形成,进而分化出毛细血管、动脉、静脉和淋巴管[13],该过程出现错误会导致血管畸形。血管畸形包括毛细血管畸形、静脉畸形、淋巴管畸形、动静脉畸形及混合型畸形。本研究尝试根据ISSVA标准将肌内血管瘤分为以血管增殖为特点的血管瘤及以成熟管腔形成异常为特征的血管畸形,结果显示收集的40例肌内血管瘤患者重新分类后有4例为血管瘤,36例为血管畸形。其中血管瘤患者在病理上均呈毛细血管型肌内血管瘤形态,病变以血管增生为特点;血管畸形病例根据累及脉管系统类型分为毛细血管畸形、静脉畸形、动静脉畸形、淋巴管畸形及混合型,其中WHO分类中海绵状血管型血管瘤均可对应ISSVA标准中血管畸形,且静脉畸形最常见(22例),其次为动静脉混合型畸形(静脉畸形与动静脉畸形混合12例、动静脉畸形1例),淋巴管畸形最少(静脉畸形与淋巴管畸形混合1例)。
本研究中4例血管瘤均位于面部,H-E染色镜下形态均以无包膜血管增生为主要特征,血管呈分叶状增生,血管内皮细胞肥胖,偶见核分裂象,未见坏死、血栓,间质均可见散在肥大细胞。36例血管畸形中单纯静脉畸形22例,单纯性静动脉畸形1例,混合型血管畸形13例。混合型血管畸形中以静脉畸形与动静脉畸形混合畸形为主(12例),1例为静脉畸形与淋巴管畸形混合。静脉畸形在患者出生时即存在,尤其是位于深部横纹肌内者,故病变发现较晚,病灶可单灶、多灶,亦可累及整个肢体。22例单纯静脉畸形血管由薄壁、扩张静脉组成,血管内皮细胞扁平,未见核分裂象,18例可见混合性血栓,6例见静脉石,临床上可引起病灶区域疼痛、水肿等症状。1例动静脉畸形由厚壁动脉、静脉、毛细血管混合组成,厚壁动脉及静脉管腔扭曲、拉长,内弹力层破坏,管壁厚薄不一,间质不同程度纤维化并平滑肌束状增生。混合型血管畸形以动静脉畸形及静脉畸形混合为主,部分间质内可见淋巴细胞、浆细胞为主的炎症细胞浸润。淋巴管畸形可发生于全身任何位置,常发生在淋巴丰富的区域如头颈部、腋窝、口腔、腹股沟、纵隔等,根据扩张淋巴管管径不同分为微囊型、巨囊型及混合型。本研究中仅1例淋巴管畸形,可见扩张淋巴管结构,呈微囊型改变,扩张管腔周围淋巴细胞聚集,免疫组织化学染色示淋巴管内皮细胞D2-40阳性。此外,本研究发现仅血管瘤患者细胞间质见肥大细胞散在分布,而血管畸形病例中均未发现肥大细胞。由此可见,H-E染色病理形态在血管瘤和血管畸形的鉴别诊断中起着关键作用。聚类分析结果也表明,根据ISSVA标准不同分类间镜下病理特征差异明显。
免疫组织化学染色在区分血管瘤及血管畸形方面作用有限。GLUT-1是促进葡萄糖被动转运到细胞中的葡萄糖转运蛋白成员,是幼年型血管瘤的特异性指标,但在其他类型血管瘤中局灶表达或不表达[14]。CD34、CD31用于标记血管内皮,于血管瘤、血管畸形中均表达。本研究中4例血管瘤患者血管内皮CD31、CD34均呈阳性表达,GLUT-1呈阴性表达。36例血管畸形患者血管内皮细胞CD34及CD31均阳性表达,淋巴管内皮细胞表达D2-40,着色强度及着色模式均同血管畸形病例。
本组患者术后随访9个月至8年,4例血管瘤患者均未复发,36例血管畸形患者中8例原部位复发(复发率为22.2%)。相较血管瘤,血管畸形发病机制方面研究数据较少,针对病因的治疗措施有限。血管畸形多为散发性,源于体细胞突变。大部分血管畸形参与以下3条信号通路中的1种:(1)PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路;(2)MAPK通路;(3)G蛋白偶联受体信号通路[15-16]。对血管畸形的治疗方法包括手术切除、栓塞或硬化疗法,有研究主张不同类型血管畸形采用不同治疗方式[17]。β受体阻滞剂和类固醇对以血管内皮增生为特点的血管瘤有治疗作用[18]。近期研究发现蛋白水解酶(如高分子量基质金属蛋白酶)可能参与血管畸形中组织重建,针对碱性成纤维细胞生长因子、基质金属蛋白酶的靶向药物可能是此类血管畸形患者的潜在治疗药物[19]。
本研究尝试使用ISSVA分类方法对肌内血管瘤进行重新分类,回顾性分析了新疆医科大学第一附属医院既往8年内诊断的40例肌内血管瘤病例资料,结果显示4例血管瘤与36例血管畸形患者在发病部位、病理形态及临床预后方面均存在差异,因此建议在肌内血管瘤诊断时应用ISSVA标准进一步精细分类,为临床诊疗决策提供有价值的信息。本研究样本量小,今后仍需积累更多数据,进一步探讨ISSVA分类的临床意义。
| [1] |
KUMER L K S, KURIEN N M, VENUGOPAL K, NAIR P R, MONY V. Intramuscular hemangioma of the masseter muscle-a case report and review of literature[J]. Int J Surg Case Rep, 2016, 26: 209-216. DOI:10.1016/j.ijscr.2016.07.025 |
| [2] |
HEIN K D, MULLIKEN J B, KOZAKEWICH H P W, UPTON J, BURROWS P E. Venous malformations of skeletal muscle[J]. Plast Reconstr Surg, 2002, 110: 1625-1635. DOI:10.1097/00006534-200212000-00001 |
| [3] |
International Society for the Study of Vascular Anomalies. ISSVA classification for vascular anomalies[EB/OL]. [2022-01-04]. https://www.issva.org/UserFiles/file/ISSVA-Classification-2018.pdf.
|
| [4] |
WHO Classification of Tumours Editorial Board. WHO classification of tumours. Soft tissue and bone tumours[M]. 5th ed. Lyon: IARC Press, 2020: 145-146.
|
| [5] |
LESCURA C M, DE ANDRADE B A B, BEZERRA K T, AGOSTINI M, ANKHA M V A, DE CASTRO F, et al. Oral intramuscular hemangioma: report of three cases[J]. J Cutan Pathol, 2019, 46: 603-608. DOI:10.1111/cup.13482 |
| [6] |
MELMAN L, JOHNSON F E. Intramuscular cavernous hemangioma[J]. Am J Surg, 2008, 195: 816-817. DOI:10.1016/j.amjsurg.2007.08.064 |
| [7] |
ALLEN P W, ENZINGER F M. Hemangioma of skeletal muscle. An analysis of 89 cases[J]. Cancer, 1972, 29: 8-22. DOI:10.1002/1097-0142(197201)29:1<8::AID-CNCR2820290103>3.0.CO;2-A |
| [8] |
WASSEF M, BORSIK M, CERCEAU P, FAUCON B, LAURIAN C, LE CLERC N, et al. [Classification of vascular tumours and vascular malformations. Contribution of the ISSVA 2014/2018 classification][J]. Ann Pathol, 2021, 41: 58-70. DOI:10.1016/j.annpat.2020.11.004 |
| [9] |
YILMAZ S, KOZAKEWICH H P, ALOMARI A I, FISHMAN S J, MULLIKEN J B, CHAUDRY G. Intramuscular capillary-type hemangioma: radiologic-pathologic correlation[J]. Pediatr Radiol, 2014, 44: 558-565. DOI:10.1007/s00247-014-2876-5 |
| [10] |
STEELE L, ZBEIDY S, THOMSON J, FLOHR C. How is the term haemangioma used in the literature? An evaluation against the revised ISSVA classification[J]. Pediatr Dermatol, 2019, 36: 628-633. DOI:10.1111/pde.13885 |
| [11] |
SADICK M, MüLLER-WILLE R, WILDGRUBER M, WOHLGEMUTH W A. Vascular anomalies (Part Ⅰ): classification and diagnostics of vascular anomalies[J]. Rofo, 2018, 190: 825-835. DOI:10.1055/a-0620-8925 |
| [12] |
JOHNSON C M, NAVARRO O M. Clinical and sonographic features of pediatric soft-tissue vascular anomalies part 1: classification, sonographic approach and vascular tumors[J]. Pediatr Radiol, 2017, 47: 1184-1195. DOI:10.1007/s00247-017-3885-y |
| [13] |
COHEN M M Jr. Vascular update: morphogenesis, tumors, malformations, and molecular dimensions[J]. Am J Med Genet A, 2006, 140: 2013-2038. |
| [14] |
NORTH P E, WANER M, MIZERACKI A, MIHM M C Jr. GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas[J]. Hum Pathol, 2000, 31: 11-22. DOI:10.1016/S0046-8177(00)80192-6 |
| [15] |
HOEGER P H. Genes and phenotypes in vascular malformations[J]. Clin Exp Dermatol, 2021, 46: 495-502. DOI:10.1111/ced.14513 |
| [16] |
KUNIMOTO K, YAMAMOTO Y, JINNIN M. ISSVA classification of vascular anomalies and molecular biology[J/OL]. Int J Mol Sci, 2022, 23: 2358. DOI: 10.3390/ijms23042358.
|
| [17] |
JOHNSON A B, RICHTER G T. Surgical considerations in vascular malformations[J/OL]. Tech Vasc Interv Radiol, 2019, 22: 100635. DOI: 10.1016/j.tvir.2019.100635.
|
| [18] |
HASSANEIN A H, MULLIKEN J B, FISHMAN S J, GREENE A K. Evaluation of terminology for vascular anomalies in current literature[J]. Plast Reconstr Surg, 2011, 127: 347-351. DOI:10.1097/PRS.0b013e3181f95b83 |
| [19] |
MARLER J J, FISHMAN S J, KILROY S M, FANG J M, UPTON J, MULLIKEN J B, et al. Increased expression of urinary matrix metalloproteinases parallels the extent and activity of vascular anomalies[J]. Pediatrics, 2005, 116: 38-45. DOI:10.1542/peds.2004-1518 |
 2023, Vol. 44
2023, Vol. 44


