超声引导锁骨上阻滞能够在几乎直视下对神经进行定位和阻滞,并可实时观察局部麻醉药是否在目标神经周围均匀扩散、充分浸润,从而提高臂丛神经阻滞的安全性和有效性[1]。为提高神经阻滞效果,临床上有时会采用高浓度或大容量的局部麻醉药,这可能会增加发生不良反应的风险。罗哌卡因是一种常用的局部浸润麻醉药,一些研究探讨了罗哌卡因用于臂丛神经阻滞时的合适剂量,但因为评判标准、操作方法和穿刺途径各不相同,结论存在差异[2-4]。本研究拟探讨罗哌卡因用于超声引导锁骨上臂丛神经阻滞行前臂手术时的合理有效浓度,为后续临床应用提供依据。
1 资料和方法 1.1 研究对象选择2013年10-12月在上海交通大学附属第六人民医院行择期前臂手术的患者。纳入标准:(1)年龄18~64岁;(2)美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级为Ⅰ级或Ⅱ级;(3)能正确、清楚地表达前臂痛温觉;(4)手术部位为自肘部以下前臂、手掌、手指等。排除标准:(1)有局部麻醉药过敏史;(2)BMI>30 kg/m2;(3)上肢感觉或运动功能异常;(4)合并呼吸系统疾病、凝血功能障碍。本研究获得上海交通大学附属第六人民医院伦理委员会审批(2013-84),所有患者或其家属均已理解研究方案并签署知情同意书。
1.2 麻醉药注入方法患者入手术室后,常规开放外周静脉,持续监测基础生命体征,包括经皮动脉血氧饱和度(percutaneous arterial oxygen saturation,SpO2)、心电图、心率和无创血压等指标。患者取90°侧卧位(患侧在上),超声探头放于锁骨上中点,首先在超声图像上寻找圆形、有明显搏动的锁骨下动脉(探头加压形状无明显变化,或采用彩色多普勒超声证实),锁骨上臂丛神经位于此动脉的外浅层,为椭圆形或圆形的蜂巢状或筛子状的低回声区,其周围围绕高回声结缔组织。
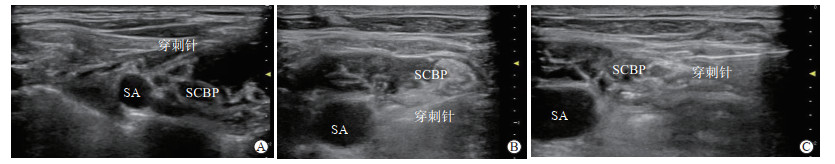
采用短轴平面内穿刺技术,用5 cm长的7 G针从探头外侧、距离探头侧面中点0.5 cm处穿刺,观察到穿刺针尖接近神经时给药。为了保证局部麻醉药溶液均匀扩散到锁骨上臂丛的每一部分,采用围绕神经分三点注射的方法:先将穿刺针推进到锁骨上臂丛神经的内侧注入局部麻醉药10 mL(图 1A);然后改变针尖方向,在锁骨上臂丛神经的上方注入局部麻醉药10 mL(图 1B);再次改变针尖方向,在锁骨上臂丛神经的外侧注入局部麻醉药10 mL(图 1C)。每次注药前都需要先回抽以免发生血管内注入。最后可在超声图像上观察到锁骨上臂丛神经被局部麻醉药完全包裹。为了避免神经内注射,先推入1 mL局部麻醉药,如果患者无异常疼痛或感觉异常主诉,或麻醉操作者自觉注射压力不高,再把余下的药物常规注入。
|
图 1 超声引导锁骨上臂丛三点注射法的超声图像 A:在锁骨上臂丛神经内侧注药;B:在锁骨上臂丛神经上方注药;C:在锁骨上臂丛神经外侧注药. SA:锁骨下动脉;SCBP:锁骨上臂丛. |
1.3 罗哌卡因浓度确定
本研究过程中始终由同一位麻醉医师完成超声引导锁骨上臂丛神经阻滞,局部麻醉药为罗哌卡因30 mL,起始浓度定为0.50%(根据我科以往经验,0.50%罗哌卡因可为单独施行臂丛神经阻滞的患者提供比较完全的阻滞),运用序贯法确定后续患者的用药浓度,浓度每级增减为0.05%。由另一位麻醉医师评价阻滞效果(该麻醉医师和所有受试患者均不知晓局部麻醉药的浓度),神经阻滞完成后10 min开始用针刺法测定前臂5根主要神经桡神经、正中神经、尺神经、前臂内侧皮神经、前臂外侧皮神经支配的绝对皮肤区域的阻滞效果。此5根神经支配的绝对皮肤区域分别为虎口区(桡神经)、示指和中指末节(正中神经)、小指末节(尺神经)、前臂外侧至腕部(前臂外侧皮神经)、前臂内侧至腕部(前臂内侧皮神经)的皮肤区域。嘱患者采用疼痛数字评估量表(numeric rating scale,NRS)对针刺区域进行评分,疼痛评分为0~10分,共11级,0分代表无痛,10分代表最大疼痛。之后每隔3 min用相同方法重复测定上述5根神经支配区域的感觉直至30 min,如任一神经支配区域NRS评分均为0~2分,则视为阻滞有效,下一病例罗哌卡因浓度降低一级;只要有一个神经支配区域NRS评分≥3分,即视为阻滞无效,随后此病例改为喉罩全身麻醉,而下一病例罗哌卡因浓度增加一级。
1.4 安全性评估(1)密切观察患者基础生命体征;(2)记录并发症的发生情况,包括霍纳综合征、局部麻醉药中毒、血管损伤、气胸和呼吸困难等。
1.5 样本量计算使用Dixon的up-down方法[5]无法事先确定样本量的大小。根据既往报道,当出现6个以上阻滞拐点(从成功阻滞到不成功阻滞或从不成功阻滞到成功阻滞均被认为是1个拐点)时,即可停止招募患者[6-7]。在使用Dixon的up-down方法[5]进行的麻醉试验模拟研究中,至少需要40例患者提供目标剂量的可靠估计。综上,本研究纳入64例患者。
1.6 统计学处理采用SPSS 21.0软件进行统计学分析。计数资料以例数和百分数表示,计量资料以x±s表示。采用logistic回归方法计算超声引导锁骨上臂丛神经阻滞中罗哌卡因的半数有效浓度(median effective concentration,EC50)及其95% CI。
2 结果 2.1 一般资料共64例患者纳入分析,男37例、女27例,年龄为(42.25±15.35)岁,身高为(165.75±8.41)cm,体重为(64.20±9.90)kg,BMI为(23.38±3.36)kg/m2,ASA分级Ⅰ级48例、Ⅱ级16例,手术部位位于手43例、前臂21例。
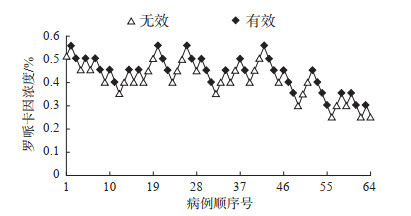
2.2 罗哌卡因浓度与麻醉效果的关系所有患者的基础生命指标在神经阻滞前后均维持在正常范围。在64例患者中,阻滞有效34例,无效30例。按照序贯法确定罗哌卡因浓度,64例患者的罗哌卡因浓度与麻醉效果如图 2所示。经logistic回归方法计算得到的罗哌卡因EC50为0.518%(95% CI 0.496%~0.547%)。
|
图 2 64例患者罗哌卡因浓度与麻醉效果分布情况 |
2.3 不良反应
64例患者中,发生霍纳综合征2例,无气胸、局部麻醉药中毒、血管损伤和呼吸困难等并发症发生。
3 讨论在选择局部麻醉药时,需考虑其阻滞维持时间、不良反应发生率、起效时间等因素。临床麻醉中为达到完美的神经阻滞镇痛效果,往往选择较高的局部麻醉药剂量,这可能会造成阻滞过深,也增加了发生不良反应的风险[8-9]。如何在保证麻醉效果的前提下降低局部麻醉药的使用剂量、提高麻醉安全性,成为麻醉医师关注的问题[10]。
有学者认为在阻滞效果相同的前提下,通过超声引导减少局部麻醉药的剂量行肌间沟和腋路神经阻滞是可行的[11-12]。但是,在超声引导下行锁骨上臂丛神经阻滞能否降低局部麻醉药容量存在争议[13-14]。Jeon等[15]将120例行超声引导锁骨上臂丛神经阻滞的患者随机分成4个容量组,观察阻滞成功率、阻滞起效时间和并发症,结果认为使用1%甲哌卡因的药物容量应为30 mL。Kant等[16]在超声引导锁骨上臂丛神经阻滞中使用0.5%布比卡因得出的95%有效容量(95% effective dose,ED95)为27 mL。综合以上结果,再根据我们以往的临床经验,本研究在选定容量30 mL的前提下,探讨罗哌卡因在锁骨上臂丛神经阻滞的EC50。
既往文献报道使用盲探法或神经刺激仪行锁骨上臂丛神经阻滞时,气胸发生率为1%~4%[17-19],这极大限制了锁骨上臂丛神经阻滞方法的推广。使用超声引导技术以后,锁骨上臂丛神经阻滞已具有重要的临床应用价值[20]。在锁骨上臂丛神经超声图像上可见到呈低回声的神经纤维被高回声的神经纤维外膜分成若干个腔室。注射局部麻醉药时,可在超声图像上观察到局部麻醉药的扩散受到这些神经纤维外膜的限制,提示其可能是引起锁骨上臂丛神经阻滞起效时间延长和阻滞不全的原因之一[21]。Gupta等[22]在研究BMI对锁骨上臂丛神经阻滞0.5%布比卡因半数有效容量(median effective dose,ED50)的影响中,考虑到神经纤维膜的分隔作用,采用了三点注射法进行神经阻滞。并非所有研究者都认同此方法,因为它需要多次调整穿刺针的角度,对麻醉医师的穿刺水平提出更高的要求,患者也会产生一定的不适。Soares等[23]提出单点注射法,Rodríguez等[24]则认为两点注射法为较好的选择。本研究采用三点注射法,通过超声图像证实采用此法注入的药物可充分地包裹锁骨上臂丛神经,经logistic回归方法计算得到的罗哌卡因EC50为0.518%(95% CI 0.496%~0.547%)。
唐毅等[25]研究表明,在神经刺激仪引导下罗哌卡因用于锁骨上臂丛神经阻滞的EC50为0.295%(95% CI 0.276%~0.316%),与本研究结果有较大差距。其原因可能有二:(1)评价标准不同。唐毅等[25]以视觉模拟量表评分≤4分为阻滞有效的标准,而本研究是以NRS评分0~2分为阻滞有效的标准。(2)唐毅等[25]的研究中使用芬太尼1 μg/kg静脉注射,而本研究没有使用任何镇痛镇静药物。Fang等[2]使用40 mL罗哌卡因、采用两点注射法得出的锁骨上臂丛神经阻滞的90%最低有效浓度(90% minimum effective concentration,MEC90)为0.257%。与之相比,本研究评估支配前臂和手的5根末梢神经绝对皮肤支配区域的镇痛效果且评估范围达到示指、中指和小指的末节,对前臂感觉阻滞的评价范围更广、更全面;此外Fang等[2]在研究中也提出相对较低的MEC90可能部分归因于全身性右美托咪定的使用。我们前期在超声引导下采用肌间沟法联合腋路法进行臂丛神经阻滞的研究中,测得的罗哌卡因EC50为0.436%[26],可能因为使用的穿刺途径不同,与本研究结果也有差距。在腋路位置,臂丛神经已形成具体的终末神经,超声图像上可以大致地分辨出肌皮神经、尺神经、正中神经和桡神经,注射少量的局部麻醉药就能产生阻滞效果;而在锁骨上位置,臂丛神经类似蜂窝状,不能分辨出具体神经。同时上文提到的神经纤维外膜的阻隔作用也是一个原因。Kessler等[27]研究提出在环状软骨水平以下膈神经阻滞的发生与局部麻醉药的体积有关,减少局部麻醉药的体积可以降低膈神经阻滞的发生率。由于本研究采用的是三点注射法,药物向各个方向分布比较均匀,向上扩散到肌间沟臂丛发生膈神经阻滞导致膈肌麻痹的容量有限,虽然并不排除亚临床半膈性瘫的发生,但由于对侧膈肌的代偿,在没有基础肺部疾病的患者中通常耐受性良好[28]。这可能是本组患者中无一例发生呼吸困难或氧饱和度下降的原因。
本研究严格限制了研究对象,排除了年龄<18岁的青少年和≥65岁的老年人,有呼吸系统疾患和BMI>30 kg/m2的人群也没有纳入。今后可以在这两方面细化,纳入相关人群开展进一步研究。
综上所述,本研究结果显示,在超声引导锁骨上臂丛神经阻滞时采用三点注射法,局部麻醉药容量为30 mL时,罗哌卡因最佳浓度为0.518%(95% CI 0.496%~0.547%)。此结果可为临床在超声引导锁骨上臂丛神经阻滞中选择合适的药物浓度提供依据。
| [1] |
PERLAS A, LOBO G, LO N, BRULL R, CHAN V W S, KARKHANIS R. Ultrasound-guided supraclavicular block[J]. Reg Anesth Pain Med, 2009, 34: 171-176. DOI:10.1097/AAP.0b013e31819a3f81 |
| [2] |
FANG G, WAN L, MEI W, YU H H, LUO A L. The minimum effective concentration (MEC90) of ropivacaine for ultrasound-guided supraclavicular brachial plexus block[J]. Anaesthesia, 2016, 71: 700-705. DOI:10.1111/anae.13445 |
| [3] |
PEI Q Q, YANG Y Q, LIU Q, PENG Z Y, FENG Z Y. Lack of sex difference in minimum local analgesic concentration of ropivacaine for ultrasound-guided supraclavicular brachial plexus block[J]. Med Sci Monit, 2015, 21: 3459-3466. DOI:10.12659/MSM.894570 |
| [4] |
ZHANG L G, PANG R F, ZHANG L. Effect of different volumes of 0.375% ropivacaine on diaphragmatic paralysis by supraclavicular brachial plexus block under ultrasound guidance[J]. Ann Palliat Med, 2020, 9: 3993-4001. DOI:10.21037/apm-20-1955 |
| [5] |
DAWES J, MYERS D, GÖRGES M, ZHOU G H, ANSERMINO J M, MONTGOMERY C J. Identifying a rapid bolus dose of dexmedetomidine (ED50) with acceptable hemodynamic outcomes in children[J]. Paediatr Anaesth, 2014, 24: 1260-1267. DOI:10.1111/pan.12468 |
| [6] |
LIU S Y, CAI C Y, NING J. Up-and-down designs for phaseⅠclinical trials[J]. Contemp Clin Trials, 2013, 36: 218-227. DOI:10.1016/j.cct.2013.07.002 |
| [7] |
PAUL M, FISHER D M. Are estimates of MAC reliable?[J]. Anesthesiology, 2001, 95: 1362-1370. DOI:10.1097/00000542-200112000-00014 |
| [8] |
SATSUMAE T, TANAKA M, SAITO S, INOMATA S. Convulsions after ropivacaine 300 mg for brachial plexus block[J]. Br J Anaesth, 2008, 101: 860-862. DOI:10.1093/bja/aen297 |
| [9] |
MÜLLER M, LITZ R J, HÜLER M, ALBRECHT D M. Grand mal convulsion and plasma concentrations after intravascular injection of ropivacaine for axillary brachial plexus blockade[J]. Br J Anaesth, 2001, 87: 784-787. DOI:10.1093/bja/87.5.784 |
| [10] |
LYONS G R, KOCAREV M G, WILSON R C, COLUMB M O. A comparison of minimum local anesthetic volumes and doses of epidural bupivacaine (0.125% w/v and 0.25% w/v) for analgesia in labor[J]. Anesth Analg, 2007, 104: 412-415. DOI:10.1213/01.ane.0000252458.20912.ef |
| [11] |
HARPER G K, STAFFORD M A, HILL D A. Minimum volume of local anaesthetic required to surround each of the constituent nerves of the axillary brachial plexus, using ultrasound guidance: a pilot study[J]. Br J Anaesth, 2010, 104: 633-636. DOI:10.1093/bja/aeq050 |
| [12] |
KURUBA S G, SINGH S K. Ultrasound reduces the minimum effective local anaesthetic volume[J]. Br J Anaesth, 2011, 106: 600-602. |
| [13] |
DUGGAN E, EL BEHEIRY H, PERLAS A, LUPU M, NUICA A, CHAN V W S, et al. Minimum effective volume of local anesthetic for ultrasound-guided supraclavicular brachial plexus block[J]. Reg Anesth Pain Med, 2009, 34: 215-218. DOI:10.1097/AAP.0b013e31819a9542 |
| [14] |
TRAN D Q H, DUGANI S, CORREA J A, DYACHENKO A, ALSENOSY N, FINLAYSON R J. Minimum effective volume of lidocaine for ultrasound-guided supraclavicular block[J]. Reg Anesth Pain Med, 2011, 36: 466-469. DOI:10.1097/AAP.0b013e3182289f59 |
| [15] |
JEON D G, KIM S K, KANG B J, KWON M A, SONG J G, JEON S M. Comparison of ultrasound-guided supraclavicular block according to the various volumes of local anesthetic[J]. Korean J Anesthesiol, 2013, 64: 494-499. DOI:10.4097/kjae.2013.64.6.494 |
| [16] |
KANT A, GUPTA PK, ZOHAR S, CHEVRET S, HOPKINS P M. Application of the continual reassessment method to dose-finding studies in regional anesthesia: an estimate of the ED95 dose for 0.5% bupivacaine for ultrasound-guided supraclavicular block[J]. Anesthesiology, 2013, 119: 29-35. DOI:10.1097/ALN.0b013e31829764cf |
| [17] |
LA GRANGE P, FOSTER P A, PRETORIUS L K. Application of the Doppler ultrasound bloodflow detector in supraclavicular brachial plexus block[J]. Br J Anaesth, 1978, 50: 965-967. DOI:10.1093/bja/50.9.965 |
| [18] |
BONICA J J, MOORE D C, ORLOV M. Brachial plexus block anesthesia[J]. Am J Surg, 1949, 78: 65-79. DOI:10.1016/0002-9610(49)90186-5 |
| [19] |
DE JONG R H. Axillary block of the brachial plexus[J]. Anesthesiology, 1961, 22: 215-225. DOI:10.1097/00000542-196103000-00010 |
| [20] |
CHAN V W S, PERLAS A, RAWSON R, ODUKOYA O. Ultrasound-guided supraclavicular brachial plexus block[J]. Anesth Analg, 2003, 97: 1514-1517. |
| [21] |
李挺, 吴道珠, 徐旭仲, 黄品同. 上肢手术病人超声引导锁骨上臂丛神经阻滞的效果[J]. 中华麻醉学杂志, 2006, 26: 126-129. |
| [22] |
GUPTA P K, PACE N L, HOPKINS P M. Effect of body mass index on the ED50 volume of bupivacaine 0.5% for supraclavicular brachial plexus block[J]. Br J Anaesth, 2010, 104: 490-495. DOI:10.1093/bja/aeq017 |
| [23] |
SOARES L G, BRULL R, LAI J, CHAN V W. Eight ball, corner pocket: the optimal needle position for ultrasound-guided supraclavicular block[J]. Reg Anesth Pain Med, 2007, 32: 94-95. |
| [24] |
RODRÍGUEZ J, BÁRCENA M, TABOADA-MUÑIZ M, LAGUNILLA J, ÁLVAREZ J. A comparison of single versus multiple injections on the extent of anesthesia with coracoid infraclavicular brachial plexus block[J]. Anesth Analg, 2004, 99: 1225-1230. DOI:10.1213/01.ANE.0000131724.73956.8E |
| [25] |
唐毅, 耿智隆, 汪惠文. 神经刺激仪引导下锁骨上臂丛神经阻滞罗哌卡因半数有效浓度的研究[J]. 西北国防医学杂志, 2010, 31: 111-113. DOI:10.16021/j.cnki.1007-8622.2010.02.018 |
| [26] |
顾晨桃, 王爱忠, 单宇, 江伟. 超声引导下罗哌卡因臂丛神经阻滞的半数有效浓度[J]. 中华麻醉学杂志, 2011, 31: 217-219. DOI:10.3760/cma.j.issn.0254-1416.2011.02.025 |
| [27] |
KESSLER J, SCHAFHALTER-ZOPPOTH I, GRAY A T. An ultrasound study of the phrenic nerve in the posterior cervical triangle: implications for the interscalene brachial plexus block[J]. Reg Anesth Pain Med, 2008, 33: 545-550. |
| [28] |
MAK P H K, IRWIN M G, OOI C G C, CHOW B F M. Incidence of diaphragmatic paralysis following supraclavicular brachial plexus block and its effect on pulmonary function[J]. Anaesthesia, 2001, 56: 352-356. DOI:10.1046/j.1365-2044.2001.01708-2.x |
 2023, Vol. 44
2023, Vol. 44


