2. 海军军医大学(第二军医大学)卫生勤务学系军队卫生统计学教研室, 上海 200433
2. Department of Military Health Statistics, Faculty of Medical Services, Naval Medical University (Second Military Medical University), Shanghai 200433, China
钠-葡萄糖共转运蛋白2(sodium-glucose co-transporter 2,SGLT2)抑制剂是一类相对较新的口服降糖药,相比其他口服降糖药,它在糖尿病重要共病如动脉粥样硬化性心血管疾病、心力衰竭及慢性肾脏病中发挥明显的保护作用。美国糖尿病学会《糖尿病诊疗标准(2021年版)》和《中国2型糖尿病防治指南(2020年版)》中均将SGLT2抑制剂推荐为优选的二联降糖药[1-2]。目前全球范围内已上市8种单药SGLT2抑制剂[3],其中美国FDA批准的有卡格列净(canagliflozin)、达格列净(dapagliflozin)、恩格列净(empagliflozin)和艾托格列净(ertugliflozin)。
SGLT2抑制剂通过选择性地抑制肾小管对葡萄糖的重吸收并增加尿糖的排出降低血糖水平。由于其独特的作用机制,服用SGLT2抑制剂可增加泌尿生殖系统感染的风险,这也是其最常见的不良事件[4]。已在说明书中列出的SGLT2抑制剂生殖系统不良反应有各种生殖器感染、阴道炎、宫颈炎、阴道瘙痒、前列腺炎、包皮龟头炎等,以及一种危及生命且极其罕见的会阴坏死性筋膜炎(Fournier坏疽)。尽管尚无确切的因果证据,但基于病例报告或数据库的药物安全性研究均显示Fournier坏疽的发生与SGLT2抑制剂存在关联[5-8],且FDA于2018年也发布了关于Fournier坏疽的黑盒警告。虽然既往研究已对SGLT2抑制剂相关的Fournier坏疽或生殖器感染进行了分析,但大多是以单个或部分生殖系统不良事件为目标事件,可能还存在未被发现的生殖系统不良事件,因此对SGLT2抑制剂的生殖系统不良事件进行全面的挖掘分析非常必要。本研究基于美国FDA不良事件报告系统(Food and Drug Administration Adverse Event Reporting System,FAERS),以整个生殖系统为目标集,利用数据挖掘方法来识别不同的SGLT2抑制剂(包括种类和用药方案)潜在的生殖风险,展示了更详细的患者特征、预后结果及事件发生时间(time to onset,TTO)信息,可以作为既往研究的数据补充,为临床合理用药提供参考。
1 材料和方法 1.1 数据来源与数据处理FAERS数据库是一个公开的自发报告系统,收集全球范围内的不良事件报告以支持FDA对药品和生物制品的上市后监测,可用于识别和量化药品与不良事件之间的潜在联系[9-10]。FAERS数据按季度更新,包含患者基线资料、出现的不良反应、用药情况、治疗开始和结束时间、药品适应证等信息。本研究在开始分析前,先对整个数据库进行去重处理,根据FDA的建议[11],当报告的CASEID相同时,保留最新的FDA_DT,当CASEID和FDA_DT均相同时,通过选择最新的PRIMARYID来删除重复的记录。从FAERS数据库中选取2013年第1季度(FDA首次批准SGLT2抑制剂)至2021年第2季度(可获取的最新数据)所有关于SGLT2抑制剂的报告。由于数据库中药品名称未标准化,使用SGLT2抑制剂所有的单药和联合用药的通用名和商品名在DRAGNAME和PROD_AI中检索。在提取所有关于SGLT2抑制剂的记录后,排除首选术语(preferred term,PT)、ROLE_COD字段缺失的记录,并删去目标药品作为“concomitant”(伴随)和“interacting”(交互作用)的报告,只保留SGLT2抑制剂为“primary suspect”(首要怀疑)和“second suspect”(次要怀疑)的药品记录。在本研究中,SGLT2抑制剂单药治疗定义为单独使用某一种SGLT2抑制剂,即某一特定的SGLT2抑制剂在DRUG文件的ROLE_COD字段中是“首要怀疑”,且在同一报告中没有其他药品作为“次要怀疑”“伴随”或“交互作用”的记录;联合治疗定义为同时使用SGLT2抑制剂和其他降糖药,即这一SGLT2抑制剂作为“首要怀疑”或“次要怀疑”,而同一报告中的另一个降糖药是其余作用角色的记录[12]。不良事件的TTO是字段EVENT_DT(不良事件发生日期)和START_DT(开始使用研究药品的日期)之间的时间间隔。此外,我们借助欧洲药品管理局制定的重要医疗事件(important medical event,IME)术语列表筛选出SGLT2抑制剂生殖系统中的IME。FDA未公开此类列表,但FAERS中的不良事件术语和IME术语列表均依据国际人用药品注册技术协调会的《国际医学用语词典》(Medical Dictionary for Regulatory Activities,MedDRA)24.0版按PT进行编码,因此使用此列表是可行的。本研究中的生殖系统不良事件是指MedDRA中系统器官分类(system organ class,SOC)为“reproductive system and breast disorders”包含的全部PT。严重的患者结局定义为死亡、危及生命、住院、残疾和先天畸形[9]。意外的信号是指在药品说明书中未提及的不良事件。
1.2 统计学处理研究涉及的数据处理和统计分析均使用SAS 9.4软件完成。使用不相称测定分析(disproportionality analysis)中常用的报告比值比法(reporting odds ratio,ROR)和信息成分法(information component,IC),并结合压缩估计方法,以减少事件发生频数很低时出现的虚假信号[13],压缩估计的不相称测定分析可以使信号检测结果更稳定且更易于发现危险信号[14-15],压缩估计参数通常取0.5。当ROR的95% CI下限(ROR025)>1且药品-不良反应的组合数≥3,或者IC的95% CI下限(IC025)>0时,认为该药品与特定不良反应存在关联,数值越大则关联强度越强。同时,将IC025≥4的信号定义为强信号[9, 16]。计量资料以中位数(下四分位数,上四分位数)表示,计数资料以频次和百分数表示。
2 结果 2.1 基线资料从2013年第1季度至2021年第2季度,FDA共收到11 822 884份报告,与SGLT2抑制剂相关的报告共57 818份,其中以SGLT2抑制剂为“首要怀疑”或“次要怀疑”的生殖系统相关不良事件记录共2 700条(“首要怀疑”2 642条、“次要怀疑”58条),占所有SGLT2抑制剂报告的4.67%。在SGLT2抑制剂的生殖系统不良事件中,男性占57.59%,高于女性(35.70%),而在其他药品相关的生殖系统不良事件中出现相反的情况。患者年龄为60(52,67)岁,分布集中在18~64岁;体重为94.0(80.0,112.5)kg。报告数随着年份呈双峰分布,在2015年和2019年到达峰值。推测原因可能是FDA在2015年发布了SGLT2抑制剂可能会导致糖尿病酮症酸中毒、骨密度降低等黑盒警告,并在2018年8月发布了警惕SGLT2抑制剂可能引起的Fournier坏疽的警告,这些警告和媒体宣传引起大家对此类药物的关注进而促使相关报告的增加。患者结局主要是住院(22.93%)和其他严重不良事件(28.63%),并且危及生命的事件比例(2.67%)远高于对照药品(0.74%)。详见表 1。
|
|
表 1 SGLT2抑制剂及其他药物的生殖系统不良事件基线情况 Tab 1 Baseline characteristics of reproductive adverse events for SGLT2 inhibitors and other drugs |
2.2 信号挖掘结果
如表 2所示,无论是从整体上,还是从单一疗法或联合用药上看,SGLT2抑制剂均与生殖系统不良事件存在关联。与联合用药相比,单一疗法的关联强度更大(IC025:1.40;ROR025:2.65)。恩格列净的报告频率最高且其信号值也最大(IC025:1.69;ROR025:3.25)。尽管艾托格列净的生殖不良事件仅有32例,但信号强度却高于卡格列净。类似的情形也出现在SGLT2抑制剂与二甲双胍、二肽基肽酶4(dipeptidyl peptidase 4,DPP-4)抑制剂联合用药的比较中。与其他药品联合使用,并没有加强SGLT2抑制剂的生殖毒性(IC025:-0.24;ROR025:0.86)。
|
|
表 2 不同SGLT2抑制剂治疗策略与生殖系统不良事件的关联 Tab 2 Association of reproductive adverse effects with different SGLT2 inhibitor strategies |
本研究分别对SGLT2抑制剂单药和联合用药进行具体生殖系统不良事件的信号挖掘,IC和ROR的信号检测结果基本一致。由表 3可见,在单药治疗中,共检测出56个阳性信号,出现8个强信号和13个IME。有35个生殖系统不良事件在说明书中没有被提及,其中10个属于IME。恩格列净涉及的不良事件最多,共有49个阳性信号,其中Fournier坏疽、龟头包皮炎、外阴阴道瘙痒、生殖器瘙痒为强信号,对应的IC025值分别为7.60、5.17、4.74、4.48。Fournier坏疽、生殖器真菌感染和龟头包皮炎是达格列净和卡格列净共有的强信号,前3种单药的共有IME是Fournier坏疽和男性外生殖器蜂窝织炎。此外,血尿的报告频率相对较高且与SGLT2抑制剂存在关联。
|
|
表 3 SGLT2抑制剂单药治疗中生殖系统不良事件的阳性信号 Tab 3 Significant signals of reproductive adverse effects for different SGLT2 inhibitor monotherapies |
由表 4可见,在所有联合用药中,Fournier坏疽均为阳性信号,且所有信号事件可在单药引起不良事件的列表(表 3)中找到。由表 5可见,不同SGLT2抑制剂与某些独特的生殖系统不良事件存在关联,如卡格列净与前列腺感染、恩格列净与阴茎癌、恩格列净和二甲双胍联用与女性乳腺癌等。
|
|
表 4 SGLT2抑制剂联合用药治疗中生殖系统不良事件的阳性信号 Tab 4 Significant signals of reproductive adverse effects for different SGLT2 inhibitor polytherapies |
|
|
表 5 SGLT2抑制剂单药和联合用药治疗中特有及意外的生殖系统不良事件信号 Tab 5 Unique and unexpected reproductive adverse effect signals in SGLT2 inhibitor monotherapy and polytherapy |
2.3 其他分析结果
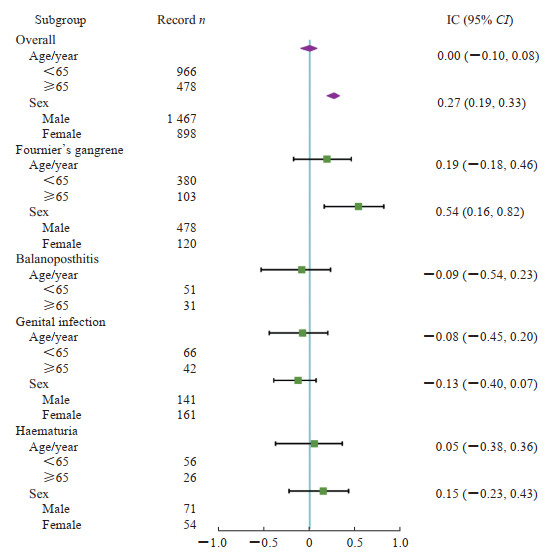
针对单一和联合疗法中报告频数较高且出现较强关联的生殖不良事件,包括Fournier坏疽、生殖器真菌感染、龟头包皮炎和外阴阴道真菌感染,我们进一步分析了每种SGLT2抑制剂出现这4种不良事件的TTO,见图 1。Fournier坏疽在单一疗法中的TTO约为250 d,在部分联合用药中发生Fournier坏疽的时间延长。SGLT2抑制剂单一疗法中共703例出现严重不良事件结局,表 6列出了单药治疗信号事件中出现严重结局的IME。Fournier坏疽在每种严重事件结局中均有分布,且有13例患者死亡。男性外生殖器蜂窝织炎、女性乳腺癌也被频繁报道且均为意外信号。此外,我们对报道频次排前4位的PT作亚组分析(图 2),整体上,接受SGLT2抑制剂治疗的男性患者出现生殖不良事件的风险更高(IC025:0.19)。Fournier坏疽更容易发生在成年男性中(IC025:0.16),患者发生其他特定不良事件的风险在年龄和性别亚组中并无差别。

|
图 1 不同SGLT2抑制剂中常见的4种生殖系统不良事件的TTO Fig 1 TTO for 4 common reproductive adverse events in different SGLT2 inhibitors A: Fournier's gangrene; B: Genital infection fungal; C: Balanoposthitis; D: Vulvovaginal mycotic infection. SGLT2: Sodium-glucose co-transporter 2; TTO: Time to onset; Cana: Canagliflozin; Empa: Empagliflozin; Dapa: Dapagliflozin; Ertu: Ertugliflozin; CM: Canagliflozin+metformin; EM: Empagliflozin+metformin; EL: Empagliflozin+linagliptin. |
|
|
表 6 SGLT2抑制剂单一疗法生殖系统不良事件信号中发生严重结局的IME Tab 6 IMEs with serious outcomes in SGLT2 inhibitor monotherapy of reproductive adverse effect signals |
|
图 2 SGLT2抑制剂常见生殖系统不良事件的年龄、性别亚组分析 Fig 2 Age and sex subgroup analysis of the common SGLT2 inhibitor-associated reproductive adverse events SGLT2: Sodium-glucose co-transporter 2; IC: Information component; CI: Confidence interval. |
3 讨论
SGLT2抑制剂作为2型糖尿病的一类口服治疗药,不仅有显著的降糖效果,且在心肾保护、体重控制、低血糖风险降低等多方面具有优势[3]。与其相关的药品安全问题也一直是研究热点。已有研究证明SGLT2抑制剂不良反应涉及感染、代谢、生殖、肾脏及泌尿系统[17-19]。此类药品发生生殖感染的风险大约是其他口服降糖药的3倍[20]。本研究着眼于SGLT2抑制剂的生殖毒性,使用大型药物警戒数据库FAERS中2013年第1季度至2021第2季度的数据,从单一疗法和联合疗法的角度全面挖掘了卡格列净、达格列净、恩格列净和艾托格列净4种SGLT2抑制剂潜在的生殖信号。同时,借助IME列表,筛选出SGLT2抑制剂相关的IME。本研究主要发现如下。
3.1 男性发生生殖系统不良事件的报告数量明显高于女性本研究发现男性的生殖系统不良事件占比远高于女性[57.59%(1 555/2 700)vs 35.70%(964/2 700)],而在其他药品中完全相反。亚组分析也证实了这一点。其他针对SGLT2抑制剂与生殖器感染的研究也发现了类似情况[4, 21]。本研究进一步分析发现,2型糖尿病成年男性更容易发生Fournier坏疽,在不同年龄患者中无明显差别。流行病学研究发现大多数Fournier坏疽病例出现在30~60岁男性人群中[22]。女性发生Fournier坏疽的频率较低,原因可能是女性阴道分泌物在会阴区可以更好地引流[23]。
3.2 SGLT2抑制剂的生殖毒性在不同疗法中的强度不同SGLT2抑制剂单药治疗与生殖系统不良事件的关联强度明显高于联合用药。目前尚无研究证明联合用药会降低其生殖毒性,但研究发现SGLT2抑制剂与DPP-4抑制剂联用时,由于两者的作用机制互补,不但提高了疗效而且没有造成额外的安全问题[24-25]。但与二甲双胍联用时,可能会增加患者代谢性酸中毒的风险[26]。本研究结果有助于为SGLT2抑制剂联合用药的安全性提供依据。在单一疗法中,恩格列净的信号检测结果最高,尽管大量研究证明其具有显著的心脏保护作用,但也有研究发现相比于其他单药,恩格列净及其联合用药与生殖器感染、Fournier坏疽的关联更强[8, 23]。
3.3 不同SGLT2抑制剂单药的生殖毒性谱不同本研究结果显示恩格列净的生殖系统毒性谱更广,其次是达格列净和卡格列净;并且同样的不良事件在不同SGLT2抑制剂中的关联强度和TTO也不同。Fournier坏疽是4种单药均出现的信号,但恩格列净的信号强度最大,艾托格列净最小。大部分联合用药治疗延长了Fournier坏疽的TTO。一项关于SGLT2抑制剂与Fournier坏疽的研究[23]结果与本研究一致。但恩格列净与二甲双胍联用时发生Fournier坏疽的TTO明显低于其他药品,考虑到在FAERS数据库中TTO存在大量缺失,本研究结果仅作为提示,还需要更多的临床证据。在本研究中,Fournier坏疽涉及各种严重结局,其中13例患者死亡。虽然糖尿病本身就是Fournier坏疽的危险因素之一,但这种危及生命的严重不良事件仍是罕见的。目前尚无临床试验证据证明SGLT2抑制剂与Fournier坏疽的因果关系,但已有病例报告和真实世界数据表明SGLT2抑制剂与Fournier坏疽存在关联。因此在实际使用中,若服用SGLT2抑制剂的患者出现疑似Fournier坏疽的症状,应立即停止使用此类药品并及时治疗。生殖器真菌感染和外阴阴道真菌感染也是4种单药共有不良事件,卡格列净表现出最高关联。与安慰剂相比,SGLT2抑制剂与生殖器真菌感染的发生率存在显著差异,并且女性外阴阴道真菌感染率较高[27]。这可能是由于尿糖排泄增加导致泌尿生殖道中真菌的繁殖。值得注意的是,男性外生殖器蜂窝织炎在SGLT2抑制剂说明书中被提及且属于IME,并造成17例患者住院治疗的结局。一项meta分析曾报道1例接受SGLT2抑制剂治疗的患者出现蜂窝织炎[28],但另一项基于FAERS的信号挖掘研究显示与SGLT2抑制剂相关的蜂窝织炎患者共524例[19]。这从一定程度上反映出真实世界数据对药物不良反应研究的重要性。不同的SGLT2抑制剂可能会引起独特的生殖IME,除前列腺脓肿、会阴脓肿外,恩格列净相关的阴茎癌与女性乳腺癌也出现阳性信号。基于临床试验的meta分析结果显示SGLT2抑制剂可能会增加膀胱癌的风险,特别是恩格列净[29]。也有研究发现服用达格列净的患者膀胱癌和乳腺癌的发病率高于对照组[30]。虽然癌症类型与本研究结果不同,但SGLT2抑制剂与癌症相关性的评价值得关注,今后需要更多长期的纵向数据加以验证。
本研究也存在一定的局限性。首先,FAERS数据库存在固有缺陷,如大量漏报、少报情况且缺少患者既往病史、诊疗信息等,无法分析其对报告中不良事件的影响程度;第二,虽然不相称测定分析已在药物警戒领域中大量使用,但该方法没有判断结果的金标准,测定结果只能说明目标药物与事件的关联性,无法证实其因果关系;第三,本研究未对其他口服降糖药进行数据挖掘、对比分析,只参考了同样使用FAERS数据库的相关文献。
随着SGLT2抑制剂在2型糖尿病领域的广泛使用,其相关不良事件的报道越来越多,充分探究其相关的不良事件可为今后的安全用药提供保障。本研究全面分析了SGLT2抑制剂潜在的生殖风险,发现不同SGLT2抑制剂疗法和种类引起的生殖事件类型、程度存在差异。除了已知的生殖系统不良事件外,本研究还发现了乳腺癌、阴茎癌、男性外生殖器蜂窝织炎等意外信号。但这些意外信号仍需更多的药物流行病学研究加以验证。临床医师在开具处方前应充分了解不同SGLT2抑制剂的生殖系统不良事件特异性,尽可能规避不良事件的发生。
| [1] |
American Diabetes Association. 9. Pharmacologic approaches to glycemic treatment: standards of medical care in diabetes-2021[J]. Diabetes Care, 2021, 44(Suppl 1): S111-S124. |
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志, 2021, 41: 482-548. |
| [3] |
KUCHAY M S, FAROOQUI K J, MISHRA S K, MITHAL A. Glucose lowering efficacy and pleiotropic effects of sodium-glucose cotransporter 2 inhibitors[J]. Adv Exp Med Biol, 2021, 1307: 213-230. |
| [4] |
FADINI G P, SARANGDHAR M, DE PONTI F, AVOGARO A, RASCHI E. Pharmacovigilance assessment of the association between Fournier's gangrene and other severe genital adverse events with SGLT-2 inhibitors[J/OL]. BMJ Open Diabetes Res Care, 2019, 7: e000725. DOI: 10.1136/bmjdrc-2019-000725.
|
| [5] |
ZHANG N, YU X, ZHANG K, LIU T J. A retrospective case series of Fournier's gangrene: necrotizing fasciitis in perineum and perianal region[J/OL]. BMC Surg, 2020, 20: 259. DOI: 10.1186/s12893-020-00916-3.
|
| [6] |
INSUA-PEREIRA I, FERREIRA P C, TEIXEIRA S, BARREIRO D, SILVA Á. Fournier's gangrene: a review of reconstructive options[J]. Cent European J Urol, 2020, 73: 74-79. |
| [7] |
BERSOFF-MATCHA S J, CHAMBERLAIN C, CAO C, KORTEPETER C, CHONG W H. Fournier gangrene associated with sodium-glucose cotransporter-2 inhibitors: a review of spontaneous postmarketing cases[J]. Ann Intern Med, 2019, 170: 764-769. DOI:10.7326/M19-0085 |
| [8] |
商永光, 张镭, 郭冬杰, 邵宏. 钠-葡萄糖共转运蛋白2抑制剂与生殖器感染不良事件: 基于真实世界的上市后监测数据分析[J]. 中国医院药学杂志, 2020, 40: 1739-1743. |
| [9] |
ZHAI Y H, YE X F, HU F Y, XU J F, GUO X J, ZHUANG Y L, et al. Endocrine toxicity of immune checkpoint inhibitors: a real-world study leveraging US Food and Drug Administration adverse events reporting system[J/OL]. J Immunother Cancer, 2019, 7: 286. DOI: 10.1186/s40425-019-0754-2.
|
| [10] |
PENG L, XIAO K, OTTAVIANI S, STEBBING J, WANG Y J. A real-world disproportionality analysis of FDA Adverse Event Reporting System (FAERS) events for baricitinib[J]. Expert Opin Drug Saf, 2020, 19: 1505-1511. DOI:10.1080/14740338.2020.1799975 |
| [11] |
WONG C K, HO S S, SAINI B, HIBBS D E, FOIS R A. Standardisation of the FAERS database: a systematic approach to manually recoding drug name variants[J]. Pharmacoepidemiol Drug Saf, 2015, 24: 731-737. DOI:10.1002/pds.3805 |
| [12] |
FAN Q, HU Y, YANG C, ZHAO B. Myocarditis following the use of different immune checkpoint inhibitor regimens: a real-world analysis of post-marketing surveillance data[J/OL]. Int Immunopharmacol, 2019, 76: 105866. DOI: 10.1016/j.intimp.2019.105866.
|
| [13] |
VAN PUIJENBROEK E P, BATE A, LEUFKENS H G M, LINDQUIST M, ORRE R, EGBERTS A C G. A comparison of measures of disproportionality for signal detection in spontaneous reporting systems for adverse drug reactions[J]. Pharmacoepidemiol Drug Saf, 2002, 11: 3-10. DOI:10.1002/pds.668 |
| [14] |
汪晶. 我国药品不良反应自发呈报系统信号检测中压缩估计参数的探索[D]. 上海: 第二军医大学, 2015.
|
| [15] |
史文涛, 叶小飞, 张天一, 郭晓晶, 汪晶, 朱田田, 等. 不相称测定分析中存在的问题及分析策略[J]. 药物流行病学杂志, 2014, 23: 437-440. |
| [16] |
史文涛, 侯永芳, 叶小飞, 朱田田, 张天一, 吴桂芝, 等. 我国药品不良反应自发呈报系统中信号强度分级阈值的探索[J]. 药物流行病学杂志, 2015, 24: 466-469. |
| [17] |
RASCHI E, PARISOTTO M, FORCESI E, LA PLACA M, MARCHESINI G, DE PONTI F, et al. Adverse events with sodium-glucose co-transporter-2 inhibitors: a global analysis of international spontaneous reporting systems[J]. Nutr Metab Cardiovasc Dis, 2017, 27: 1098-1107. DOI:10.1016/j.numecd.2017.10.008 |
| [18] |
SCHEEN A J. An update on the safety of SGLT2 inhibitors[J]. Expert Opin Drug Saf, 2019, 18: 295-311. DOI:10.1080/14740338.2019.1602116 |
| [19] |
郑淑芬, 钟诗龙. SGLT2抑制剂不良反应信号的挖掘与评价[J]. 中国药房, 2021, 32: 986-990. |
| [20] |
DAVE C V, SCHNEEWEISS S, PATORNO E. Comparative risk of genital infections associated with sodium-glucose co-transporter-2 inhibitors[J]. Diabetes Obes Metab, 2019, 21: 434-438. |
| [21] |
WANG T T, PATEL S M, HICKMAN A, LIU X Y, JONES P L, GANTZ I, et al. SGLT2 inhibitors and the risk of hospitalization for fournier's gangrene: a nested case-control study[J]. Diabetes Ther, 2020, 11: 711-723. |
| [22] |
SORENSEN M D, KRIEGER J N. Fournier's gangrene: epidemiology and outcomes in the general US population[J]. Urol Int, 2016, 97: 249-259. |
| [23] |
HU Y, BAI Z Y, TANG Y, LIU R J, ZHAO B, GONG J, et al. Fournier gangrene associated with sodium-glucose cotransporter-2 inhibitors: a pharmacovigilance study with data from the U.S. FDA adverse event reporting system[J/OL]. J Diabetes Res, 2020, 2020: 3695101. DOI: 10.1155/2020/3695101.
|
| [24] |
LI D D, SHI W L, WANG T S, TANG H L. SGLT2 inhibitor plus DPP-4 inhibitor as combination therapy for type 2 diabetes: a systematic review and meta-analysis[J]. Diabetes Obes Metab, 2018, 20: 1972-1976. |
| [25] |
MOLINA-VEGA M, MUÑOZ-GARACH A, FERNÁNDEZ-GARCÍA J C, TINAHONES F J. The safety of DPP-4 inhibitor and SGLT2 inhibitor combination therapies[J]. Expert Opin Drug Saf, 2018, 17: 815-824. |
| [26] |
DONNAN K, SEGAR L. SGLT2 inhibitors and metformin: dual antihyperglycemic therapy and the risk of metabolic acidosis in type 2 diabetes[J]. Eur J Pharmacol, 2019, 846: 23-29. |
| [27] |
PUCKRIN R, SALTIEL M P, REYNIER P, AZOULAY L, YU O H Y, FILION K B. SGLT-2 inhibitors and the risk of infections: a systematic review and meta-analysis of randomized controlled trials[J]. Acta Diabetol, 2018, 55: 503-514. |
| [28] |
CHEWCHARAT A, PRASITLUMKUM N, THONGPRAYOON C, BATHINI T, MEDAURA J, VALLABHAJOSYULA S, et al. Efficacy and safety of SGLT-2 inhibitors for treatment of diabetes mellitus among kidney transplant patients: a systematic review and meta-analysis[J/OL]. Med Sci (Basel), 2020, 8: 47. DOI: 10.3390/medsci8040047.
|
| [29] |
TANG H L, DAI Q, SHI W L, ZHAI S D, SONG Y Q, HAN J L. SGLT2 inhibitors and risk of cancer in type 2 diabetes: a systematic review and meta-analysis of randomised controlled trials[J]. Diabetologia, 2017, 60: 1862-1872. |
| [30] |
TENTOLOURIS A, VLACHAKIS P, TZERAVINI E, ELEFTHERIADOU I, TENTOLOURIS N. SGLT2 inhibitors: a review of their antidiabetic and cardioprotective effects[J/OL]. Int J Environ Res Public Health, 2019, 16: 2965. DOI: 10.3390/ijerph16162965.
|
 2023, Vol. 44
2023, Vol. 44


