2. 甘肃中医药大学, 兰州 730000
2. University of Traditional Chinese Medicine, Lanzhou 730000, Gansu, China
糖尿病是一种临床常见内分泌系统疾病,具有慢性进展的特点。流行病学资料显示,2型糖尿病患者的发病率和致残、致死率增加,严重威胁患者生命安全[1]。对糖尿病大血管病变患者,高糖会促进动脉斑块形成、增加血管闭塞。相关研究证实,动脉硬化是糖尿病合并血管病变患者最常见的病理特征,患者体内高糖会加重机体氧化应激,增加炎症反应,损伤内皮功能,加快疾病的发展[2]。
组蛋白乙酰转移酶(histone acetyltransferase,HAT)/组蛋白脱乙酰酶(histone deacetylase,HDAC)平衡是众多疾病调节的靶点之一。HAT/ HDAC通过参与基因结构修饰调控基因的表达[3]。研究证实,HAT/HDAC与血管病变存在关联,高糖会加快平滑肌细胞活性增殖而诱导动脉斑块形成,在此期间HAT过度激活能够抑制过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的表达,而HDAC激动剂干预使PPARγ表达升高,提示PPARγ高表达可能是干预动脉粥样硬化(atherosclerosis,AS)的中心环节[3]。PI3K/Akt通路是机体的重要信号通路,在细胞存活、蛋白质合成、代谢、运动及血管生成等多种生理功能中发挥重要作用。PI3K/Akt通路能够调控AS炎症反应、内皮细胞活性等多个生物过程,而PPARγ激动剂可诱导Akt磷酸化并抑制上述生物过程,推测通过调节HAT/HDAC平衡调控PPARγ/PI3K/Akt通路活化可能是干预AS发病的机制之一[4-5]。黄连化浊胶囊是甘肃中医药大学附属医院院内制剂,主要活性成分为小檗碱,具有改善糖尿病患者胰岛素抵抗、调节血脂代谢的作用[6]。本研究基于HAT/HDAC平衡调控PPARγ/PI3K/Akt通路活化,探讨黄连化浊胶囊对糖尿病大血管病变的作用。
1 材料和方法 1.1 实验动物6~8周龄载脂蛋白(apolipoprotein E,ApoE)基因剔除小鼠40只,品系名称为C57BL/6J-KO(ApoE),雌雄各半,体重(20±3)g;10只野生型C57小鼠,体重(22±2)g。所有小鼠均购自斯贝福(北京)生物技术有限公司[动物生产许可证号:SCXK(京)2019-0010],于封闭、无菌环境下隔离饲养。
1.2 药物、试剂与仪器黄连化浊胶囊(黄连9 g,鸡内金12 g,法半夏9 g,竹茹15 g,枳实9 g,陈皮9 g,茯苓15 g,炙甘草9 g)为甘肃中医药大学附属医院院内制剂(批准文号:甘药制字Z120110)。阿托伐他汀购自美国辉瑞公司(批号:20130841);FBS购自美国Mediatech公司;人氧化低密度脂蛋白(human oxidized low density lipoprotein,ox-LDL)购自上海雅吉生物科技有限公司;HAT抗体、HDAC1抗体购自安诺伦(北京)生物科技有限公司;PPARγ抗体、PI3K抗体及Akt抗体均购自英国Abcam公司;H-E染色试剂盒购自海德创业(北京)生物科技有限公司;CytoFLEX流式细胞仪购自美国Beckman Coulter公司;台式高速离心机购自长沙东旺实验仪器有限公司;转轮式石蜡切片机购自郑州博邦科贸有限公司;蛋白电泳系统购自北京柏莱斯特科技发展有限公司;COBAS C501全自动生化分析仪购自瑞士Roche公司。
1.3 糖尿病大血管病变小鼠模型的构建所有ApoE基因剔除小鼠均适应性饲养7 d后以高脂、高糖饲料[7]喂养4周,抽取尾静脉血检测血糖,空腹血糖>16.7 mmol/L表示2型糖尿病小鼠建模成功。之后继续以高脂、高糖饲料喂养并于饮水中加入0.1 g/L一氧化氮合酶抑制剂N-硝基-L-精氨酸甲酯盐酸盐(N-nitro-L-arginine methyl ester hydrochloride,L-NAME),连续4周,建立糖尿病大血管病变动物模型。10只野生型C57小鼠以普通饲料喂养。
1.4 动物分组与药物干预10只野生型C57小鼠为空白组;ApoE基因剔除小鼠随机分为模型组、阿托伐他汀组、黄连化浊胶囊组、阿托伐他汀+黄连化浊胶囊组,每组10只。阿托伐他汀组小鼠用阿托伐他汀10 mg/kg(溶于0.3%羧甲基纤维素溶液)灌胃,每天1次,连续8周。黄连化浊胶囊组小鼠灌胃0.675 g/kg黄连化浊胶囊水溶液(将1个2 g的胶囊加水50 mL配制成40 g/L水溶液,采用常规方法利用天平及量筒检测溶液密度,密度为1 g/mL),每天1次,连续8周。阿托伐他汀+黄连化浊胶囊组小鼠同时按阿托伐他汀组和黄连化浊胶囊组小鼠的给药方案处理。空白组和模型组小鼠灌胃等体积生理盐水。黄连化浊胶囊组小鼠实验结束后取血清,即为黄连化浊胶囊含药血清。
1.5 血糖和血脂水平检测末次灌胃后,每只小鼠眼眶取静脉血1.5 mL,采用全自动生化分析仪检测餐后血糖(postprandial blood glucose,PBG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)及低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)含量。
1.6 H-E染色麻醉后颈部脱臼处死小鼠,分离胸主动脉,吸干水分后用4%甲醛溶液固定24 h,80%(体积分数)乙醇脱水,5 μm厚度切片,脱蜡10 min后用95%(体积分数)乙醇水化。采用碱性苏木精染液染15 min,PBS冲洗3次,蒸馏水清洗。再用伊红染液染3 min,PBS透明处理后封片。在光学显微镜下观察小鼠胸主动脉病理形态。
1.7 细胞培养及分组分离小鼠胸主动脉,去除血管内膜及外膜,制成2 mm3大小组织块,研磨后加入裂解液裂解,0.25%胰蛋白酶消化后过80目筛,收集平滑肌细胞,用高糖培养基(含100 U/mL青霉素及100 μg/mL链霉素)培养,常规条件下培养至80%~90%细胞融合时进行实验。将细胞分为空白组、ox-LDL组、ox-LDL+PPARγ沉默组、ox-LDL+PPARγ过表达组,除空白组外,另3组细胞均加入100 μg/mL ox-LDL共培养。PPARγ质粒转染方法参考文献[8],PPARγ siRNA转染方法参考文献[9]。
1.8 细胞干预方法除空白组外,其余3组细胞均加入200 μg/mL黄连化浊胶囊含药血清,空白组加入等体积的空白血清,培养24 h后进行后续实验。血清提取方法参考文献[10]。
1.9 流式细胞术检测平滑肌细胞凋亡率将用0.25%胰蛋白酶消化的平滑肌细胞接种到含FBS的培养基过夜培养。各组随机选择3个细胞样本,取100 μL接种于5 mL流式试管中,加入5 μL FITC标记的膜联蛋白Ⅴ与5 μL PI混合染色液,遮光条件下静置15 min,再加入200 μL结合溶液,用流式细胞仪进行检测。
1.10 蛋白质印迹法检测平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K及Akt蛋白的表达平滑肌细胞用0.25%胰蛋白酶消化后离心,取上清液检测蛋白质含量后进行SDS-PAGE。将蛋白条带转移到PVDF膜,分别加入一抗(HAT1、HDAC1抗体稀释比例均为1∶2 000,PPARγ、PI3K、Akt抗体稀释比例均为1∶1 000)进行孵育,后加入二抗山羊抗兔IgG(稀释比例为1∶5 000)杂交,用PBS冲洗。将PVDF膜放入显影液,在化学显影仪中曝光,用ImageJ软件对曝光得到的蛋白条带进行灰度测量,以GAPDH为内参,计算目的蛋白的相对表达水平。
1.11 qPCR检测平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K及Akt mRNA的表达平滑肌细胞经0.25%胰蛋白酶消化后采用TRIzol法抽提总RNA。将提取的RNA反转录为cDNA,以β-肌动蛋白为内参进行qPCR。反应条件:95 ℃预变性3 min,95 ℃变性5 s、58 ℃退火30 s,共40个循环。检测结果采用2-ΔΔCt方法进行分析。引物序列如下:HAT1正向引物为5'-GATGATGAAAGATGGCACTAC-3',反向引物为5'-CCTTGACCTTGAAATGGAGT-3';HDAC正向引物为5'-GCCAAGTGTGTGGAATTTGT-3',反向引物为5'-GGAAGGACTGATATGAAGTTT-3';PPARγ正向引物为5'-CCCTTTACCACGGTTGATT-TCTC-3',反向引物为5'-CCAGGCTCTACTTTGA-TCGCACT-3';PI3K正向引物为5'-GACTCCAAG-ATGAAGAAGATGTG-3',反向引物为5'-AAGTA-GGGAGGCATCTCG-3';Akt正向引物为5'-GGGTG-GACTGCTCAAGAAGG-3',反向引物为5'-ATCC-TGCCAGTTGATGCTGA-3';β-肌动蛋白正向引物为5'-ATCATGTTTGAGACCTTCAACA-3',反向引物为5'-CATCTCTTGCTCGAAGTCCA-3'。
1.12 统计学处理采用SPSS 23.0软件对数据进行分析,实验数据符合正态分布,以x±s表示,多组间比较采用单因素方差分析,多重比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 各组小鼠血糖及血脂水平与空白组相比,模型组小鼠PBG、TC、TG及LDL-C含量升高,HDL-C含量降低(P均<0.05)。与模型组比较,阿托伐他汀组、黄连化浊胶囊组、阿托伐他汀+黄连化浊胶囊组小鼠HDL-C含量均升高,PBG、TC、TG及LDL-C含量均降低(P均<0.05)。阿托伐他汀组与黄连化浊胶囊组小鼠血糖及血脂水平的差异均无统计学意义(P均>0.05);与黄连化浊胶囊组、阿托伐他汀组比较,阿托伐他汀+黄连化浊胶囊组小鼠PBG、TC、TG及LDL-C含量均降低,HDL-C含量均升高,差异均有统计学意义(P均<0.05)。见表 1。
|
|
表 1 各组小鼠血糖及血脂水平比较 Tab 1 Comparison of blood glucose and blood lipid levels of mice in each group |
2.2 各组小鼠胸主动脉病理形态改变
空白组小鼠胸主动脉血管内壁层次清晰,细胞无坏死,平滑肌细胞排列正常,无增殖;模型组小鼠胸主动脉血管内皮增厚,有明显的斑块形成,泡沫细胞增多,炎症浸润及平滑肌细胞增多;与模型组相比,阿托伐他汀组、黄连化浊胶囊组小鼠胸主动脉血管内壁层次紊乱改善,泡沫细胞较少;阿托伐他汀+黄连化浊胶囊组小鼠胸主动脉血管内壁层次紊乱的改善优于阿托伐他汀组、黄连化浊胶囊组。见图 1。
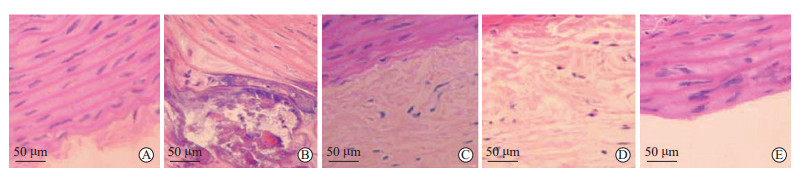
|
图 1 苏木精-伊红染色观察各组小鼠胸主动脉病理形态 Fig 1 Observation of pathological morphology of thoracic aorta of mice in each group by hematoxylin-eosin staining A: Blank group; B: Model group; C: Atorvastatin group; D: Huanglian Huazhuo capsule; E: Atorvastatin+Huanglian Huazhuo capsule group. |
2.3 各组平滑肌细胞凋亡率
空白组平滑肌细胞凋亡率为(5.95±0.63)%,ox-LDL组平滑肌细胞凋亡率[(7.55±1.15)%]与空白组相比升高,差异有统计学意义(P<0.05)。与ox-LDL组相比,ox-LDL+PPARγ沉默组平滑肌细胞凋亡率降低[(4.45±0.57)% vs(7.55±1.15)%,P<0.05],ox-LDL+PPARγ过表达组平滑肌细胞凋亡率升高[(14.96±2.08)% vs(7.55±1.15)%,P<0.05]。见图 2。
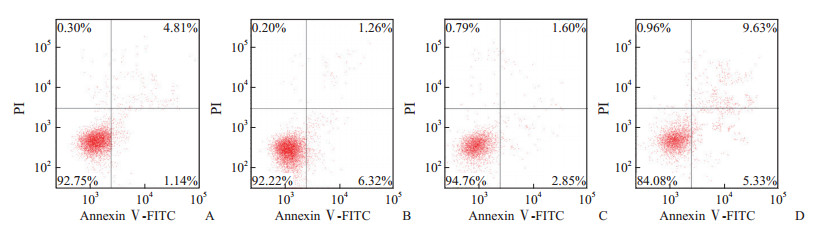
|
图 2 流式细胞术检测各组平滑肌细胞凋亡率 Fig 2 Apoptosis rate of smooth muscle cells in each group detected by flow cytometry A: Blank group; B: ox-LDL group; C: ox-LDL+PPARγ silent group; D: ox-LDL+PPARγ overexpression group; ox-LDL: Human oxidized low density lipoprotein; PPARγ: Peroxisome proliferator-activated receptor γ; PI: Propidium iodide; FITC: Fluorescein isothiocyanate. |
2.4 各组平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K及Akt蛋白的表达
与空白组相比,ox-LDL组平滑肌细胞中HAT1蛋白表达水平升高,HDAC1、PPARγ、PI3K及Akt蛋白表达水平降低(P均<0.05)。与ox-LDL组相比,ox-LDL+PPARγ沉默组平滑肌细胞中HAT1蛋白表达水平升高,HDAC1、PPARγ、PI3K及Akt蛋白表达水平降低(P均<0.05);ox-LDL+PPARγ过表达组平滑肌细胞的HAT1蛋白表达水平降低,HDAC1、PPARγ、PI3K及Akt蛋白表达水平升高(P均<0.05)。见图 3、表 2。

|
图 3 蛋白质印迹法检测各组平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K及Akt蛋白的表达 Fig 3 Expression of HAT1, HDAC1, PPARγ, PI3K and Akt in smooth muscle cells of each group detected by Western blotting 1: Blank group; 2: ox-LDL group; 3: ox-LDL+PPARγ silent group; 4: ox-LDL+PPARγ overexpression group. HAT1: Histone acetyltransferase 1; HDAC1: Histone deacetylase 1; PPARγ: Peroxisome proliferator-activated receptor γ; PI3K: Phosphatidylinositol 3-kinase; Akt: Protein kinase B; ox-LDL: Human oxidized low density lipoprotein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
|
|
表 2 各组平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K及Akt蛋白表达水平比较 Tab 2 Comparison of protein expression levels of HAT1, HDAC1, PPARγ, PI3K and Akt in smooth muscle cells of each group |
2.5 各组平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K及Akt mRNA的表达
ox-LDL组平滑肌细胞中HAT1 mRNA相对表达量高于空白组,HDAC1、PPARγ、PI3K及Akt mRNA相对表达量低于空白组(P均<0.05)。与ox-LDL组相比,ox-LDL+PPARγ沉默组平滑肌细胞中HAT1 mRNA相对表达量增高,HDAC1、PPARγ、PI3K及Akt mRNA相对表达量降低(P均<0.05);ox-LDL+PPARγ过表达组平滑肌细胞HAT1 mRNA相对表达量降低,HDAC1、PPARγ、PI3K及Akt mRNA相对表达量增高(P均<0.05)。见表 3。
|
|
表 3 各组平滑肌细胞中HAT1、HDAC1、PPARγ、PI3K、Akt mRNA相对表达量比较 Tab 3 Comparison of relative mRNA expression levels of HAT1, HDAC1, PPARγ, PI3K and Akt in smooth muscle cells of each group |
3 讨论
糖尿病大血管病变由多种因素导致,糖脂代谢紊乱及氧化应激等增加了血管中血小板聚集黏附,氧化应激引起的炎症反应会增加血管通透性,胆固醇等沉积在动脉内膜下会导致血管病理损伤。高糖环境下血管内皮细胞损伤可诱导血管活性物质或因子表达异常,血管功能紊乱可导致平滑肌细胞结构及功能改变并演变成具有分泌及增殖功能的一类细胞[11]。平滑肌细胞由收缩型表型转变为合成型表型,细胞外基质中基质金属蛋白酶和Ⅰ/Ⅲ型胶原表达增加,可促进动脉粥样斑块形成。本研究首先建立了糖尿病大血管病变小鼠模型观察黄连化浊胶囊对血糖、血脂的改善作用,随后提取平滑肌细胞用高糖培养制成损伤细胞,敲除或过表达PPARγ以含有黄连化浊胶囊血清培养,观察黄连化浊胶囊通过调控PPARγ对糖尿病大血管病变的保护机制。
本研究证实糖尿病大血管病变小鼠静脉血中代谢指标紊乱,H-E染色发现胸主动脉形态有明显斑块形成,经黄连化浊胶囊或阿托伐他汀干预后代谢指标改善、病理损伤减轻,两者联合干预效果更佳,说明黄连化浊胶囊能够改善模型小鼠代谢紊乱,降低主动脉血管损伤。阿托伐他汀能够通过抑制羟甲基戊二酸单酰辅酶A还原酶活性减少胆固醇合成,降低外周血中LDL-C表达,发挥抗斑块形成作用[12]。黄连化浊胶囊由甘肃中医药大学附属医院内分泌科结合糖尿病“浊毒”病理机制研制而成,方中黄连清热燥湿、泻火解毒、止消渴,鸡内金具有醒脾消食、化积滞、缩小便之功,两者共为君药,对于脾胃一泻一补,对于痰浊一解一化,标本兼治,起到化浊、解毒之功效,以治消渴。法半夏体滑而性燥,具有健脾燥湿、温胃降逆作用;竹茹开胃土之郁,清肺金之燥,胆和则烦呕自止;陈皮以辛散之,以苦燥之,调中而快膈,消痰而导滞;枳实破气,痰化而痞胀消,四者共为臣药。茯苓为佐药,味甘、淡,性平,归心、肺、脾、肾经,具有益脾除湿、利窍宁心之功,脾健而痰无以生。炙甘草味甘气温,补三焦元气而散表寒,调和诸药,为使药。全方寒温并用,补泻兼施,达到清热解毒、运脾化浊之效。黄连性寒,对脾、心及大肠经,在《名医别录》中记载对消渴具有治疗作用。现代药理学研究表明,黄连化浊胶囊中黄连的主要活性成分小檗碱能够发挥降糖、改善胰岛素抵抗及降低血脂作用[13]。小檗碱能改善高糖诱导的足细胞功能损伤[14]。刘琴等[15]的研究证实,小檗碱对糖尿病大血管病变小鼠具有抗斑块形成作用。本研究结果与上述文献一致。
高糖能够促进平滑肌细胞增殖,这是糖尿病大血管病变动脉血管中产生斑块的主要原因。糖尿病大血管病变引起动脉硬化产生的主要机制在于平滑肌细胞大量增殖,进入内膜上调细胞外基质活化,诱导纤维组织增生,加快斑块形成[16]。平滑肌细胞生长及凋亡属于一个复杂的基因调控过程,乙酰化是蛋白质翻译后参与细胞活性调控的重要途径之一[17]。HAT/HDAC是乙酰化重要蛋白,两者互相拮抗,均可以调节蛋白乙酰化水平。在糖尿病大血管病变中HAT能够加快组蛋白乙酰化,导致平滑肌细胞DNA与组蛋白连接稀疏,而与其他复合物结合启动基因转录。在上述过程中HDAC表达降低,无法发挥基因抑制作用。
本研究证实,高糖诱导动脉斑块形成时HAT1过度激活,降低了PPARγ表达,因而无法调节胰岛素抵抗的作用,糖脂代谢紊乱增加,促进了平滑肌细胞活性增加、斑块的形成。HDAC特异性激动剂能够上调糖尿病血管病变小鼠PPARγ表达,加快葡萄糖运转调节脂肪因子,抑制平滑肌细胞活性,减少斑块形成[18-19]。PI3K参与细胞生长、分化及凋亡,Akt是相关信号通路之一,两者联合能够在胰岛素调控血糖方面发挥作用。本研究表明,PPARγ过表达能够通过上调PI3K/Akt表达促进平滑肌细胞凋亡,与刘文华等[20]的研究结果一致。黄连是黄连化浊胶囊君药之一,从黄连中提取的异哇琳类生物碱类小檗碱主要发挥抗肿瘤、改善血糖和血脂等作用,能够通过改善糖尿病小鼠代谢指标紊乱对高糖下的斑块形成发挥抑制作用[21]。ox-LDL能致平滑肌细胞中PPARγ表达降低,抑制巨噬细胞对ox-LDL的吸收,小檗碱通过上调PPARγ表达增加巨噬细胞对ox-LDL的摄取并促进细胞凋亡,抑制平滑肌细胞活性,减少斑块形成。魏胜男[22]的研究也发现,黄癸固体分散体的主要成分小檗碱能够介导PI3K/Akt通路激活,促进糖代谢运转,减少血管内皮损伤。
综上所述,黄连化浊胶囊能够通过抑制HAT表达,抑制糖尿病大血管病变小鼠代谢紊乱,促进平滑肌细胞凋亡,减少动脉斑块形成,从而发挥保护作用,其机制可能与调节PPARγ/PI3K/Akt信号通路有关。
| [1] |
孙学娇, 刘乃丰. 关注糖尿病与血管钙化的共同发病机制和临床意义[J]. 中国动脉硬化杂志, 2020, 28: 169-174. |
| [2] |
LI C L, LIU X H, QIAO Y, NING L N, LI W J, SUN Y S, et al. Allicin alleviates inflammation of diabetic macroangiopathy via the Nrf2 and NF-kB pathway[J/OL]. Eur J Pharmacol, 2020, 876: 173052. DOI: 10.1016/j.ejphar.2020.173052.
|
| [3] |
DEMYANENKO S V, DZREYAN V A, UZDENSKY A B. The expression and localization of histone acetyltransferases HAT1 and PCAF in neurons and astrocytes of the photothrombotic stroke-induced penumbra in the rat brain cortex[J]. Mol Neurobiol, 2020, 57: 3219-3227. DOI:10.1007/s12035-020-01959-6 |
| [4] |
CICCOCIOPPO R, UBALDI M. Nuclear peroxisome proliferator activated receptor-gamma (PPARγ) as a therapeutic target to treat neurodegeneration and dependence elicited by drugs of abuse[J]. Neural Regen Res, 2021, 16: 984-985. DOI:10.4103/1673-5374.297072 |
| [5] |
RAMBUR A, LOURS-CALET C, BEAUDOIN C, BUÑAY J, VIALAT M, MIROUSE V, et al. Sequential Ras/MAPK and PI3K/AKT/mTOR pathways recruitment drives basal extrusion in the prostate-like gland of Drosophila[J/OL]. Nat Commun, 2020, 11: 2300. DOI: 10.1038/s41467-020-16123-w.
|
| [6] |
金轶平, 朱皓皓, 廖宇洁, 于晓彦. 黄连素对高糖培养的大鼠视网膜Müller细胞的抗凋亡和抗炎作用及其机制[J]. 中华实验眼科杂志, 2020, 38: 1016-1024. |
| [7] |
富晓旭, 高泓, 刘桠, 谢红艳, 袁海泼, 谢春光. 基于表达谱芯片研究参芪复方对糖尿病大血管病变大鼠血管内皮生长的双向调节作用[J]. 辽宁中医杂志, 2019, 46: 463-466. |
| [8] |
沈娜, 方涛, 苏卫东, 刘勇, 李焕明. ox-LDL诱导的Raw264.7细胞炎症因子表达变化及PPARγ Ser273磷酸化调控作用观察[J]. 山东医药, 2020, 60: 27-31. |
| [9] |
田宏山, 苏晓彤, 赵志东, 韩向敏, 昝林森, 胡江, 等. siRNA沉默ACSL1基因对秦川肉牛脂肪细胞中不饱和脂肪酸合成的影响[J]. 农业生物技术学报, 2020, 28: 1722-1732. |
| [10] |
XU F, LIU Y X, ZHU X X, LI S S, SHI X L, LI Z J, et al. Protective effects and mechanisms of vaccarin on vascular endothelial dysfunction in diabetic angiopathy[J/OL]. Int J Mol Sci, 2019, 20: E4587. DOI: 10.3390/ijms20184587.
|
| [11] |
HU Z P, YANG M Y, XIE C G, GAO H, FU X X, XIE H Y, et al. Efficacy and safety of shenqi compound for the treatment of diabetic macroangiopathy: a protocol for systematic review and meta-analysis[J/OL]. Medicine (Baltimore), 2020, 99: e19682. DOI: 10.1097/MD.0000000000019682.
|
| [12] |
魏京霞, 李丽淑. 阿托伐他汀钙治疗糖尿病合并动脉粥样硬化性疾病的疗效观察[J]. 实用临床医药杂志, 2020, 24: 101-103, 107. |
| [13] |
庄微, 刘挺松, 张成成, 宫剑滨. 小檗碱对波动性高糖诱导的人冠状动脉内皮细胞凋亡的影响[J]. 中草药, 2019, 50: 1365-1371. |
| [14] |
王盈盈, 刘青, 唐丽琴, 魏伟. 小檗碱对高糖诱导足细胞功能及相关蛋白表达的影响[J]. 中国药理学通报, 2018, 34: 1158-1163. |
| [15] |
刘琴, 杨黎星, 石婧, 黄雨晴, 高洪婷, 鞠瑞, 等. 小檗碱激活巨噬细胞自噬并改善动脉粥样硬化斑块脆弱性[J]. 基础医学与临床, 2020, 40: 668-677. |
| [16] |
NIE X W, TAN J X, DAI Y A, LIU Y, ZOU J, SUN J, et al. CCL5 deficiency rescues pulmonary vascular dysfunction, and reverses pulmonary hypertension via caveolin-1-dependent BMPR2 activation[J]. J Mol Cell Cardiol, 2018, 116: 41-56. |
| [17] |
ZHANG B Y, DONG Y, LIU M, YANG L, ZHAO Z. miR-149-5p inhibits vascular smooth muscle cells proliferation, invasion, and migration by targeting histone deacetylase 4(HDAC4)[J]. Med Sci Monit, 2019, 25: 7581-7590. |
| [18] |
GAO Q, WEI A, CHEN F, CHEN X R, DING W W, DING Z Q, et al. Enhancing PPARγ by HDAC inhibition reduces foam cell formation and atherosclerosis in ApoE deficient mice[J/OL]. Pharmacol Res, 2020, 160: 105059. DOI: 10.1016/j.phrs.2020.105059.
|
| [19] |
张昭亮. C/EBPα基因启动子DNA超甲基化对与PPARγ相关的HDAC1抑制解除作用[J]. 中国矫形外科杂志, 2013, 21: 1761-1766. |
| [20] |
刘文华, 望永鼎, 翟一飞, 靳莉莉, 肖丽, 李永兵. 人参皂苷Rg1介导PI3K/AKT/FOXO3通路缓解高糖诱导的肾小球系膜细胞氧化应激反应[J]. 免疫学杂志, 2020, 36: 285-291. |
| [21] |
胡亚耘, 陆付耳, 胡倩, 易屏. 小檗碱调控AMPK-TSC1/LC3-Ⅱ信号通路促进高糖高脂应激下NIT-1胰岛β细胞的自噬[J]. 中国医院药学杂志, 2020, 40: 29-37. |
| [22] |
魏胜男. 黄癸固体分散体通过调控肝脏HNF4α/miR122通路纠正糖尿病糖脂代谢紊乱机制研究[D]. 长春: 吉林大学, 2016.
|
 2023, Vol. 44
2023, Vol. 44


