皮质性痴呆是疾病侵犯大脑皮质所致的痴呆,多因皮质神经元变性和萎缩引起认知障碍,如阿尔茨海默病(Alzheimer disease,AD)和额颞叶痴呆等[1]。AD是常见的皮质性痴呆基础疾病,病理改变主要在大脑皮质[2],包括β淀粉样蛋白(amyloid β-protein,Aβ)积聚形成的细胞外神经炎性斑块和Tau蛋白过度磷酸化形成的神经细胞内神经原纤维缠结(neurofibrillary tangle,NFT),从而引发大脑皮质皱缩、脱失及海马椎体细胞颗粒空泡变性等皮质损害,并伴有脑区神经元大量丢失及突触功能异常[2-5]。AD患者Aβ的产生与正常人相同,但清除率降低[6],疾病早期Aβ沉积形成的斑块首先出现在皮质基部并沿皮质分布,晚期斑块在整个脑内发生沉积,尤以皮质沉积量最大,进而干扰中枢神经系统功能并引发AD等神经系统疾病[7]。
本研究拟在D-半乳糖(D-galactose,D-gal)致衰老动物模型基础上,辅以能引起脑内老年斑和NFT的化学试剂亚硝酸钠,制备皮质性痴呆小鼠模型[8]。本研究采用生物相容性微乳(biocompatible microemulsion)模拟人体胃液[9],仿生提取党参远志散复方[10],基于中药复方多靶点、多环节、多途径、整体调节的特点和微乳制剂低黏度、稳定、吸收迅速、靶向释药等特点[11],探究党参远志散微乳对皮质性痴呆模型小鼠学习记忆能力的影响,并通过检测PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的表达,初步探讨其作用机制。
1 材料和方法 1.1 动物、试剂与仪器SPF级ICR小鼠60只,雌雄各半,7周龄,体重(20±2)g,由上海西普尔-必凯实验动物有限公司[实验动物生产许可证号:SCXK(沪)2013-0016]提供,经上海市实验动物检测中心检验合格(实验动物合格证号:20130016008383)。本研究涉及的所有动物相关操作由山西中医药大学医学伦理委员会批准(2019LL136)。
远志(批号:130823060)购自安国市祁澳中药饮片有限公司;黄连(批号:1801002)、石菖蒲(批号:1512001)、党参(批号:1611001)、茯苓(批号:1611001)购自河北全泰药业有限公司,经山西中医药大学裴香萍教授鉴定均为《中华人民共和国药典》2015年版规定正品;D-gal(批号:20141212)购自天津市光复精细化工研究所;亚硝酸钠(批号:20160518)购自天津市天大化工实验厂;吡拉西坦片(商品名为脑复康片,批号:6180308)购自东北制药集团沈阳第一制药有限公司;尼氏染液(货号:R30434)购自上海源叶生物科技有限公司;PI3K催化亚单位γ抗体(货号:ab140307)购自英国Abcam公司,鼠抗Akt抗体(货号:bsm-33325M)、兔抗mTOR抗体(货号:bs-1992R)、兔抗双皮质素(doublecortin,DCX)抗体(货号:bs-20797R)、DAPI溶液(货号:C02-04002)均购自北京博奥森生物技术有限公司;兔SP检测试剂盒(货号:SP-9001)、DAB显色试剂盒(货号:ZLI-9017)、FITC标记兔抗山羊IgG(货号:ZF-0314)均购自北京中杉金桥科技有限公司。
JLBehv-M Morris水迷宫视频分析系统购自上海吉量软件科技有限公司,ASP300全自动组织脱水机、EG1150组织包埋机、CM1950全自动切片机均购自德国Leica公司,BX51T-PHD-J11显微镜、IX71荧光倒置显微镜购自日本奥林巴斯株式会社。
1.2 党参远志散微乳的制备[10, 12-13]按照远志散原复方克配比4∶5∶6∶4∶3称取远志、茯苓、石菖蒲、黄连、党参,干燥、粉碎后,过一号筛,用液固比2.3 mL/g的生物相容性微乳避光浸泡24 h,37 ℃恒温渗漉,得到党参远志散微乳。
1.3 动物分组、造模与给药小鼠常规饲养1周后随机分为空白组、模型组、生物相容性微乳组、吡拉西坦组、党参远志散微乳低剂量组、党参远志散微乳高剂量组,每组10只,雌雄各半。除空白组外,其余组均腹腔注射D-gal 120 mg/kg和亚硝酸钠54 mg/kg制备皮质性痴呆模型;间隔6 h后,模型组灌胃蒸馏水,生物相容性微乳组灌胃生物相容性微乳10 mL/kg,吡拉西坦组灌胃吡拉西坦0.63 g/kg,党参远志散微乳低剂量组和高剂量组分别灌胃党参远志散微乳8.58 g/kg(相当于生药材量)、17.16 g/kg(相当于生药材量),每天1次,持续6周[11, 14]。
1.4 Morris水迷宫实验[15]所用Morris水迷宫为直径120 cm、高度50 cm的圆形水池,水温(24±2)℃。在第三象限正中距池壁30 cm处放1个直径6 cm、高度21.5 cm的圆形黑色平台,平台低于水面1~2 cm,用摄像机即时记录小鼠运动轨迹。定位航行实验:软件记录60 s内小鼠找到平台的时间,即逃避潜伏期,若小鼠在60 s内未找到平台,则由实验者将其引导上平台并停留10 s,记录逃避潜伏期为60 s,每天训练2次,共5 d。空间探索实验:第6天拆除平台,检测小鼠记忆能力,软件记录小鼠60 s内在原平台所在象限内停留的时间及穿越原平台的次数。
1.5 脑组织切片制备及检测Morris水迷宫实验结束24 h后脱颈椎处死小鼠,剪开小鼠头皮,暴露出头骨,用直镊拨开小鼠脑壳,取出鼠脑浸泡在4%多聚甲醛溶液中固定。取固定完成的脑组织,经梯度乙醇脱水、二甲苯透明,用55 ℃石蜡和铜制模具包埋。用切片机切成厚度为5 μm的切片,附于经多聚赖氨酸处理的载玻片上,60 ℃过夜。
1.5.1 H-E染色切片常规脱蜡至水,用苏木精水溶液染色后在酸水和氨水中分色,再用乙醇伊红染色液染色2~3 min,脱水、透明、封固,在光学显微镜下观察并拍照记录。
1.5.2 尼氏染色切片常规脱蜡至水,蒸馏水冲洗,放入甲苯胺蓝染色液并将染色缸置于恒温箱50 ℃浸染40 min,蒸馏水稍冲洗后,入70%乙醇冲洗,95%乙醇迅速分化,无水乙醇脱水,二甲苯透明,用中性树胶封固,在光学显微镜下观察。
1.5.3 免疫组织化学染色取切片浸于二甲苯、系列浓度乙醇、自来水、PBS,各洗2次,每次5 min。加1%甲醇双氧水室温放置10 min,用蒸馏水、0.1 mol/L PBS冲洗。加抗原修复液室温放置10 min,用0.1 mol/L PBS冲洗。切片上滴加山羊血清封闭液,室温放置20 min。甩去多余液体,不洗,切片上滴加相应一抗(1∶100),4 ℃过夜,用0.1 mol/L PBS冲洗。切片上滴加生物素化二抗(IgG),37 ℃放置20 min,用0.1 mol/L PBS冲洗。滴加HRP标记链霉卵白素工作液,37 ℃放置20 min,用0.1 mol/L PBS冲洗。用DAB显色6 min,充分水洗。用苏木精复染细胞核1 min,充分水洗,1%盐酸乙醇分化,1%氨水返蓝,充分水洗,经系列浓度乙醇脱水、二甲苯透明,中性树脂封片。每组选取3张切片,在40×10倍视野下随机选取3个视野拍照,使用Image-Pro Plus 6.0成像软件(美国Media Cybernetics公司)进行图像分析和处理。
1.5.4 免疫荧光染色取切片浸于二甲苯1.5 h,经系列浓度乙醇冲洗、自来水冲洗,加入3%甲醇双氧水室温放置20 min,自来水冲洗。热修复抗原后,将切片放入PBS。取出切片,滴加山羊血清封闭液,室温放置20 min。甩去多余液体,不洗,滴加一抗(1∶100)4 ℃过夜,PBS冲洗。切片上滴加荧光标记的二抗(IgG),37 ℃避光放置20 min,PBS冲洗后滴加DAPI试剂染核3~5 min,PBS冲洗,晾干,中性树胶封片,经显微照相后,使用ISCapture成像软件(上海深瞳光电科技有限公司)进行图像分析。
1.6 统计学处理应用SPSS 19.0软件进行统计学分析。服从正态分布的计量资料以x±s表示,组间比较采用单因素方差分析,多重比较采用最小显著性差异法。检验水准(α)为0.05。
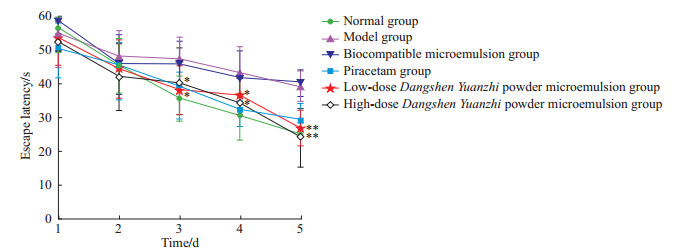
2 结果 2.1 党参远志散微乳对皮质性痴呆小鼠学习记忆能力的影响党参远志散微乳高剂量组有2只小鼠分别于灌胃后第32、36天死亡,死亡原因为胃肠肿胀;其余小鼠均存活。Morris水迷宫定位航行实验结果(图 1)显示,经过学习,各组小鼠逃避潜伏期呈现下降趋势;与模型组比较,党参远志散微乳低、高剂量组小鼠从第3天起逃避潜伏期缩短(P均<0.05)。空间探索实验结果(图 2、表 1)显示,空白组小鼠轨迹相对集中在平台所在第三象限,轨迹相对稀疏;与空白组比较,模型组和生物相容性微乳组小鼠轨迹遍布于4个象限内,学习记忆能力下降,表现为原平台所在象限停留时间、穿越原平台次数均减少(P均<0.01);与模型组比较,3个药物干预组小鼠轨迹密集分布在原平台所在第三象限,学习记忆能力提高,表现为吡拉西坦组在原平台所在象限停留时间延长(P<0.01),党参远志散微乳低、高剂量组在原平台所在象限停留时间延长(P均<0.01)且穿越原平台次数增多(P均<0.05),但低、高剂量组之间差异并无统计学意义。结果表明,低、高剂量党参远志散微乳均能提高模型小鼠的学习记忆能力,且低、高剂量效果相当。
|
图 1 Morris水迷宫实验第1~5天各组小鼠的逃避潜伏期 Fig 1 Escape latency of mice in each group in Morris water maze test from day 1 to day 5 *P < 0.05, **P < 0.01 vs model group. n=10 in normal, model, biocompatible microemulsion, piracetam and low-dose Dangshen Yuanzhi powder microemulsion groups; n=8 in high-dose Dangshen Yuanzhi powder microemulsion group (one mouse of 10 died on the 32nd day of gavage and another mouse died on the 36th day of gavage, which had no effect on the test results). x±s. |

|
图 2 Morris水迷宫实验第6天各组小鼠游泳轨迹 Fig 2 Swimming track of mice in each group in Morris water maze test on the 6th day From left to right are normal, model, biocompatible microemulsion, piracetam, low-dose Dangshen Yuanzhi powder microemulsion, and high-dose Dangshen Yuanzhi powder microemulsion groups. |
|
|
表 1 Morris水迷宫实验中各组小鼠在原平台所在象限内的停留时间和穿越原平台次数 Tab 1 Dwell time in quadrant of original platform and times of crossing the original platform of mice in each group in Morris water maze test |
2.2 党参远志散微乳对皮质性痴呆小鼠海马皮质组织病理学的影响
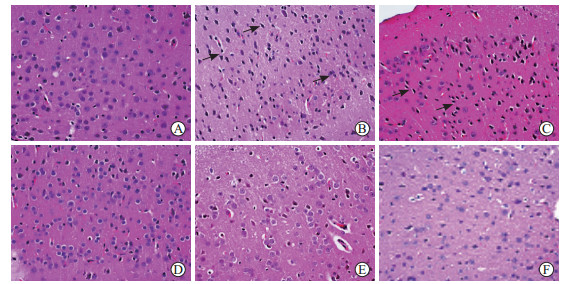
H-E染色结果(图 3)显示,空白组小鼠海马皮质神经元排列整齐、紧密,细胞形态完整。模型组小鼠海马皮质神经元层次紊乱、排列松散,大多神经细胞核膜不清,胞核固缩呈三角形或多角形,胞质消失,轻度水样变性。生物相容性微乳组小鼠海马皮质神经元胞质疏松,轻度水样变性。吡拉西坦组小鼠海马皮质神经元核固缩减轻,未见水样变性,病理结构有明显改善。党参远志散微乳低、高剂量组小鼠海马皮质神经元未见异常,病理结构改善明显。
|
图 3 各组小鼠海马皮质的病理形态学(H-E染色,400×) Fig 3 Pathomorphology of hippocampal cortex of mice in each group (H-E staining, 400×) A: Normal group; B: Model group; C: Biocompatible microemulsion group; D: Piracetam group; E: Low-dose Dangshen Yuanzhi powder microemulsion group; F: High-dose Dangshen Yuanzhi powder microemulsion group. The arrows show cell shrinkage. H-E: Hematoxylin-eosin. |
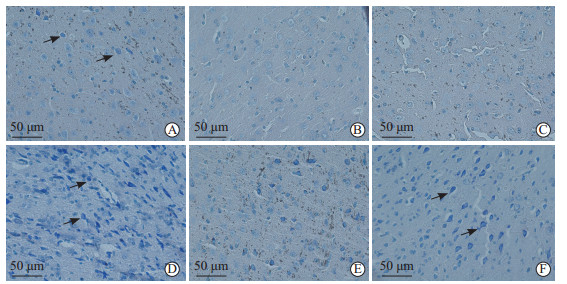
尼氏染色结果(图 4)显示,尼氏体位于神经元胞体和树突内,光镜下呈强嗜碱性。空白组小鼠海马皮质神经元排列整齐密集,形态规则圆整,胞质中尼氏体丰富。模型组、生物相容性微乳组小鼠海马皮质神经元排列紊乱稀疏,神经元脱失明显,胞质中尼氏体减少。吡拉西坦组小鼠海马皮质神经元排列紊乱紧密,形态不规整,但胞质中尼氏体丰富致密。党参远志散微乳低、高剂量组小鼠海马皮质神经元排列和形态均明显改善,高剂量组神经元胞体和树突内尼氏体丰富。
|
图 4 各组小鼠海马皮质神经元尼氏体的变化(尼氏染色) Fig 4 Changes of Nissl bodies in hippocampal cortical neurons of mice in each group (Nissl staining) A: Normal group; B: Model group; C: Biocompatible microemulsion group; D: Piracetam group; E: Low-dose Dangshen Yuanzhi powder microemulsion group; F: High-dose Dangshen Yuanzhi powder microemulsion group. The arrows show Nissl bodies. |
2.3 党参远志散微乳对皮质性痴呆小鼠海马皮质PI3K、Akt、mTOR表达的影响
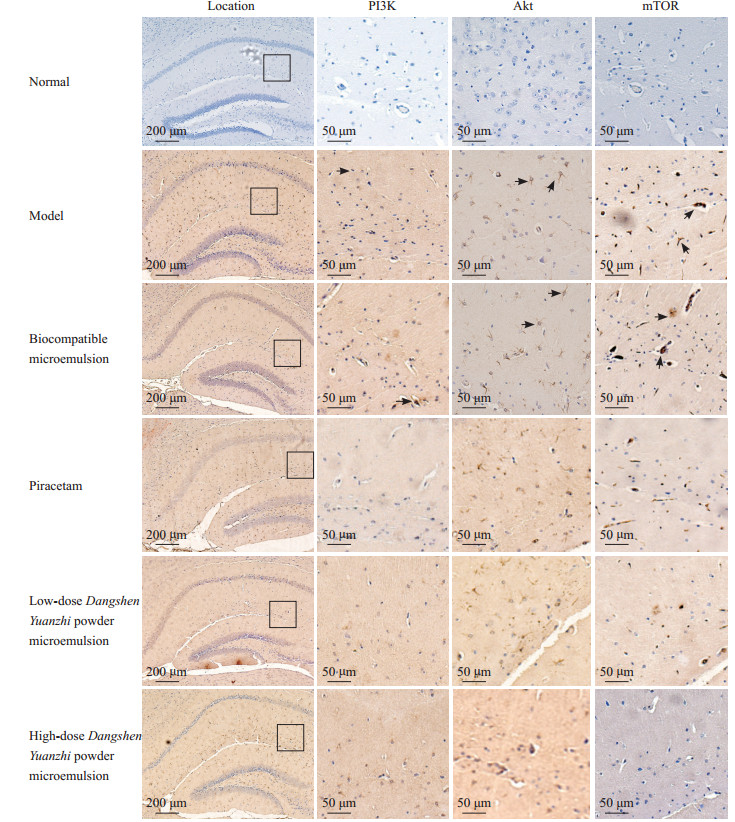
免疫组织化学染色结果(图 5、表 2)显示,与空白组比较,模型组与生物相容性微乳组小鼠海马皮质PI3K、Akt、mTOR阳性细胞数和平均光密度均增高(P均<0.01)。与模型组比较,3个药物干预组小鼠海马皮质PI3K、Akt、mTOR阳性细胞数均降低(P均<0.05);3个药物干预组小鼠海马皮质PI3K、Akt平均光密度降低;党参远志散微乳高剂量组mTOR平均光密度降低,但吡拉西坦组和党参远志散微乳低剂量组mTOR平均光密度均增高(P均<0.05)。与吡拉西坦组比较,党参远志散微乳低、高剂量组PI3K、Akt、mTOR阳性细胞数均降低,党参远志散微乳高剂量组Akt、mTOR平均光密度均降低(P均<0.05)。与党参远志散微乳低剂量组比较,高剂量组PI3K、mTOR阳性细胞数均降低(P均<0.05),PI3K、Akt、mTOR平均光密度均降低(P均<0.05)。结果表明,党参远志散微乳低、高剂量均能降低PI3K、Akt、mTOR在皮质性痴呆小鼠海马皮质的表达,且高剂量效果更显著。
|
图 5 各组小鼠海马皮质PI3K、Akt、mTOR蛋白的表达(免疫组织化学染色) Fig 5 Protein expression of PI3K, Akt and mTOR in hippocampal cortex of mice in each group (immunochemical staining) The arrows show positive expression of protein. The figures in the last 3 columns are an enlarged view of the part framed by the square of the first column. PI3K: Phosphatidylinositol 3-kinase; Akt: Protein kinase B; mTOR: Mammalian target of rapamycin. |
|
|
表 2 各组小鼠海马皮质PI3K、Akt、mTOR阳性细胞数和平均光密度 Tab 2 Number of positive cells and average optical density of PI3K, Akt and mTOR in hippocampal cortex of mice in each group |
2.4 党参远志散微乳对皮质性痴呆小鼠海马皮质DCX表达的影响
利用DCX抗体特异性标记新生神经元胞质及突起进行免疫荧光染色,结果(图 6)显示DCX阳性细胞呈绿色荧光,分布于小鼠海马皮质,其胞质和突起均呈绿色。空白组小鼠海马皮质仅见分布稀疏的DCX阳性细胞,胞体小,多为短突起。模型组及生物相容性微乳组小鼠海马皮质无明显可见的DCX阳性细胞。吡拉西坦组、党参远志散微乳低剂量组、党参远志散微乳高剂量组小鼠海马皮质DCX阳性细胞胞体大且突起长,党参远志散微乳低、高剂量组皮质DCX阳性细胞更密集多见。
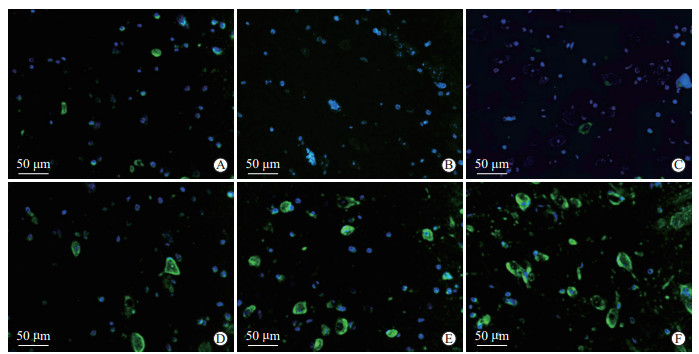
|
图 6 各组小鼠海马皮质DCX蛋白的表达(免疫荧光染色) Fig 6 Expression of DCX protein in hippocampal cortex of mice in each group (immunofluorescence staining) A: Normal group; B: Model group; C: Biocompatible microemulsion group; D: Piracetam group; E: Low-dose Dangshen Yuanzhi powder microemulsion group; F: High-dose Dangshen Yuanzhi powder microemulsion group. DCX: Doublecortin. |
由表 3可见,与空白组比较,模型组与生物相容性微乳组小鼠海马皮质DCX阳性细胞数和平均光密度均降低(P均<0.01)。与模型组比较,3个药物干预组小鼠海马皮质DCX阳性细胞数和平均光密度均增高(P均<0.01)。与吡拉西坦组比较,党参远志散微乳低剂量组DCX阳性细胞数增高(P<0.01),党参远志散微乳高剂量组DCX阳性细胞数和平均光密度均增高(P均<0.01)。与党参远志散微乳低剂量组比较,高剂量组DCX平均光密度增高(P<0.05)。结果表明,低、高剂量党参远志散微乳均可诱导皮质性痴呆小鼠海马皮质神经元新生、增强DCX蛋白阳性表达,且高剂量组效果更显著。
|
|
表 3 各组小鼠海马皮质DCX阳性细胞数和平均光密度 Tab 3 Number of positive cells and average optical density of DCX in hippocampal cortex of mice in each group |
3 讨论
本研究采用D-gal联合亚硝酸钠建立小鼠皮质性痴呆模型。长时间注射D-gal后其代谢产物半乳糖醇不能进一步代谢而堆积在细胞内,从而影响渗透压,引起细胞膜脂质过氧化,导致一系列氧化损伤;亚硝酸钠能将血红蛋白中的二价铁氧化成三价铁,使血红蛋白失去携带、输送氧气功能,导致机体组织发生缺氧性中毒[16-18]。本研究通过腹腔注射D-gal、亚硝酸钠建立小鼠模型,H-E、尼氏染色结果显示模型小鼠海马皮质出现神经元缺失、神经元核固缩、尼氏体数量减少等类似于AD的病理形态改变,说明该模型能够模拟皮质性痴呆。
PI3K/Akt/mTOR信号通路参与中枢神经系统细胞存活、自噬、神经发生、神经元增殖分化、突触可塑性等生理过程[19]。PI3K信号通路活化由PI3K激活开始,质膜产生第二信使磷酸肌醇三磷酸(phosphatidylinositol 3, 4, 5-triphosphate,PIP3),PIP3与细胞内含有普列克底物蛋白同源域(pleckstrin homology domain,PHD)的信号蛋白Akt和磷酸肌醇依赖性激酶1(phosphoinositide-dependent kinase 1,PDK1)结合,促使PDK1磷酸化Akt蛋白的Ser-308位点,活化的Akt通过磷酸化mTOR的Ser-448位点激活mTOR,被激活的mTOR将大大提高RNA的翻译效率,从而调节细胞生长[20]。PI3K/Akt/mTOR信号通路是自噬调控的主要节点[21-22],该通路通过调控自噬水平参与神经系统疾病的发生、发展[23]。
AD与PI3K/Akt/mTOR异常激活有关[24]。本研究中皮质性痴呆模型小鼠海马皮质PI3K、Akt、mTOR均出现了高表达。PI3K/Akt/mTOR信号通路被异常激活后,神经元自噬水平受到抑制,对Aβ的清除率降低,促进AD的发生[25]。DCX是一种在神经前体细胞和未成熟的神经细胞表达的微管相关蛋白,在神经前体细胞分裂活跃时开始表达[26],在新神经元中进行最终定位。皮质性痴呆模型小鼠海马皮质无明显可见的DCX阳性细胞,说明神经元受到损伤。通过党参远志散微乳干预,治疗组PI3K、Akt、mTOR的阳性表达下降,DCX阳性表达提升,说明党参远志散微乳可通过抑制PI3K/Akt/mTOR信号通路诱导自噬,减轻神经元损伤,诱导神经元新生,改善D-gal和亚硝酸钠所致的皮质性痴呆模型小鼠的学习记忆能力。安柳等[27]的研究证实远志具有胃肠毒性而石菖蒲对其毒性有一定的拮抗作用。本研究中党参远志散微乳高剂量组出现小鼠因胃肠肿胀毒性而死亡的现象,与周国俅等[28]研究结果一致。权衡效毒,党参远志散微乳应选择用低剂量,即临床等效剂量。
| [1] |
阿尔茨海默病名词审定委员会. 全国科学技术名词审定委员会公布阿尔茨海默病名词(2019)[J]. 阿尔茨海默病及相关病, 2019, 2: 460-480. DOI:10.3969/j.issn.2096-5516.2019.03.014 |
| [2] |
李拓, 赵忠新. β-淀粉样肽与阿尔茨海默病[J]. 第二军医大学学报, 2010, 31: 1133-1137. LI T, ZHAO Z X. β-amyloid and Alzheimer disease: recent progress[J]. Acad J Sec Mil Med Univ, 2010, 31: 1133-1137. |
| [3] |
ITTNER L M, GÖTZ J. Amyloid-β and tau: a toxic pas de deux in Alzheimer's disease[J]. Nat Rev Neurosci, 2011, 12: 65-72. |
| [4] |
李雪霞. Zn2+对阿尔茨海默症的损伤机制及干预药物的研究[D]. 合肥: 中国科学技术大学, 2020.
|
| [5] |
MARTINEZ B, PEPLOW P V. Amelioration of Alzheimer's disease pathology and cognitive deficits by immunomodulatory agents in animal models of Alzheimer's disease[J]. Neural Regen Res, 2019, 14: 1158-1176. DOI:10.4103/1673-5374.251192 |
| [6] |
陈紫晗, 孙琳琳, 张艺璇, 闫军浩. β-淀粉样蛋白清除障碍在阿尔兹海默症发病中的作用[J]. 生理科学进展, 2019, 50: 149-152. DOI:10.3969/j.issn.0559-7765.2019.02.016 |
| [7] |
OW S Y, DUNSTAN D E. A brief overview of amyloids and Alzheimer's disease[J]. Protein Sci, 2014, 23: 1315-1331. DOI:10.1002/pro.2524 |
| [8] |
李岚, 刘爽, 于燕, 宁巧庆, 王秀华, 张秀丽. 阿尔茨海默病复合动物模型的构建[J]. 中国老年学杂志, 2015, 35: 6685-6688. DOI:10.3969/j.issn.1005-9202.2015.23.018 |
| [9] |
李卫飞, 冯前进, 李妍, 刘晓艳, 许金凯, 刘帅, 等. 生物相容性微乳抗H1N1流感病毒效果及其作用机制的网络分析[J]. 中华中医药杂志, 2017, 32: 4377-4380. |
| [10] |
杨丽霞, 赵婧, 郭亚菲, 冯前进, 王颖莉. 生物相容性党参远志散微乳对AD模型小鼠学习记忆的影响[J]. 中华中医药杂志, 2020, 35: 1732-1735. |
| [11] |
叶海英, 张忠义. 常见载药微乳制剂及其特性[J]. 第一军医大学学报, 2001, 21: 80-83. |
| [12] |
郝彦伟, 李斌, 张怡, 谢沛俊, 喻俊榕, 向劲松, 等. 基于脑肠肽Ghrelin水平探讨远志散对AD大鼠学习记忆能力及进食量的影响[J]. 中国实验方剂学杂志, 2020, 26: 8-14. |
| [13] |
国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2020: 凡例Ⅺ.
|
| [14] |
杨丽霞, 赵婧, 王善, 王佳敏, 王颖莉. 党参远志散微乳对阿尔茨海默病模型小鼠学习记忆障碍的改善作用[J]. 中草药, 2020, 51: 1257-1263. DOI:10.7501/j.issn.0253-2670.2020.05.023 |
| [15] |
BANJI O J F, BANJI D, CH K. Curcumin and hesperidin improve cognition by suppressing mitochondrial dysfunction and apoptosis induced by D-galactose in rat brain[J]. Food Chem Toxicol, 2014, 74: 51-59. DOI:10.1016/j.fct.2014.08.020 |
| [16] |
李牧函. 6首开心散类方对阿尔茨海默症的药理作用及机制初探[D]. 北京: 北京中医药大学, 2016.
|
| [17] |
ALI T, BADSHAH H, KIM T H, KIM M O. Melatonin attenuates D-galactose-induced memory impairment, neuroinflammation and neurodegeneration via RAGE/NF-κB/JNK signaling pathway in aging mouse model[J]. J Pineal Res, 2015, 58: 71-85. |
| [18] |
郭静静, 廖红. 阿尔茨海默病治疗药物的研究进展[J]. 中国药科大学学报, 2010, 41: 395-400. |
| [19] |
张治楠, 梁丽艳, 连嘉惠, 黄芸, 钟正, 曲姗姗, 等. 中枢神经系统PI3K/AKT/mTOR信号通路研究进展[J]. 实用医学杂志, 2020, 36: 689-694. |
| [20] |
WANG W F, XIE Y, ZHOU Z H, QIN Z H, WU J C, HE J K. PIK3CA hypomethylation plays a key role in activation of the PI3K/AKT pathway in esophageal cancer in Chinese patients[J]. Acta Pharmacol Sin, 2013, 34: 1560-1567. |
| [21] |
AKHMETZYANOVA E, KLETENKOV K, MUKHAMEDSHINA Y, RIZVANOV A. Different approaches to modulation of microglia phenotypes after spinal cord injury[J/OL]. Front Syst Neurosci, 2019, 13: 37. DOI: 10.3389/fnsys.2019.00037.
|
| [22] |
HASEGAWA J, MAEJIMA I, IWAMOTO R, YOSHIMORI T. Selective autophagy: lysophagy[J]. Methods, 2015, 75: 128-132. |
| [23] |
POLCHI A, MAGINI A, MEO D D, TANCINI B, EMILIANI C. mTOR signaling and neural stem cells: the tuberous sclerosis complex model[J/OL]. Int J Mol Sci, 2018, 19: 1474. DOI: 10.3390/ijms19051474.
|
| [24] |
CRINO P B. The mTOR signalling cascade: paving new roads to cure neurological disease[J]. Nat Rev Neurol, 2016, 12: 379-392. |
| [25] |
LI Q, LIU Y, SUN M. Autophagy and Alzheimer's disease[J]. Cell Mol Neurobiol, 2017, 37: 377-388. |
| [26] |
BROWN J P, COUILLARD-DESPRÉS S, COOPER-KUHN C M, WINKLER J, AIGNER L, KUHN H G. Transient expression of doublecortin during adult neurogenesis[J]. J Comp Neurol, 2003, 467: 1-10. |
| [27] |
安柳, 吴赛, 陈海洋, 吕银娟, 柳琳, 张智华. 石菖蒲-远志药对不同配伍比例对小鼠胃肠形态的影响[J]. 云南中医中药杂志, 2015, 36: 63-66. |
| [28] |
周国俅, 胡婷, 陆礼柏, 俞皋, 韩光顺, 黄锁义. 人参茯神远志石菖蒲配伍提取物的急性毒性预实验[J]. 微量元素与健康研究, 2018, 35: 4-5. |
 2023, Vol. 44
2023, Vol. 44


