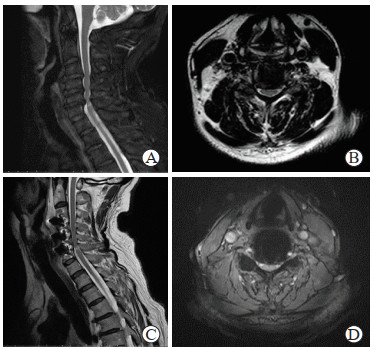
患者男,72岁,因“双上肢麻木10年余,加重伴头晕、步态不稳2个月余”于2022年1月9日收入同济大学附属同济医院脊柱外科。患者10年前无明显诱因出现双上肢麻木刺痛感,无颈肩部疼痛,当时未予重视。2个月前无诱因出现右上肢麻木,感觉过敏伴步态不稳,偶有头晕发作、脚踩棉花感,无视物模糊,无恶心呕吐,无大小便失禁,于2022年1月9日就诊于同济大学附属同济医院,门诊拟“脊髓型颈椎病”收入院。入院体格检查:双侧肩胛提肌、斜方肌、三角肌、肱三头肌、肱二头肌、腕伸肌、腕屈肌肌力Ⅴ级,双手握力Ⅴ级,双侧肩颈不适,双上肢麻木,肱二头肌双侧反射3+/4,膝反射右侧3+/4、左侧2+/4,霍夫曼征、巴宾斯基征阴性,颈椎日本骨科协会(Japanese Orthopaedic Association,JOA)评分为13分(运动、感觉、膀胱功能得分分别为8、2、3分)。入院当天MRI检查提示C3/4、C4/5、C5/6椎间盘突出伴椎管狭窄(图 1A、1B)。诊断为脊髓型颈椎病。于2022年1月11日在全身麻醉下行颈椎前路减压植骨融合内固定术,手术顺利。术后第1天患者诉双上肢麻木较术前略好转;体格检查示颈部切口见少量渗血,辅料包扎固定中,右上肢肱二头肌、肩胛提肌、斜方肌、肱三头肌、肱二头肌、腕伸肌、腕屈肌肌力Ⅴ级,握力Ⅴ级,三角肌肌力Ⅲ-级;左上肢肌力Ⅴ级;颈椎JOA评分为11分(运动、感觉、膀胱功能得分分别为5、3、3分)。术后第3天复查MRI提示C3~C6椎体内固定中,脊髓减压充分(图 1C、1D)。诊断为颈椎前路术后C5神经根麻痹,遂于术后第3天开始重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)+运动康复训练治疗。
|
图 1 患者手术前后磁共振成像检查资料 术前T2加权成像矢状面可见C3/4、C4/5、C5/6椎间盘突出伴椎管狭窄;B:术前T2加权成像C4/5横断面可见硬脊膜受压、脊髓变性;C:术后T2加权成像矢状面可见C3~C6椎体金属内固定中;D:术后T1加权成像C4/5横断面可见脊髓减压充分,无明显压迫 |
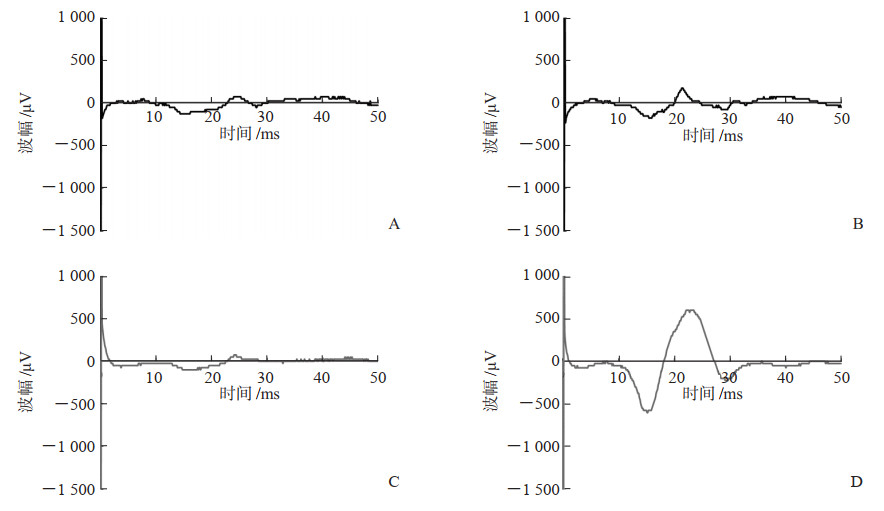
在第1次rTMS治疗前进行运动诱发电位(motor evoked potential,MEP)和表面肌电图(surface electromyography,sEMG)测试,患者取坐位,将sEMG记录和参考电极贴在需要测试的三角肌表面记录皮层MEP和sEMG。测试结果显示静息运动阈值(rest motor threshold,RMT)的MEP潜伏期为9.1 ms,波峰振幅为100 μV;活动运动阈值(active motor threshold,AMT)的MEP潜伏期为9.2 ms,波峰振幅为350 μV(图 2A、2B)。右侧三角肌平均肌电值为146.387 μV,积分肌电值为(348.634±15.826)cm/s,平均功率频率为50.287 Hz,中心频率为41.605 Hz。测试结束后,将圆形线圈中心放置在左侧运动皮质区(M1区),再通过佩戴经颅磁刺激的定位帽,取120% RMT、10 Hz、600个脉冲进行rTMS治疗,每天1次,5次/周,共1周。运动康复训练方案包括三角肌主动肌力训练、上肢功能互动式训练,每天1次,5次/周,共1周。5次联合治疗完成后,体格检查示右上肢三角肌肌力恢复至Ⅳ级,其余肌力Ⅴ级;颈椎JOA评分为13分(运动、感觉、膀胱功能得分分别为7、3、3分)。MEP测试结果(图 2C、2D)提示,在相同刺激强度下RMT、AMT的MEP潜伏期分别为9.1、8.1 ms,波峰振幅分别为350、1 200 μV;sEMG测试结果提示时域指标提升[平均肌电值为423.124 μV,积分肌电值为(982.959±44.788)cm/s],频域指标也有改善(平均功率频率为43.600 Hz,中心频率为39.264 Hz)。患者主诉症状改善,于2022年1月19日出院,出院诊断为脊髓型颈椎病伴颈椎前路术后C5神经根麻痹,门诊随访。术后1个月随访颈椎JOA评分为15分(运动、感觉、膀胱功能得分分别为8、4、3分),右上肢三角肌肌力(Ⅴ级)恢复正常。
|
图 2 患者右侧三角肌RMT和AMT的MEP波形 A:治疗前RMT的MEP波形;B:治疗前AMT的MEP波形;C:治疗后RMT的MEP波形;D:治疗后AMT的MEP波形.RMT:静息运动阈值;AMT:活动运动阈值;MEP:运动诱发电位. |
2 讨论
C5神经根麻痹是颈椎手术的并发症之一,临床表现为颈椎术后肩关节外展受限和/或曲肘无力,且脊髓疾病症状无恶化[1]。研究表明,神经根的牵引移位和再灌注损伤是C5神经根麻痹的重要病理机制[2-3]。解剖上C4/5小关节位置更靠前,由于C5神经根细小且短,容易牵拉C5神经根造成损伤。本例患者病程10余年,术前脊髓受压时间较长,脊髓减压可导致局部血流突然增加,导致细胞内产生大量自由基、细胞受损并形成局部血栓,引起神经功能障碍[4]。对于颈椎术后C5神经根麻痹,目前尚无规范的治疗方案,近年来非侵入性神经调控技术的应用越来越广泛,其中rTMS已被广泛用于脑卒中、脊髓损伤、帕金森病等运动障碍疾病[5],但未见rTMS治疗C5神经根麻痹的报道。C5神经根麻痹的常规治疗方法包括高压氧治疗、物理治疗、皮质类固醇药物和肩带辅具等[6]。Nassr等[7]研究显示,经如上常规方法治疗后约70%的患者C5神经根麻痹症状在术后6个月内完全恢复,但仍有约15%的患者残留不同程度的神经功能缺损症状。因此迫切需要研发用于C5神经根麻痹的新型康复技术,以促进功能障碍的早期恢复。
本例患者电生理评估发现rTMS+运动康复训练治疗后AMT的MEP波峰振幅明显提升,这可能与rTMS的电流作用于突触延长了突触放电时间,即离散程度恢复有关[8]。同时在治疗后积分肌电值和平均肌电值均较治疗前明显提升,平均功率频率和中心频率也下降,说明肌肉的控制能力有所提升,且疲劳程度缓解、神经支配功能恢复。sEMG能客观测量神经肌肉生物电活动,反映神经肌肉功能的状态及肌肉力量的改变,根据其测量指标可了解患者的神经功能和肌肉活动水平变化[9],其中时域指标积分肌电值和平均肌电值,可分别反映肌肉在一定时间内参与活动的运动单位的放电总量和瞬间肌电图振幅的平均水平,与中枢控制能力有关;频域指标平均功率频率和中心频率则反映了肌电信号在频率上的变化,能用于评价肌肉活动时的疲劳程度,其测试结果与运动单位的动作传导速度及同步化程度有关[10]。
综合肌力检查及电生理评估结果,本例患者在rTMS治疗后C5神经根麻痹引起的运动功能障碍有效改善,其机制主要是通过激活膜电位、改变细胞的兴奋性、促进神经元再生、诱发轴突新芽等引发动作电位,从而改善神经传导通路的功能;同时,短时间的高频重复刺激可引起长时程抑制,增强突触传递[11-12],因此rTMS理论上可提高神经元的兴奋性,同时增强受损运动神经元的突触联系,进而改善患者运动功能。
本例患者经过5次磁刺激治疗后,颈椎JOA评分从术后的11分提高到13分。文献报道C5神经根麻痹患者的运动能力恢复率为75.5%,平均运动功能恢复时间为9.7个月,部分患者在手术后数月甚至数年才得以恢复[13]。以上结果表明rTMS对于早期肌肉失神经支配具有显著疗效,能够加快恢复速度,有效改善运动功能障碍,提高了患者术后满意度。
综上所述,本例C5神经根麻痹患者经过1周rTMS治疗后症状明显改善,但需要收集更多病例开展临床随机对照试验以进一步验证。目前C5神经根麻痹的机制尚未明确,也缺少规范的康复治疗方案及共识,但是随着非侵入性神经调控技术的应用和研究越来越深入,rTMS在术后C5神经根麻痹早期评估与治疗中有广泛的应用前景,并将逐步形成规范的干预方案。
| [1] |
NORI S, AOYAMA R, NINOMIYA K, YAMANE J, KITAMURA K, UEDA S, et al. Cervical laminectomy of limited width prevents postoperative C5 palsy: a multivariate analysis of 263 muscle-preserving posterior decompression cases[J]. Eur Spine J, 2017, 26: 2393-2403. DOI:10.1007/s00586-017-5202-8 |
| [2] |
ZHAO J J, ZHAO Q H, LIU Z Z, DENG S X, CHENG L, ZHU W J, et al. The anatomical mechanism of C5 palsy after expansive open-door laminoplasty[J]. Spine J, 2020, 20: 1776-1784. DOI:10.1016/j.spinee.2020.06.002 |
| [3] |
韩钊, 倪斌. 颈椎术后颈5神经根病研究进展[J]. 中国矫形外科杂志, 2019, 27: 251-255. |
| [4] |
SAKAURA H, HOSONO N, MUKAI Y, ISHⅡ T, YOSHIKAWA H. C5 palsy after decompression surgery for cervical myelopathy: review of the literature[J]. Spine (Phila Pa 1976), 2003, 28: 2447-2451. DOI:10.1097/01.BRS.0000090833.96168.3F |
| [5] |
ZHU H J, XU G Z, FU L D, LI Y, FU R, ZHAO D S, et al. The effects of repetitive transcranial magnetic stimulation on the cognition and neuronal excitability of mice[J]. Electromagn Biol Med, 2020, 39: 9-19. DOI:10.1080/15368378.2019.1696358 |
| [6] |
LIM C H, ROH S W, RHIM S C, JEON S R. Clinical analysis of C5 palsy after cervical decompression surgery: relationship between recovery duration and clinical and radiological factors[J]. Eur Spine J, 2017, 26: 1101-1110. DOI:10.1007/s00586-016-4664-4 |
| [7] |
NASSR A, ECK J C, PONNAPPAN R K, ZANOUN R R, DONALDSON W F 3rd, KANG J D. The incidence of C5 palsy after multilevel cervical decompression procedures: a review of 750 consecutive cases[J]. Spine (Phila Pa 1976), 2012, 37: 174-178.
|
| [8] |
ROTENBERG A, HORVATH J C, PASCUAL-LEONE A. Transcranial magnetic stimulation[M]. New York: Humana Press, 2014: 88-92.
|
| [9] |
顾春雅, 程媛, 赵丽娟, 许东升. rTMS刺激运动前区改善脊髓损伤后肌张力障碍1例报告[J]. 四川大学学报(医学版), 2020, 51: 618-621. |
| [10] |
胡凤丹, 蔡华安, 胡德, 符鲲, 黄靓. 表面肌电在临床康复中的应用进展[J]. 赣南医学院学报, 2021, 41: 740-744. |
| [11] |
DI LAZZARO V, ROTHWELL J, CAPOGNA M. Noninvasive stimulation of the human brain: activation of multiple cortical circuits[J]. Neuroscientist, 2018, 24: 246-260. DOI:10.1177/1073858417717660 |
| [12] |
LATORRE A, ROCCHI L, BERARDELLI A, BHATIA K P, ROTHWELL J C. The use of transcranial magnetic stimulation as a treatment for movement disorders: a critical review[J]. Mov Disord, 2019, 34: 769-782. DOI:10.1002/mds.27705 |
| [13] |
HOFLER R C, FRAZZETTA J, ZAKARIA J, AZIZ A, ADAMS W, JONES G A. C5 palsy after cervical laminectomy: natural history in a 10-year series[J]. Spine J, 2021, 21: 1473-1478. DOI:10.1016/j.spinee.2021.04.003 |
 2022, Vol. 43
2022, Vol. 43


