2. 解放军32265部队医院影像科,广州 510220
2. Department of Radiology, Hospital of No. 32265 Troop of PLA, Guangzhou 510220, Guangdong, China
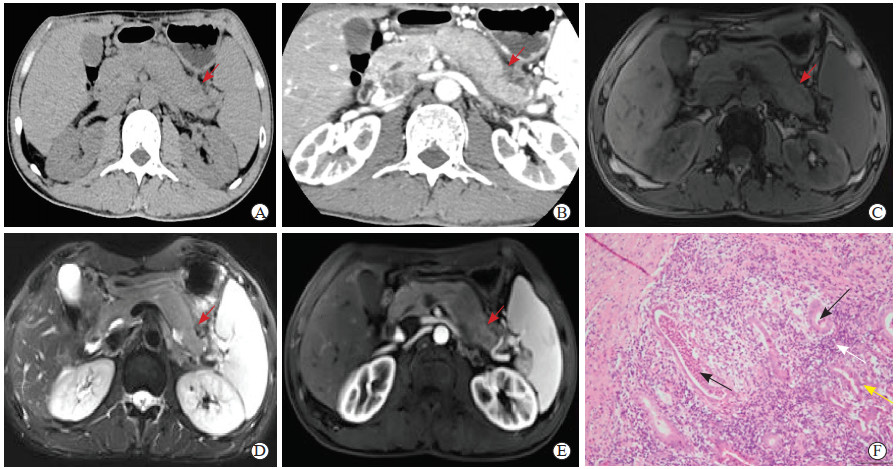
病例1,男,47岁,因“腹痛及体重下降2个月余”于2018年11月4日至海军军医大学(第二军医大学)第一附属医院住院治疗。2018年8月28日患者因“腹痛伴腰背部疼痛”就诊于苏北人民医院,急查血淀粉酶为456 U/mL,血脂酶为1 092 U/L,考虑急性胰腺炎,予抑酸、抑酶补液等对症支持治疗后好转出院。2018年10月3日患者再次出现腹痛,于苏北人民医院查血淀粉酶为151.8 U/mL,CA19-9为153.5 U/mL;腹部CT检查提示胰尾部异常信号灶伴周围少许渗出,脾胰间隙淋巴结显示;予对症支持治疗后好转出院。为求进一步治疗,于2018年10月29日至海军军医大学(第二军医大学)第一附属医院就诊,行胰腺CT平扫+增强检查提示胰腺体尾部稍低密度肿块影,增强后肿块未见明显强化,肿块大小约为21 mm×36 mm,胆管系统可见扩张(图 1A、1B);MRI平扫+增强检查提示胰腺癌可能性大,胰尾部多发潴留囊肿(图 1C~1E),于2018年11月4日收入院。患者发病以来体重下降约7.5 kg,无全身皮肤及巩膜黄染、皮肤瘙痒、恶心呕吐、陶土色大便等症状,脐周轻压痛,余体格检查未见异常。2016年12月11日肠镜检查提示溃疡性结肠炎,规律服用美沙拉秦(每次0.4 g,每天3次)、柳氮磺砒啶(每次0.75 g,每天3次),2018年6月18日复查肠镜未见异常后停药。无饮酒、吸烟史。术前诊断为胰体尾占位(胰腺癌?)、溃疡性结肠炎。经充分术前评估后于2018年11月6日行开腹胰体尾脾脏切除+腹后淋巴结清扫术,术前未行血清IgG4检查。术后病理结果提示慢性胰腺炎、2型自身免疫性胰腺炎(autoimmune pancreatitis,AIP)(图 1F);免疫组织化学染色结果示IgG4(-)、低分子量细胞角蛋白(low molecular weight cytokeratin 5.2,CAM5.2)(+)、IgG(+)。患者术后一般情况尚可,伤口愈合良好,于2018年11月11日出院。
|
图 1 病例1影像学及术后病理检查结果 A:CT平扫见胰腺体尾部稍低密度肿块影(箭头所示);B:CT增强检查见肿块无明显强化,肿块大小约为21 mm×36 mm(箭头所示),胆管系统可见扩张;C:MRI T1加权成像平扫示肿块呈稍低信号(箭头所示);D:MRI T2加权成像平扫见肿块呈稍高信号(箭头所示);E:MRI增强检查示肿块轻度强化(箭头所示);F:胰腺(管)组织苏木精-伊红染色可见以导管为中心的淋巴细胞、浆细胞浸润(白色箭头所示),导管内可见中性粒细胞浸润(黑色箭头所示),导管上皮内可见中性粒细胞浸润(黄色箭头所示)(200×).CT:计算机断层扫描;MRI:磁共振成像. |
病例2,男,49岁,2018年11月11日因“皮肤、巩膜黄染伴小便深黄12 d”就诊于海军军医大学(第二军医大学)第一附属医院。2018年10月31日患者无明显诱因出现皮肤和巩膜黄染、小便深黄,伴有皮肤瘙痒、陶土色大便,无腹痛、恶心呕吐等症状,2018年11月3日至太仓市人民医院就诊,入院当天实验室检查提示总胆红素升高(具体不详),胰腺MRI检查提示胰头占位。为求进一步诊治,于2018年11月11日至海军军医大学(第二军医大学)第一附属医院就诊,以“胰头占位”收入院。发病以来患者体重下降约3 kg。既往患2型糖尿病2年,规律服用二甲双胍(每次0.5 g,每天2次)、格列齐特片(每次80 mg,每天1次),血糖控制稳定;患高血压5年(Ⅲ级,很高危),规律服用苯磺酸氨氯地平片(每次2.5 mg,每天1次),血压控制稳定。吸烟指数500年支,无酗酒史。11月12日查血淀粉酶为54 U/mL,CA19-9为119.6 U/mL;腹部超声检查提示胰头实性占位、肝内外胆管扩张;上腹部CT平扫+增强检查提示胰头部低密度肿块,增强见肿块呈等密度影,大小约为35 mm×26 mm,胆管系统可见扩张(图 2A、2B);上腹部MRI平扫+增强检查提示胰腺癌可能性大(图 2C~2E)。术前诊断:(1)梗阻性黄疸;(2)胰尾占位;(3)2型糖尿病;(4)高血压(Ⅲ级,很高危)。经充分术前评估后,于2018年11月13日行根治性胰十二指肠切除术(Whipple术),术前未进行血清IgG4检查。术后组织病理学检查提示慢性胰腺炎、2型AIP;免疫组织化学染色结果示IgG4(-)、CAM5.2(+)、IgG(+)、P53(-)、Ki-67(淋巴细胞部分+)。患者术后一般情况尚可,伤口愈合良好,于2018年12月16日出院。

|
图 2 病例2影像学检查结果 A:CT平扫可见胰头部低密度肿块(箭头所示);B:CT增强检查见肿块呈等密度影,大小约35 mm×26 mm(箭头所示),胆管系统可见扩张;C:MRI T1加权成像平扫示肿块呈低信号(箭头所示);D:MRI T2加权成像平扫见肿块呈高信号(箭头所示);E:MRI增强检查示肿块轻度强化(箭头所示).CT:计算机断层扫描;MRI:磁共振成像. |
病例3,男,30岁,因“上腹部不适1个月余”于2019年3月5日在海军军医大学(第二军医大学)第一附属医院就诊。2019年2月患者无明显诱因出现上腹部胀痛,无恶心呕吐、皮肤和巩膜黄染、深黄小便、陶土色大便、体重下降等症状,于2019年3月1日至晋中市第一人民医院就诊,行腹部超声检查示胰腺壶腹部及胰头周围实性占位,后腹膜淋巴结肿大,肝内外胆管扩张。为求进一步治疗,于2019年3月5日收入海军军医大学(第二军医大学)第一附属医院治疗。既往患溃疡性结肠炎,具体年限、治疗情况不详;无吸烟、酗酒史。3月6日查血CA19-9为54.89 U/mL,血清IgG4为0.45 g/L(正常参考值为0.08~1.4 g/L);上腹部CT平扫+增强检查提示胰腺壶腹部周围占位伴胆道系统明显扩张,恶性可能性大(图 3A、3B);胰腺MRI平扫+增强检查提示胰腺壶腹部周围癌,十二指肠降部及胰头受侵,胆道系统扩张(图 3C~3E)。术前诊断为胰腺占位、溃疡性结肠炎。经充分术前评估后,于2019年3月19日行根治性胰十二指肠切除术(Whipple术)。术后组织病理学结果提示2型AIP;免疫组织化学染色结果示IgG4(-)、CAM5.2(上皮+)、IgG(+)、细胞角蛋白(cytokeratin,CK)8/18(上皮+)、CD3(部分+)、CD4(较多+)、CD8(较多+)、CD38(浆细胞+)、P53(-)、Ki-67(淋巴细胞少量+)。患者术后一般情况尚可,伤口愈合良好,于2019年3月26日出院。

|
图 3 病例3影像学检查结果 A:CT平扫可见胰腺壶腹部低密度肿块(箭头所示);B:CT增强检查见肿块明显强化,大小约38 mm×26 mm,与胰头及十二指肠降部分界不清(箭头所示),胆管系统明显扩张,胰头周围脂肪组织间隙模糊;C:MRI T1加权成像平扫示肿块呈等信号(箭头所示);D:MRI T2加权成像平扫见肿块呈稍高信号(箭头所示);E:MRI增强检查示肿块轻度强化(箭头所示).CT:计算机断层扫描;MRI:磁共振成像. |
2 讨论
Yoshida等[1]在1995年首次提出AIP的概念,并沿用至今。2010年国际共识会议上正式提出了AIP的分型:1型及2型。AIP的流行病学调查研究显示,1型AIP多见于亚洲地区,目前报道较多;2型AIP多见于欧美地区,但国内外却鲜有文献报道,临床对2型AIP的认识仍然存在很多不足,导致该病经常被漏诊、误诊[2]。以“自身免疫性胰腺炎”为关键词,检索海军军医大学(第二军医大学)第一附属医院2015年1月至2020年1月电子病历资料,仅发现3例经病理确诊的2型AIP患者,术前影像学检查均误诊为胰腺肿瘤,本文对该3例患者的诊治过程进行总结,以引起临床对该病的重视。
2型AIP又称特发性导管中心性胰腺炎,该型发现较晚且病例鲜有报道,目前其发病机制仍不明确,主要组织病理表现为胰管周围淋巴细胞、浆细胞广泛浸润并伴有纤维化,胰管管壁有中性粒细胞浸润偶伴微脓肿形成,免疫组织化学染色少见或没有IgG4阳性浆细胞浸润。Gupta等[3]研究发现,免疫组织化学染色中导管程序性死亡配体1(programmed death-ligand 1,PD-L1)反应性有可能区分2型AIP与其他形式的胰腺炎和胰腺导管腺癌,其灵敏度及特异度分别为70%和99%。本组3例患者免疫组织化学染色示IgG4均为阴性,符合文献报道,但均未行PD-L1检测。
研究表明2型AIP患者平均发病年龄较小,性别分布上尚未见差异,首诊的临床表现以胰腺炎相关症状为主,表现为上腹胀痛、皮肤及巩膜黄染、消瘦、尿色加深、陶土色大便等,但与1型AIP相比梗阻性黄疸相关表现并不突出[4]。此外,研究显示2型AIP很少累及肾脏、唾液腺、腹膜等胰腺外组织器官,但临床上约48%的2型AIP合并炎症性肠病,部分患者也因炎症性肠病相关症状而就诊[5]。Pattabathula等[6]回顾性分析当地经组织学证实的AIP病理数据库,发现2型AIP并发炎症性肠病的比例较1型AIP更高(40% vs 15%,P<0.05),并指出血清IgG4阴性的年轻炎症性肠病患者若合并胰腺炎时需高度怀疑2型AIP。2型AIP尚无特异性的实验室诊断指标,与1型AIP相比,2型AIP血清IgG4升高少见,因此IgG4可作为两者鉴别的重要依据[7]。本组3例患者均为男性,平均年龄为42岁,2例出现腹部不适(腹痛),1例出现全身皮肤及巩膜黄染、小便深黄、陶土色大便,2例出现体重下降,2例合并炎症性肠病,1例患有高血压、糖尿病,3例患者中仅1例入院行血清IgG4检查(为0.45 g/L,未见异常)。
目前尚无高效的影像学检查方式用于诊断2型AIP,近30%的患者有局灶性肿块相关表现,易被误诊为胰腺癌;28%的患者可见弥漫性胰腺肿大,13%的患者胰腺无肿块及低密度灶,抑或为正常/萎缩的胰腺、间质性胰腺炎表现[2, 8]。Sun等[9]的研究在一定程度上为AIP的影像学诊断提供了很大帮助,但在2型AIP与1型AIP、胰腺癌的鉴别诊断方面仍存在很大困难。AIP的影像学表现多样,CT平扫及增强检查可见胰腺实质弥漫性、局限性或局灶性增大并伴有强化延迟。相较于CT,胰腺MRI显示病灶更加清晰、灵敏,主要表现为T1低信号、T2高信号,但30%~40%的AIP患者可见胰腺局部肿物,极易被误诊为胰腺癌,临床上应予以重视[10]。Zhang等[11]对AIP与胰腺癌纤维化程度的差异进行分析发现,AIP在弥散加权成像呈均匀信号,而胰腺癌为高信号。Niu等[12]的一项关于鉴别胰腺肿瘤良恶性的meta分析显示,弥散加权成像鉴别胰腺肿瘤良恶性的灵敏度、特异度分别为91%和86%,但MRI弥散加权成像不是临床常规检查项目,且检查时间较长,尚未作为常规检查应用于AIP的诊断。此外,超声内镜在AIP的诊断中有重要地位,尤其是超声引导下胰腺穿刺活检是目前诊断AIP的重要方法,相较于手术,其具有费用低、创伤小、操作快、患者易接受等优点,对临床上诊断困难的患者意义重大[13]。本组3例患者术前CT平扫见病灶均为低密度,MRI检查为T1低或等信号、T2高信号,增强可见轻度强化,影像学诊断均提示胰腺局部占位、胆道系统扩张,考虑恶性肿瘤可能性大,并均接受手术切除治疗,而术后病理提示2型AIP。本组3例患者均为术前误诊,在经济、生理、心理方面均对患者造成了极大的影响。
综合分析本组3例患者的误诊原因,主要有以下几点:(1)2型AIP临床表现多样,影像学表现缺乏特异性。该病主要因胰腺占位压迫周围组织产生相关临床症状,影像学表现为不典型胰腺占位,极易与胰腺癌混淆。(2)对2型AIP认识不足。因2型AIP少见,临床及影像科医师对该病的临床及影像学特征掌握不够,不能很好地将病例的临床特点与影像学表现结合起来综合分析判断。(3)对国际上2型AIP的研究进展缺乏关注。根据胰腺占位纤维化程度的差异,MRI弥散加权成像可以很好地鉴别占位性病变的良恶性。(4)术前检查缺乏多样性。在对胰腺占位诊断存疑的情况下,没有考虑行超声引导下细针穿刺活检等检查,从而加重了患者的经济、生理、心理负担。(5)缺乏科室间协作。胰腺占位种类繁多,临床医师常注重病例的临床特点而忽略影像学表现,影像科医师常关注病例的影像学表现而忽略临床特点,导致病例信息缺失,最终误诊、漏诊。(6)缺乏误诊病例总结。无论是临床科室还是影像科的医师,均应及时对术前、术后诊断不一致的病例进行回顾总结,或许可以最大限度地避免再次误诊、漏诊。
综上所述,2型AIP病例罕见,加之其临床表现、影像学、血清学等检查缺乏特异性,极易与胰腺恶性肿瘤混淆,并且其需要通过组织病理学检查才能确诊,临床漏诊、误诊率较高。结合文献报道,2型AIP相较于胰腺恶性肿瘤有以下特点:(1)血清IgG4阴性的年轻炎症性肠病患者若合并胰腺炎,应高度怀疑2型AIP;(2)与胰腺恶性肿瘤相比,2型AIP患者肿瘤标志物无明显升高;(3)MRI弥散加权成像见病灶呈均匀信号,应高度怀疑2型AIP,若为高信号则怀疑胰腺恶性肿瘤。如果临床上遇到类似的患者,应充分了解患者病史(是否患有炎症性肠病等)、血液学检查结果(血清IgG4、CA19-9水平),并结合MRI弥散加权成像等影像学检查结果,以及时做出2型AIP诊断,避免临床误诊、诊治。
| [1] |
YOSHIDA K, TOKI F, TAKEUCHI T, WATANABE S, SHIRATORI K, HAYASHI N. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis[J]. Dig Dis Sci, 1995, 40: 1561-1568. DOI:10.1007/BF02285209 |
| [2] |
MAJUMDER S, TAKAHASHI N, CHARI S T. Autoimmune pancreatitis[J]. Dig Dis Sci, 2017, 62: 1762-1769. DOI:10.1007/s10620-017-4541-y |
| [3] |
GUPTA R, NEYAZ A, CHOUGULE A, AKITA M, ZEN Y, FORCIONE D, et al. Autoimmune pancreatitis type 2: diagnostic utility of PD-L1 immunohistochemistry[J]. Am J Surg Pathol, 2019, 43: 898-906. DOI:10.1097/PAS.0000000000001282 |
| [4] |
ZEN Y. Type 2 autoimmune pancreatitis: consensus and controversies[J]. Gut Liver, 2022, 16: 357-365. DOI:10.5009/gnl210241 |
| [5] |
OH D, SONG T J, MOON S H, KIM J H, LEE N J, HONG S M, et al. Type 2 autoimmune pancreatitis (idiopathic duct-centric pancreatitis) highlighting patients presenting as clinical acute pancreatitis: a single-center experience[J]. Gut Liver, 2019, 13: 461-470. DOI:10.5009/gnl18429 |
| [6] |
PATTABATHULA K, WATERS P S, HWANG J, BETTINGTON M, SINGH M, BRYANT R D, et al. Diagnostic and therapeutic considerations in biopsy-proven type 2 autoimmune pancreatitis: comparative analysis with biopsy-proven type 1 autoimmune pancreatitis[J]. ANZ J Surg, 2021, 91: 907-914. DOI:10.1111/ans.16445 |
| [7] |
ESTRADA P, PFAU P. Diagnosing autoimmune pancreatitis: choosing your weapon[J]. Gastrointest Endosc, 2020, 91: 382-384. DOI:10.1016/j.gie.2019.11.037 |
| [8] |
DESAI G, PANDE P, TAMPI C, WAGLE P. Autoimmune pancreatitis type Ⅱ: first report from India[J]. J Clin Diagn Res, 2017, 11: PD17-PD18. |
| [9] |
SUN G F, ZUO C J, SHAO C W, WANG J H, ZHANG J. Focal autoimmune pancreatitis: radiological characteristics help to distinguish from pancreatic cancer[J]. World J Gastroenterol, 2013, 19: 3634-3641. DOI:10.3748/wjg.v19.i23.3634 |
| [10] |
KETWAROO G A, SHETH S. Autoimmune pancreatitis[J]. Gastroenterol Rep (Oxf), 2013, 1: 27-32. DOI:10.1093/gastro/got011 |
| [11] |
ZHANG T T, WANG L, LIU H H, ZHANG C Y, LI X M, LU J P, et al. Differentiation of pancreatic carcinoma and mass-forming focal pancreatitis: qualitative and quantitative assessment by dynamic contrast-enhanced MRI combined with diffusion-weighted imaging[J]. Oncotarget, 2017, 8: 1744-1759. DOI:10.18632/oncotarget.12120 |
| [12] |
NIU X K, BHETUWAL A, DAS S, XIAO Y Q, SUN F, ZENG L C, et al. Meta-analysis of quantitative diffusion-weighted MR imaging in differentiating benign and malignant pancreatic masses[J]. J Huazhong Univ Sci Technol[Med Sci], 2014, 34: 950-956. DOI:10.1007/s11596-014-1379-9 |
| [13] |
ISHIKAWA T, KAWASHIMA H, OHNO E, TANAKA H, MAEDA K, SAWADA T, et al. Usefulness of endoscopic ultrasound elastography combined with the strain ratio in the estimation of treatment effect in autoimmune pancreatitis[J/OL]. Pancreas, 2020, 49: e21-e22. DOI: 10.1097/MPA.0000000000001481.
|
 2022, Vol. 43
2022, Vol. 43


