2. 深圳市人民医院(暨南大学第二临床医学院、南方科技大学第一附属医院)风湿免疫科,深圳 518020
2. Department of Rheumatology and Immunology, Shenzhen People's Hospital (2nd Clinical Medical College of Jinan University, 1st Affiliated Hospital of Southern University of Science and Technology), Shenzhen 518020, Guangdong, China
衰老几乎存在于所有生物中,是从生殖成熟期开始或加速的一种持续的、不可逆的退行性改变,机体衰老的特征包括生育力下降、对疾病和组织功能障碍的易感性增加及死亡风险升高[1]。关于衰老的原因和方式有许多理论假说,如程序衰老理论、氧化应激损伤理论等,但目前衰老的定义仍不能确定。研究显示衰老的特点是生物学特征如代谢、炎症反应等发生了变化[2]。如何将细胞和组织衰老的原因与伴随的无数变化进行区分是研究衰老的主要挑战之一,例如,是衰老导致了脂质代谢异常,还是脂质代谢异常加速了衰老[3];是自身免疫性机制加速了炎症性衰老[4],还是衰老促进了炎症反应[5]。根据已有的大量基础研究结果,在大多数情况下是代谢-炎症与衰老存在相互作用关系,但是目前相关研究尚缺乏临床验证。已有研究证实胰岛素抵抗是各种老年相关性疾病的共同机制[6-8],在生物衰老的进程中是否存在糖化血红蛋白(glycosylated hemoglobin,GHb)水平的变化?衰老的进程伴随着代谢-炎症状态的变化,而瘦素(leptin)参与机体代谢和炎症的调节[9],那么在健康人衰老的进程中年龄是否与瘦素水平存在相关性?
本研究基于衰老领域中BMI、瘦素的研究结论,在健康成年女性人群中验证BMI、瘦素与临床生物化学指标的相关性,并探讨炎症因子TNF-α、γ干扰素等与代谢-衰老指标的关系,为挖掘临床可及的衰老程度评估指标提供依据。
1 对象和方法 1.1 研究对象连续选择2021年3-4月于深圳市人民医院健康管理中心进行全面健康体检的100名成年女性。纳入标准:(1)年龄为18~60岁;(2)无心脑血管疾病、糖尿病、癌症等明确诊断的疾病;(3)无急性感染,如活动性乙型肝炎、结核病、艾滋病;(4)无子宫肌瘤、近期手术史、厌食症等可能引起贫血、营养不良或影响临床生物化学检查结果的疾病。排除标准:(1)有精神病史,患有社会认知障碍;(2)近2个月服用过降脂、降血压、降血糖等可能影响临床检查结果的药物;(3)有假肢或脊柱、关节手术史等可能影响身高测量者;(4)正在接受药物或其他方式进行减重或增加体重者。共38名符合条件者纳入研究,本研究通过深圳市人民医院伦理委员会审批(LL-KY-2022068),研究对象均签署知情同意书。
1.2 一般资料采集对所有研究对象于健康体检当天询问病史,记录年龄、月经史和既往史等,测量收缩压、舒张压、身高、体重并计算BMI。
1.3 生物化学指标检测结果收集于健康体检当日上午空腹,通过肘前静脉采集外周血2 mL于EDTA二钾抗凝管,采用TEK8520型血细胞分析仪(江西特康科技有限公司)检测血红蛋白。采集外周血约3 mL于促凝管(添加剂为分离胶-促凝剂),采用Cobas702型全自动生化检测仪(美国Roche公司)检测血清白蛋白、球蛋白(总蛋白与白蛋白的差值)、血糖、GHb、总胆固醇、甘油三酯、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和尿酸等。采集外周血3 mL于促凝管,采用MAGLUMI 4000型化学发光免疫分析仪(深圳市新产业生物医学工程有限公司)检测肿瘤标志物癌胚抗原、糖类抗原(carbohydrate antigen,CA)153、CA19-9、CA242、甲胎蛋白、神经元特异性烯醇化酶(neuron-specific enolase,NSE)。
1.4 细胞因子的检测采集外周血3 mL于EDTA二钾抗凝管,4 ℃ 2 000×g离心8 min取血浆。采用人脂肪因子磁珠面板检测试剂盒(货号HADK2MAG-61K,美国Millipore公司),通过MILLIPLEX® MAGPI多因子检测平台测定瘦素、γ干扰素和TNF-α,操作步骤严格按照试剂盒说明书进行。使用MILLIPLEX Analyst 5.1软件,通过5参数法拟合标曲法[10]对检测结果进行定量分析。
1.5 统计学处理38人中4人BMI数据缺失,对缺失值不处理。应用GraphPad Prism 8.0.1软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验。采用Pearson或Spearman相关分析进行相关性分析。检验水准(α)为0.05。
2 结果 2.1 (围)绝经期健康女性临床指标变化共纳入38名健康成年女性,年龄为23~58岁。育龄期(<45岁且停经不超过12个月)女性22名,围绝经期及绝经期(≥45岁或停经12个月后)女性16名。(围)绝经期女性BMI及ALT、血糖、GHb、总胆固醇、甘油三酯、LDL-C、甲胎蛋白、瘦素、γ干扰素水平均高于育龄期女性(P均<0.05)。(围)绝经期女性收缩压、舒张压略高于育龄期女性但差异无统计学意义(P均>0.05)。见表 1。
|
|
表 1 (围)绝经期与育龄期健康女性临床指标比较 Tab 1 Comparison of clinical indexes between (peri)menopausal and childbearing age healthy women |
2.2 年龄与血清白蛋白水平的相关性
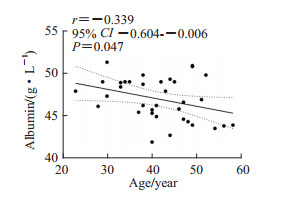
健康成年女性中,年龄与血清白蛋白水平呈负相关(r=-0.339,P<0.05;图 1),而与球蛋白水平无相关性(r=0.085,P>0.05)。
|
图 1 健康成年女性年龄与血清白蛋白水平的Pearson相关分析 Fig 1 Pearson correlation analysis of age and serum albumin levels in healthy adult women CI: Confidence interval. |
2.3 年龄与血糖、BMI、血脂、肿瘤标志物的相关性
健康成年女性年龄与血糖、HDL-C、甘油三酯水平无相关性(r=0.214、-0.203,rs=0.379,P均>0.05),但是随着年龄增长GHb、BMI、总胆固醇、LDL-C均逐渐升高(r=0.364、r=0.378、rs=0.540、r=0.559,P均<0.05;图 2A~2D)。健康成年女性中,年龄与甲胎蛋白水平呈正相关(r=0.451,P<0.05;图 2E),与其余肿瘤标志物如癌胚抗原、CA153、CA19-9、CA242及NSE水平均无相关性(r=0.315、-0.241、0.015、-0.193、0.169,P均>0.05)。

|
图 2 健康成年女性年龄与血糖、BMI、血脂、AFP的相关性分析 Fig 2 Correlation analysis of age with blood glucose, BMI, blood lipids and AFP in healthy adult women A-E: The correlation analysis of age with GHb, BMI, TC, LDL-C, and AFP, respectively. A, B, D, E: Pearson correlation analysis; C: Spearman correlation analysis. BMI: Body mass index; AFP: α-fetoprotein; GHb: Glycosylated hemoglobin; TC: Total cholesterol; LDL-C: Low density lipoprotein-cholesterol; CI: Confidence interval. |
2.4 BMI与血压、血生物化学指标的相关性
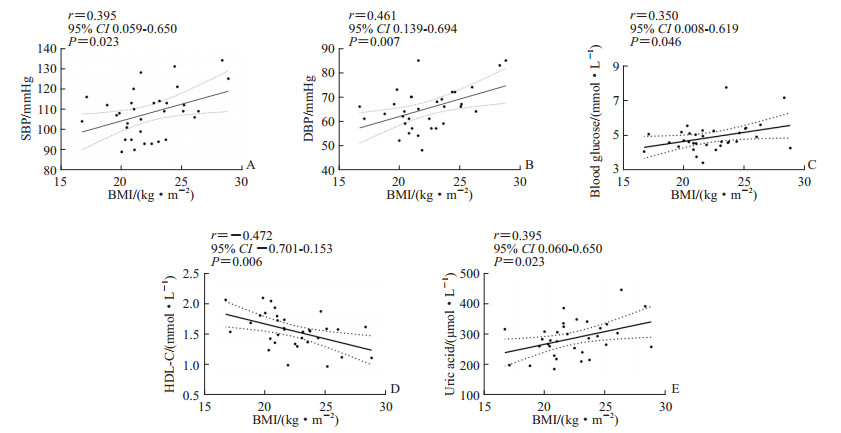
健康成年女性中,BMI与收缩压、舒张压均呈正相关(r=0.395、0.461,P均<0.05;图 3A、3B),与血糖水平呈正相关(r=0.350,P=0.046;图 3C)。随着BMI增加总胆固醇、甘油三酯、LDL-C、ALT水平无显著性变化(rs=0.195、rs=0.197、r=0.305、rs=0.372,P均>0.05),而BMI与HDL-C水平呈负相关(r=-0.472,P=0.006;图 3D)。BMI与血尿酸水平呈正相关(r=0.395,P=0.023;图 3E)。
|
图 3 健康成年女性BMI与血压、血生物化学指标的Pearson相关分析 Fig 3 Pearson correlation analysis of BMI and blood pressure and blood biochemical indexes in healthy adult women A-E: The correlation analysis of BMI with SBP, DBP, blood glucose, HDL-C, and uric acid, respectively. 1 mmHg=0.133 kPa. BMI: Body mass index; SBP: Systolic blood pressure; DBP: Diastolic blood pressure; HDL-C: High density lipoprotein-cholesterol; CI: Confidence interval. |
2.5 血浆瘦素与年龄、BMI、血压的相关性
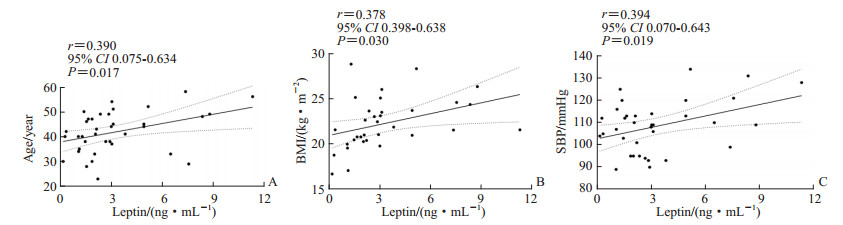
健康成年女性中,随着年龄的增长,血浆瘦素水平呈上升趋势(r=0.390,P=0.017;图 4A);血浆瘦素水平与BMI、收缩压均呈正相关(r=0.378、0.394,P均<0.05;图 4B、4C)。
|
图 4 健康成年女性血浆瘦素与年龄(A)、BMI(B)、SBP(C)的Pearson相关分析 Fig 4 Pearson correlation analysis of plasma leptin with age (A), BMI (B) and SBP (C) in healthy adult women 1 mmHg=0.133 kPa. BMI: Body mass index; SBP: Systolic blood pressure; CI: Confidence interval. |
2.6 血浆瘦素与血生物化学指标的相关性
健康成年女性中,血浆瘦素水平与血糖、GHb水平无相关性(r=0.213、0.053,P均>0.05)。血浆瘦素水平与总胆固醇、LDL-C、甘油三酯、血尿酸水平均呈正相关(rs=0.412、r=0.355、rs=0.567、r=0.518,P均<0.05;图 5A~5D)。血浆瘦素水平与ALT水平呈正相关(rs=0.372,P=0.025;图 5E)。

|
图 5 健康成年女性血浆瘦素与血生物化学指标的相关性分析 Fig 5 Correlation analysis of plasma leptin and blood biochemical indexes in healthy adult women A-E: The correlation analysis of leptin with TC, LDL-C, triglyceride, uric acid, and ALT, respectively. A, C, E: Spearman correlation analysis; B, D: Pearson correlation analysis. TC: Total cholesterol; LDL-C: Low density lipoprotein-cholesterol; ALT: Alanine aminotransferase; AST: Aspartate aminotransferase; CI: Confidence interval. |
2.7 血浆瘦素与TNF-α水平的相关性
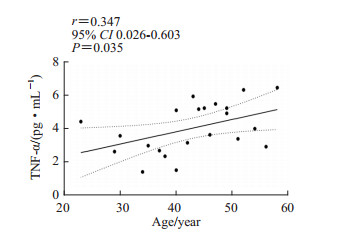
健康成年女性中,血浆瘦素水平与炎症因子TNF-α水平呈正相关(r=0.347,P=0.035;图 6)。
|
图 6 健康成年女性血浆瘦素与TNF-α的Pearson相关分析 Fig 6 Pearson correlation analysis of plasma leptin and TNF-α in healthy adult women TNF-α: Tumor necrosis factor α; CI: Confidence interval. |
3 讨论
衰老是机体功能逐渐下降、损害而导致个体适应性、生理和心理功能下降的复杂过程[11]。代谢在衰老的调节机制中发挥着重要作用,代谢重编程是衰老的主要驱动力,其导致机体出现健康受损、疾病易感性增高、应激反应能力降低及虚弱程度增加等衰老表现[12]。研究发现,人类的脂质谱随着年龄的增长而发生变化[13],脂质代谢对于机体适应外环境及繁殖至关重要,亲脂性分子(如游离脂肪酸)、类固醇和复合脂质(如甘油三酯和磷脂)等在衰老中发挥着重要作用。因性别对临床生物化学检查、预期寿命的影响显著[14],且最近有仅在男性患者中分析瘦素与衰老关系的研究[15],本研究考虑仅选择女性人群以排除性别带来的偏倚。在本研究中,年龄相对较大的(围)绝经期女性BMI、血糖及GHb均高于育龄期女性,血脂包括总胆固醇、甘油三酯、LDL-C的水平亦在(围)绝经期女性中显著升高。虽然炎症是机体正常的愈合、修复反应,但当炎症加重并持续存在时即会具有破坏性,慢性、低度炎症被认为是促进和加速衰老的机制之一,称为炎症性衰老[16]。
本研究在健康成年女性人群中验证了炎症与衰老-代谢的相关性。结果显示随着年龄的增长,血清白蛋白水平呈下降趋势。白蛋白不仅发挥着维持血浆胶体渗透压的基本作用,还整合了机体的炎症和营养状态等信息[17]。由于健康机体对血糖水平具有较高的保守性,在本研究严格筛选的健康女性人群中年龄与血糖水平未见显著相关性,但随着年龄的增长GHb水平上升。中国台湾一项大样本前瞻性队列研究(平均随访5.3年)结果显示,GHb水平与身体机能下降相关,GHb水平较高的人群衰老程度较高[18]。本研究结果显示,年龄与BMI和总胆固醇、LDL-C水平呈正相关,甘油三酯亦随年龄增长呈上升趋势,但由于样本量较小差异无统计学意义。虽然年龄与BMI及血脂不存在必然的因果关系,但研究显示随着年龄的增长,人群肥胖及血脂异常的发生率升高,肥胖可通过对代谢途径的影响促进衰老[19]。HDL-C是血管保护因子,与心脑血管疾病的发生风险存在负相关关系[20],本研究中虽然HDL-C水平与年龄未见显著相关性,但其与BMI呈负相关。尿酸是嘌呤代谢的最终氧化产物,目前研究认为尿酸升高与高血压及糖尿病等老年相关疾病的发生密切相关[21-22],本研究结果显示伴随BMI的增大,血尿酸水平逐渐升高。
甲胎蛋白属于白蛋白家族的一种糖蛋白,主要由胎儿肝细胞及卵黄囊合成,在胎儿血液循环中有较高的浓度,出生后逐渐被白蛋白替代,故在成人血清中其含量极低。目前对甲胎蛋白的研究主要是将其作为肝癌等多种肿瘤的标志物,但有研究显示在衰老小鼠中甲胎蛋白高表达[23]。本研究结果显示,甲胎蛋白水平在(围)绝经期女性人群中升高,且与年龄呈正相关,可见甲胎蛋白或许能作为衰老的评估指标。
本研究结果显示在健康女性人群中,血浆瘦素水平与年龄、BMI呈正相关。自从瘦素作为脂肪细胞衍生的饱腹因子被发现以来,脂肪组织不再被认为仅是简单的能量储存部位,还是一种活跃的内分泌和旁分泌器官,可分泌多种介质(称为脂肪因子)。研究表明,脂肪细胞通过多种脂肪因子与其他器官交流,并参与包括心血管功能等在内的多种代谢过程[23]。瘦素作为一种蛋白质激素,通过体内广泛分布的受体在调节食物摄入、血压等生理过程中发挥作用。本研究中,瘦素水平与血压及血脂(总胆固醇、LDL-C、甘油三酯)水平呈正相关,亦与血尿酸水平表现出正相关关系。这与在中年男性人群中的研究结果[24]一致。本研究还发现伴随血浆瘦素水平的升高,ALT水平升高,这可能与肝脏脂肪变性导致肝功能损害有关。瘦素不仅参与代谢调节,还参与炎症反应[25],在本研究中血浆瘦素水平与TNF-α水平呈正相关,这一结果验证了炎症在代谢与衰老中的相互影响学说。
本研究分析了健康成年女性人群BMI、血浆瘦素水平与血压及血脂、血糖等生物化学指标的相关性,结果显示随着年龄的增长,血清白蛋白水平下降,BMI及GHb、血脂、瘦素、甲胎蛋白水平均升高;伴随BMI、瘦素水平的增加,机体血压、血尿酸呈上升趋势,且瘦素水平与炎症因子TNF-α水平呈正相关。本研究结果表明在健康成年女性人群中,随着年龄增长、BMI增加,机体代谢、炎症水平发生了变化,这可为临床评估代谢-炎症性衰老提供可靠指标及依据。
| [1] |
RANDO T A, CHANG H Y. Aging, rejuvenation, and epigenetic reprogramming: resetting the aging clock[J]. Cell, 2012, 148: 46-57. DOI:10.1016/j.cell.2012.01.003 |
| [2] |
DA COSTA J P, VITORINO R, SILVA G M, VOGEL C, DUARTE A C, ROCHA-SANTOS T. A synopsis on aging—theories, mechanisms and future prospects[J]. Ageing Res Rev, 2016, 29: 90-112. DOI:10.1016/j.arr.2016.06.005 |
| [3] |
LIU H H, LI J J. Aging and dyslipidemia: a review of potential mechanisms[J]. Ageing Res Rev, 2015, 19: 43-52. DOI:10.1016/j.arr.2014.12.001 |
| [4] |
宣亚男, 陈艳娟, 赵文婷, 陈晓玲, 万丽娟, 王谨, 等. 自身免疫性疾病与衰老[J]. 中华老年医学杂志, 2021, 40: 663-667. DOI:10.3760/cma.j.issn.0254-9026.2021.05.026 |
| [5] |
FÜLÖP T, DUPUIS G, WITKOWSKI J M, LARBI A. The role of immunosenescence in the development of age-related diseases[J]. Rev Invest Clin, 2016, 68: 84-91. |
| [6] |
CRAFT S. Insulin resistance syndrome and Alzheimer's disease: age- and obesity-related effects on memory, amyloid, and inflammation[J]. Neurobiol Aging, 2005, 26(Suppl 1): 65-69. |
| [7] |
SAGUN G, GEDIK C, EKIZ E, KARAGOZ E, TAKIR M, OGUZ A. The relation between insulin resistance and lung function: a cross sectional study[J/OL]. BMC Pulm Med, 2015, 15: 139. DOI: 10.1186/s12890-015-0125-9.
|
| [8] |
ARGIRION I, WEINSTEIN S J, MÄNNISTÖ S, ALBANES D, MONDUL A M. Serum insulin, glucose, indices of insulin resistance, and risk of lung cancer[J]. Cancer Epidemiol Biomarkers Prev, 2017, 26: 1519-1524. DOI:10.1158/1055-9965.EPI-17-0293 |
| [9] |
GULCELIK N E, HALIL M, ARIOGUL S, USMAN A. Adipocytokines and aging: adiponectin and leptin[J]. Minerva Endocrinol, 2013, 38: 203-210. |
| [10] |
GOTTSCHALK P G, DUNN J R. The five-parameter logistic: a characterization and comparison with the four-parameter logistic[J]. Anal Biochem, 2005, 343: 54-65. DOI:10.1016/j.ab.2005.04.035 |
| [11] |
KHALTOURINA D, MATVEYEV Y, ALEKSEEV A, CORTESE F, IOVIŢĂ A. Aging fits the disease criteria of the international classification of diseases[J/OL]. Mech Ageing Dev, 2020, 189: 111230. DOI: 10.1016/j.mad.2020.111230.
|
| [12] |
PARKHITKO A A, FILINE E, MOHR S E, MOSKALEV A, PERRIMON N. Targeting metabolic pathways for extension of lifespan and healthspan across multiple species[J/OL]. Ageing Res Rev, 2020, 64: 101188. DOI: 10.1016/j.arr.2020.101188.
|
| [13] |
PAPSDORF K, BRUNET A. Linking lipid metabolism to chromatin regulation in aging[J]. Trends Cell Biol, 2019, 29: 97-116. DOI:10.1016/j.tcb.2018.09.004 |
| [14] |
LULKIEWICZ M, BAJSERT J, KOPCZYNSKI P, BARCZAK W, RUBIS B. Telomere length: how the length makes a difference[J]. Mol Biol Rep, 2020, 47: 7181-7188. DOI:10.1007/s11033-020-05551-y |
| [15] |
D'ELIA L, GIAQUINTO A, CAPPUCCIO F P, IACONE R, RUSSO O, STRAZZULLO P, et al. Circulating leptin is associated with serum uric acid level and its tubular reabsorption in a sample of adult middle-aged men[J]. J Endocrinol Invest, 2020, 43: 587-593. DOI:10.1007/s40618-019-01140-4 |
| [16] |
FRANCESCHI C, GARAGNANI P, PARINI P, GIULIANI C, SANTORO A. Inflammaging: a new immune-metabolic viewpoint for age-related diseases[J]. Nat Rev Endocrinol, 2018, 14: 576-590. DOI:10.1038/s41574-018-0059-4 |
| [17] |
陈永, 宣亚男, 陈艳娟, 李凯琴, 毕亚男, 陈恩生, 等. 白蛋白/球蛋白与类风湿性关节炎患者的DAS28和ESR的相关性[J]. 暨南大学学报(自然科学与医学版), 2019, 40: 373-382. |
| [18] |
BELTRAN DEL RIO M, TIWARI M, AMODU L I, CAGLIANI J, RODRIGUEZ RILO H L. Glycated hemoglobin, plasma glucose, and erythrocyte aging[J]. J Diabetes Sci Technol, 2016, 10: 1303-1307. DOI:10.1177/1932296816659885 |
| [19] |
BENTLEY R A, ROSS C N, O'BRIEN M J. Obesity, metabolism, and aging: a multiscalar approach[J]. Prog Mol Biol Transl Sci, 2018, 155: 25-42. |
| [20] |
YU Y, HU L, HUANG X, ZHOU W, BAO H, CHENG X. BMI modifies the association between serum HDL cholesterol and stroke in a hypertensive population without atrial fibrillation[J]. J Endocrinol Invest, 2021, 44: 173-181. DOI:10.1007/s40618-020-01288-4 |
| [21] |
SANCHEZ-LOZADA L G, RODRIGUEZ-ITURBE B, KELLEY E E, NAKAGAWA T, MADERO M, FEIG D I, et al. Uric acid and hypertension: an update with recommendations[J]. Am J Hypertens, 2020, 33: 583-594. DOI:10.1093/ajh/hpaa044 |
| [22] |
MORTADA I. Hyperuricemia, type 2 diabetes mellitus, and hypertension: an emerging association[J/OL]. Curr Hypertens Rep, 2017, 19: 69. DOI: 10.1007/s11906-017-0770-x.
|
| [23] |
GUO S J, QI C H, ZHOU W X, ZHANG Y X, ZHANG X M, WANG J, et al. Proteomic data show an increase in autoantibodies and alpha-fetoprotein and a decrease in apolipoprotein A-Ⅱ with time in sera from senescence-accelerated mice[J]. Revista Brasileira De Pesquisas Med E Biol, 2013, 46: 417-425. |
| [24] |
XIE D, BOLLAG W B. Obesity, hypertension and aldosterone: is leptin the link?[J]. J Endocrinol, 2016, 230: F7-F11. DOI:10.1530/JOE-16-0160 |
| [25] |
ABELLA V, SCOTECE M, CONDE J, PINO J, GONZALEZ-GAY M A, GÓMEZ-REINO J J, et al. Leptin in the interplay of inflammation, metabolism and immune system disorders[J]. Nat Rev Rheumatol, 2017, 13: 100-109. DOI:10.1038/nrrheum.2016.209 |
 2022, Vol. 43
2022, Vol. 43


