特应性皮炎(atopic dermatitis,AD)是一种常见的炎症性皮肤病,其特征是反复出现湿疹样病变和剧烈瘙痒,该病可发生在所有年龄和种族的人群,对患者及其家庭造成了巨大的心理及经济负担[1]。WHO数据显示,全世界有至少2.3亿人患有AD,儿童AD患病率为15%~25%[2]。雷西莫特是咪唑喹啉类免疫应答调节剂,可促进γ干扰素和IL-12的产生、减少IL-4和IL-5的生成,从而促进辅助性T细胞(helper T cell,Th)1反应和抑制Th2反应,同时降低健康人、变应性鼻炎及AD人群的IgE水平[3]。因此,科研人员尝试将雷西莫特应用于变应性疾病,目前已有相关动物实验开展[4]。本研究通过对AD模型小鼠腹腔注射雷西莫特,观察其对AD的治疗效果,并探讨可能的作用机制。
1 材料和方法 1.1 主要试剂与设备卡泊三醇搽剂(丹麦利奥制药有限公司,批号H20150664)。小鼠IgE、IL-4、IL-13 ELISA检测试剂盒(武汉伊莱瑞特生物科技股份有限公司),TRIzol试剂(美国Invitrogen公司)。酶标检测仪(美国Bio-Tek公司),荧光定量PCR仪(美国Applied Biosystems公司)。
1.2 实验动物6~8周龄雌性BALB/c小鼠(SPF级)30只,体重18~20 g,购自北京维通利华实验动物有限公司[实验动物生产许可证号为SCXK(京)2018-0013],饲养于海军军医大学(第二军医大学)第一附属医院动物实验中心[实验动物使用许可证号为SYXK(沪)2020-0033]。
1.3 动物分组及处理将30只小鼠随机分为空白组、模型组、治疗组,每组10只。模型组及治疗组小鼠耳部连续14 d涂抹卡泊三醇搽剂(每天2 nmol卡泊三醇)诱导AD模型,模型组同时予200 µL PBS每天腹腔注射、治疗组予50 nmol雷西莫特(溶于200 µL PBS)每天腹腔注射[4];空白组小鼠不给予任何处理。
1.4 观察指标 1.4.1 耳部皮损情况实验第15天观察各组小鼠的耳部皮损红斑、肿胀及鳞屑情况,同时用游标卡尺测量小鼠耳厚度。
1.4.2 耳部组织病理学检查实验第15天,经眼眶取血后以颈椎脱臼法处死小鼠,沿耳根部剪下鼠耳。将取下的鼠耳纵向一分为二,一半放入组织固定液中固定并经石蜡包埋后切片,通过H-E染色观察真皮炎症细胞浸润情况,通过甲苯胺蓝染色观察肥大细胞分布情况;另一半放入-80 ℃冰箱备用。
1.4.3 ELISA检测血清IgE、IL-4、IL-13水平实验第15天,将采集的血液于室温静置2 h,4 ℃ 3 996×g离心15 min,取血清分管冻存于-80 ℃冰箱中备用。按照相关试剂盒说明书进行血清IgE、IL-4、IL-13检测。
1.4.4 qPCR检测耳部皮损组织中胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)、γ干扰素mRNA表达取-80 ℃冻存的小鼠耳部皮损组织,在液氮中剪切及研磨,采用TRIzol法提取总RNA,使用Nanodrop 2000超微量分光光度计(美国ThermoFisher Scientific公司)检测RNA浓度及纯度。通过反转录合成cDNA第一链,以该链为模板、GAPDH为内参照进行PCR扩增。PCR反应条件:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃ 7 min。采用2-ΔΔCt法计算目的基因相对表达量。GAPDH上游引物序列为5'-CCTCGTCCCGTAGACAAAATG-3',下游引物序列为5'-TGAGGTCAATGAAGGGGTCGT-3';TSLP上游引物序列为5'-AGAGAAGCCCTCAATG-ACCAC-3',下游引物序列为5'-TGAGGTTTGAT-TCAGGCAGATGT-3';γ干扰素上游引物序列为5'-CTCAAGTGGCATAGATGTGGAAG-3',下游引物序列为5'-TGACCTCAAACTTGGCAA-TACTC-3'。所有引物均由上海擎熙生物科技有限公司合成。
1.5 统计学处理应用GraphPad Prism 8软件进行数据分析。呈正态分布的计量资料以x±s表示,任意两组间资料的比较采用独立样本t检验。检验水准(α)为0.05。
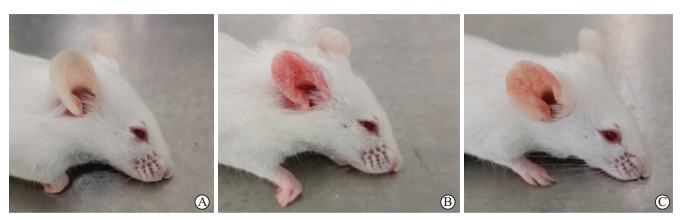
2 结果 2.1 各组小鼠耳部皮损大体情况空白组小鼠耳部皮肤未见异常(图 1A);模型组小鼠耳部皮肤明显肿胀发红、毛细血管扩张,其上附有细小的鳞屑(图 1B);与模型组相比,治疗组小鼠耳部皮肤红肿、鳞屑明显缓解,有轻度毛细血管扩张(图 1C)。模型组小鼠耳厚度为(0.48±0.02)mm,与空白组[(0.19±0.01)mm]相比增厚(P<0.01);治疗组小鼠耳厚度[(0.35±0.02)mm]较模型组变薄(P<0.01)。
|
图 1 各组小鼠实验第15天时耳部皮损情况 Fig 1 Ear skin lesions of mice in each group on the 15th day of experiment A: Blank group; B: Model group (treament with 2 nmol calcipotriol liniment on the ear daily for 14 d); C: Treatment group (treatment with 2 nmol calcipotriol liniment on the ear and intraperitoneal injection of 50 nmol resiquimod daily for 14 d). |
2.2 各组小鼠耳部组织病理学变化
H-E染色可见空白组小鼠耳部组织表皮、真皮结构正常,真皮内散在少量组织细胞,未见明显炎症细胞浸润(图 2A);模型组小鼠表皮角化过度、角化不全,棘层明显增厚,皮突延长,棘细胞间水肿,真皮全层见大量炎症细胞浸润,并可见毛细血管扩张充血(图 2B);治疗组小鼠表皮角化、棘层增厚较模型组明显缓解,未见棘细胞间水肿,真皮内可见淋巴细胞及组织细胞,淋巴细胞分布数量减少(图 2C)。甲苯胺蓝染色可见空白组小鼠真皮内散在少量肥大细胞(图 3A),模型组真皮内肥大细胞明显增多(图 3B),治疗组小鼠真皮内肥大细胞较模型组明显减少(图 3C)。

|
图 2 苏木精-伊红染色观察各组小鼠耳部组织病理学变化(400×) Fig 2 Histopathological changes of ears of mice in each group observed by hematoxylin-eosin staining (400×) A: Blank group; B: Model group (treament with 2 nmol calcipotriol liniment on the ear daily for 14 d); C: Treatment group (treatment with 2 nmol calcipotriol liniment on the ear and intraperitoneal injection of 50 nmol resiquimod daily for 14 d). |

|
图 3 甲苯胺蓝染色观察各组小鼠耳部组织病理学变化(400×) Fig 3 Histopathological changes of the ears of mice in each group observed by toluidine blue staining (400×) A: Blank group; B: Model group (treament with 2 nmol calcipotriol liniment on the ear daily for 14 d); C: Treatment group (treatment with 2 nmol calcipotriol liniment on the ear and intraperitoneal injection of 50 nmol resiquimod daily for 14 d). |
2.3 各组小鼠血清IgE、IL-4、IL-13水平
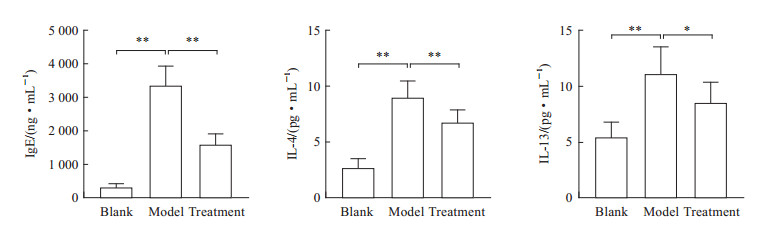
ELISA检测结果(图 4)显示,与空白组相比,模型组小鼠血清中IgE、IL-4、IL-13水平均升高(P均<0.01),说明小鼠AD模型构建成功。与模型组相比,治疗组小鼠血清IgE、IL-4、IL-13水平均下降,差异均有统计学意义(P均<0.05)。
|
图 4 各组小鼠血清IgE、IL-4、IL-13水平检测结果 Fig 4 Levels of serum IgE, IL-4 and IL-13 of mice in each group Model group: The mice were treated with 2 nmol calcipotriol liniment on the ear daily for 14 d; Treatment group: The mice treated with 2 nmol calcipotriol liniment on the ear and intraperitoneal injection of 50 nmol resiquimod daily for 14 d. *P < 0.05, **P < 0.01. n=10, x±s. IgE: Immunoglobulin E; IL: Interleukin. |
2.4 各组小鼠耳部组织中TSLP、γ干扰素mRNA表达
qPCR检测结果显示,模型组小鼠耳部组织中TSLP mRNA表达量(0.97±0.24)较空白组(0.34±0.09)升高(P<0.01),治疗组TSLP mRNA表达量(0.80±0.17)与模型组比较差异无统计学意义(P>0.05)。模型组小鼠耳部组织中γ干扰素mRNA表达量(0.81±0.48)与空白组(1.05±0.08)相比差异无统计学意义(P>0.05),但治疗组γ干扰素mRNA表达量(1.20±0.14)较模型组升高(P<0.05)。
3 讨论AD的病因复杂,包括遗传、免疫和环境等因素,其中皮肤屏障功能异常和免疫功能障碍被认为是AD发病机制的关键。免疫功能障碍相关的发病机制包括血清IgE水平升高、Th1/Th2免疫反应失衡、Th2细胞因子过表达、表达皮肤淋巴细胞相关抗原的T细胞增加、表皮炎症性树突状细胞(包括朗格汉斯细胞)中Fcε受体Ⅰ及TSLP表达增加等[5]。卡泊三醇能够诱导小鼠角质形成细胞过表达TSLP,导致AD样皮损;在卡泊三醇诱导的AD小鼠模型中可见表皮增生,真皮内嗜酸性粒细胞和肥大细胞等炎症细胞浸润,皮损处TSLP、IL-4、IL-5、IL-13、IL-31、IL-10、IL-8等Th2细胞因子表达增加,同时小鼠血清中IgE水平升高[6]。因此,卡泊三醇诱导的动物模型很好地再现了AD免疫功能障碍的特征。本实验即采用卡泊三醇搽剂诱导AD模型,观察雷西莫特对AD小鼠的治疗效果及可能的作用机制。
Toll样受体(Toll-like receptor,TLR)是一种模式识别受体,是固有免疫的重要组成部分,可对入侵的病原体产生防御性炎症反应[7]。研究表明,雷西莫特作为TLR7/8激动剂可诱导细胞因子如α干扰素、γ干扰素和IL-12表达,从而增加Th1免疫应答,同时抑制Th2细胞产生IL-4和IL-5[8]。本研究中,治疗组小鼠耳部皮损肿胀、红斑、鳞屑情况较模型组改善,耳部皮损组织中炎症细胞浸润程度减轻,肥大细胞数量减少,血清IL-4、IL-13水平下降,耳部皮损组织中γ干扰素表达增加。结果表明腹腔注射雷西莫特可以通过调节Th1/Th2免疫应答反应改善小鼠AD症状。
IgE在哮喘、变应性鼻炎、AD等变应性疾病的发病中起着至关重要的作用,Th2细胞因子有助于激活B淋巴细胞促进IgE产生,而IgE可促进肥大细胞和嗜碱性粒细胞脱颗粒进而导致过敏反应,两者可协同放大皮肤炎症反应[9]。雷西莫特可直接作用于B淋巴细胞而抑制IgE的合成,也可通过促进γ干扰素和IL-12的分泌抑制IgE的产生[10]。本实验中,治疗组小鼠血清IgE水平低于模型组,提示腹腔注射雷西莫特可能通过抑制IgE分泌改善AD皮损情况。
TSLP作为一种细胞因子,能够促进B淋巴细胞和髓系树突状细胞的活化,参与人和小鼠AD及相关疾病的发生、发展。TSLP通过TNF受体超家族成员4配体促使树突状细胞产生CC趋化因子配体17及22,招募CD4+ Th2,还可以刺激肥大细胞和自然杀伤T细胞活化,从而增加Th2细胞因子的产生[11]。雷西莫特可下调TNF受体超家族成员4配体的表达并促进IL-10、IL-12的产生,消除TSLP相关树突状细胞参与的Th2免疫应答,有助于缓解或预防变应性炎症[12]。本实验中,治疗组小鼠皮损组织中TSLP mRNA表达量与模型组比较差异无统计学意义,提示腹腔注射雷西莫特可能不会直接影响TSLP表达,其机制可能与下调TNF受体超家族成员4配体表达有关。
综上所述,本实验结果显示腹腔注射雷西莫特可以改善AD小鼠的皮炎状况,作用机制可能与雷西莫特抑制Th2反应、减少IL-4和IL-13分泌,增强Th1反应、增加γ干扰素mRNA表达,同时抑制IgE的合成有关,但其发挥作用的具体通路及不良反应有待进一步研究。
| [1] |
LANGAN S M, IRVINE A D, WEIDINGER S. Atopic dermatitis[J]. Lancet, 2020, 396: 345-360. DOI:10.1016/S0140-6736(20)31286-1 |
| [2] |
TORRES T, FERREIRA E O, GONÇALO M, MENDES-BASTOS P, SELORES M, FILIPE P. Update on atopic dermatitis[J]. Acta Med Port, 2019, 32: 606-613. DOI:10.20344/amp.11963 |
| [3] |
FROTSCHER B, ANTON K, WORM M. Inhibition of IgE production by the imidazoquinoline resiquimod in nonallergic and allergic donors[J]. J Invest Dermatol, 2002, 119: 1059-1064. DOI:10.1046/j.1523-1747.2002.19531.x |
| [4] |
QU S H, QIN T J, LI M, ZHANG S J, YE L S, WEI J Z, et al. The effects of resiquimod in an ovalbumin-induced allergic rhinitis model[J]. Int Immunopharmacol, 2018, 59: 233-242. DOI:10.1016/j.intimp.2018.04.015 |
| [5] |
ZANIBONI M C, SAMORANO L P, ORFALI R L, AOKI V. Skin barrier in atopic dermatitis: beyond filaggrin[J]. An Bras Dermatol, 2016, 91: 472-478. DOI:10.1590/abd1806-4841.20164412 |
| [6] |
MOOSBRUGGER-MARTINZ V, SCHMUTH M, DUBRAC S. A mouse model for atopic dermatitis using topical application of vitamin D3 or of its analog MC903[J]. Methods Mol Biol, 2017, 1559: 91-106. |
| [7] |
TAKEDA K, AKIRA S. Toll-like receptors[J]. Curr Protoc Immunol, 2015, 109: 14.12.1-14.12.10. |
| [8] |
WAGNER T L, AHONEN C L, COUTURE A M, GIBSON S J, MILLER R L, SMITH R M, et al. Modulation of TH1 and TH2 cytokine production with the immune response modifiers, R-848 and imiquimod[J]. Cell Immunol, 1999, 191: 10-19. DOI:10.1006/cimm.1998.1406 |
| [9] |
OETTGEN H C. Fifty years later: emerging functions of IgE antibodies in host defense, immune regulation, and allergic diseases[J]. J Allergy Clin Immunol, 2016, 137: 1631-1645. DOI:10.1016/j.jaci.2016.04.009 |
| [10] |
SHEN E, LU L, WU C. TLR7/8 ligand, R-848, inhibits IgE synthesis by acting directly on B lymphocytes[J]. Scand J Immunol, 2008, 67: 560-568. DOI:10.1111/j.1365-3083.2008.02105.x |
| [11] |
INDRA A K. Epidermal TSLP: a trigger factor for pathogenesis of atopic dermatitis[J]. Expert Rev Proteomics, 2013, 10: 309-311. DOI:10.1586/14789450.2013.814881 |
| [12] |
TORII Y, ITO T, AMAKAWA R, SUGIMOTO H, AMURO H, TANIJIRI T, et al. Imidazoquinoline acts as immune adjuvant for functional alteration of thymic stromal lymphopoietin-mediated allergic T cell response[J]. J Immunol, 2008, 181: 5340-5349. DOI:10.4049/jimmunol.181.8.5340 |
 2022, Vol. 43
2022, Vol. 43


