2. 重庆医科大学附属第二医院感染科,重庆 400010
2. Department of Infectious Diseases, The Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
HBV感染呈世界性流行,影响了超过2.57亿人[1]。目前我国一般人群乙型肝炎表面抗原(hepatitis B surface antigen,HbsAg)流行率为5%~6%,慢性HBV感染者约有7 000万例,其中慢性乙型肝炎患者有2 000万~3 000万例[2]。2014年中国疾病预防控制中心的一项流行病学调查研究显示,我国15~29岁人群HBsAg流行率为4.38%[3],可见我国青年HBV感染患者数量庞大。
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是肝衰竭中较常见的类型,是在慢性肝病基础上由各种诱因引起以急性黄疸、凝血功能障碍为表现的综合征[4],其并发症多、病死率高、住院花费高、住院时间长[5-6],内科治疗尚缺乏特效药物和手段,肝移植是其治疗的有效方案,但是因为供肝困难、手术花费较大及手术风险较高,临床应用受限。因此临床上强调在肝衰竭诊断明确后进行动态评估,采取综合治疗措施,同时提前筛选出肝移植候选人群,以降低病死率、提高生存率。既往有多种研究模型如终末期肝病模型(model for end-stage liver disease,MELD)、MELD联合血钠、整合MELD模型、皇家医学院医院标准、序贯器官衰竭评估、慢性肝衰竭联盟-器官功能衰竭评分等[7-9],但这些评分系统多由西方学者提出,用于判断我国HBV-ACLF患者预后的准确性较低,且这些评分系统针对的是全年龄段人群。
既往有学者就我国老年肝衰竭患者的预后进行了研究[10],但针对青年人群肝衰竭预后危险因素的研究尚缺乏。青年人群在社会各行各业扮演重要角色,又是家庭的重要支撑,因此罹患肝衰竭对这部分患者及其家庭无疑是沉重的打击。本研究运用二元logistic回归方法分析青年HBV-ACLF患者预后的影响因素并建立预后模型,旨在为青年HBV-ACLF的预后判断提供依据。
1 资料和方法 1.1 病例资料回顾性选择2019年1月至2021年3月于重庆医科大学附属第二医院和重庆医科大学附属大足医院感染科住院并明确诊断为HBV-ACLF的青年患者113例。纳入标准:(1)HBV感染诊断符合我国《慢性乙型肝炎防治指南(2019年版)》[11]中慢性HBV感染的诊断标准;(2)ACLF诊断符合我国《肝衰竭诊治指南(2018年版)》[4]中ACLF诊断标准,即慢性肝病基础上黄疸迅速加重(血清总胆红素≥171 μmol/L或每日上升≥17.1 μmol/L)且有出血表现(国际标准化比值≥1.5);(3)年龄为15~44岁,符合WHO 2012年提出的对于青年人群的划分标准[12]。排除标准:(1)合并甲型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒、丁型肝炎病毒或其他病毒(如HIV、EB病毒及巨细胞病毒)感染者;(2)合并肝细胞癌或肝外严重疾病;(3)合并酒精性肝病;(4)合并药物性肝炎;(5)合并自身免疫性肝病或遗传代谢性肝病;(6)妊娠期或哺乳期;(7)临床资料不完整者。
1.2 研究方法采用回顾性队列研究方法,收集患者初次住院的临床资料(包括性别、年龄、乙型肝炎家族史、是否抗HBV治疗、是否合并肝硬化)、各项实验室指标(包括肝功能、血常规、肾功能、电解质、心肌酶谱、凝血功能、乙型肝炎病毒学、免疫学、降钙素原、甲胎蛋白)及住院期间肝衰竭相关并发症发生情况(包括自发性细菌性腹膜炎、肝性脑病、消化道出血、肝肾综合征等)。本研究通过重庆医科大学附属大足医院伦理委员会审批。
1.3 治疗方法所有患者均接受标准内科治疗,包括卧床休息、肝脏支持治疗、补充能量和维生素、静脉输注白蛋白或血浆、维持水电解质平衡,相关并发症预防和治疗原则参照文献[13],抗病毒治疗根据患者意愿及HBV-DNA复制水平选择恩替卡韦、富马酸替诺福韦二吡呋酯、富马酸丙酚替诺福韦。
1.4 疗效判定标准和分组以入院后经过积极内科治疗后转归为判定标准,根据入院后治疗好转出院及入院后治疗期间死亡或出院后电话随访12周内死亡将患者分为存活组和死亡组。好转:患者肝衰竭症状、体征明显改善或基本消失,肝功能指标明显缓解(总胆红素降至正常参考值上限的5倍以下、国际标准化比值<1.5且各类指标出院后随访无明显波动)。死亡:患者肝衰竭症状、体征较治疗前无改善,肝功能恢复较差(总胆红素仍≥正常参考值上限的5倍、国际标准化比值≥1.5),并且院内死亡或出院后12周内死亡。
1.5 统计学处理应用SPSS 23.0软件进行统计学分析。服从正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;不服从正态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验。计数资料以例数和百分数表示,两组间比较采用χ2检验。对两组间差异有统计学意义的变量首先进行多重共线性检测以排除存在严重共线性的变量,然后将其余变量纳入二元logistic回归模型进行多因素分析,确定青年HBV-ACLF患者预后的独立危险因素。使用多因素分析中差异有统计学意义的变量建立预后模型,使用Hosmer-Lemeshow检验分析模型拟合优度,采用ROC曲线评价预后模型对青年HBV-ACLF患者预后的预测价值。检验水准(α)为0.05。
2 结果 2.1 患者基线指标与预后的相关性分析113例青年HBV-ACLF患者中男88例、女25例,年龄为33.00(27.00,40.00)岁。存活组49例,死亡组64例,病死率为56.64%(64/113)。死亡组患者白细胞计数、中性粒细胞比例、血钾、凝血酶原时间、国际标准化比值、肌酸激酶同工酶、降钙素原、乙型肝炎e抗原(hepatitis B e antigen,HbeAg)定量及HBV-DNA定量均高于存活组,白蛋白、血钠、甲胎蛋白均低于存活组,差异均有统计学意义(P均<0.05)。见表 1。
|
|
表 1 死亡组与存活组青年乙型肝炎病毒相关慢加急性肝衰竭患者临床基线指标比较 |
2.2 青年HBV-ACLF患者预后影响因素的多因素分析
首先对两组间差异有统计学意义的指标进行多重共线性诊断,凝血酶原时间和国际标准化比值2个指标存在严重共线性问题(容忍度、方差膨胀系数分别为0.01、51.44和0.02、50.95),予以剔除。将其余10个变量纳入二元logistic回归模型进行多因素分析,连续性变量以原始数值输入,对分类变量进行赋值,其中HBV-DNA定量≥1×106 IU/mL赋值1,<1×106 IU/mL赋值0,HBeAg定量阳性赋值1、阴性赋值0。多因素分析结果显示,HBV-DNA定量≥1×106 IU/mL(OR=19.85,P<0.05)、低白蛋白(OR=0.71,P<0.05)和低甲胎蛋白(OR=0.58,P<0.05)是青年HBV-ACLF患者预后的独立危险因素(表 2)。
|
|
表 2 青年乙型肝炎病毒相关慢加急性肝衰竭患者预后多因素二元logistic回归分析 |
2.3 预后模型的建立
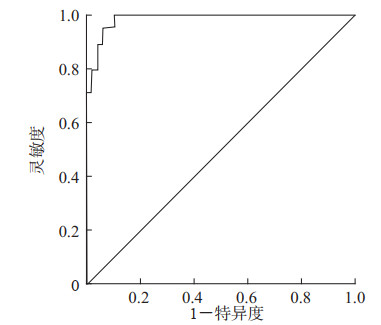
根据多因素二元logistic回归系数及常数项建立青年HBV-ACLF预后模型:P预后=1/(1+e-X),其中X=5.82+2.99×HBV-DNA定量(≥1×106 IU/mL为1,<1×106 IU/mL为0)-0.35×白蛋白(g/L)-0.54×甲胎蛋白(ng/mL)。Hosmer-Lemeshow检验提示该预后模型拟合良好(χ2=4.16,P=0.84)。ROC曲线(图 1)分析显示,该模型预测青年HBV-ACLF预后的AUC值为0.98(95% CI 0.97~1.00,P<0.001),表明该预后模型预测效果较好。以约登指数最大值对应的P预后=0.892作为模型预测诊断的临界值,其对应的特异度为93.9%,灵敏度为95.3%。
|
图 1 青年乙型肝炎病毒相关慢加急性肝衰竭患者预后模型的受试者工作特征曲线 |
3 讨论
ACLF为临床危急重症,治疗难度大、预后差,尽管科研人员及临床医师做出不懈努力,该病的病死率仍较高。在本研究中青年HBV-ACLF患者病死率高达56.64%,与既往研究[14]报道相似。鉴于肝衰竭病情进展迅速及其不可预测的预后特点,准确的预后评分是优化临床治疗策略的前提,现有肝衰竭预后模型大多建立在酒精性肝病和/或丙型肝炎患者基础之上,其用于预测HBV相关肝衰竭的准确性尚存在争议。
本研究对34种可能影响HBV-ACLF患者预后的临床指标进行单因素分析,发现白细胞计数、中性粒细胞比例、血钠、血钾、甲胎蛋白、降钙素原、白蛋白、凝血酶原时间、国际标准化比值、肌酸激酶同工酶、HBV-DNA定量及HBeAg定量可能与预后有关;再将这些指标纳入多因素二元logistic回归分析,发现低甲胎蛋白、HBV-DNA定量≥1×106 IU/mL及低白蛋白为青年HBV-ACLF患者预后的独立危险因素,ROC AUC值达到0.98,高于既往研究[15-16],提示该模型具有较好的临床预测价值。既往研究多得出总胆红素、肝衰竭相关并发症(肝性脑病、腹水、自发性细菌性腹膜炎等)、凝血功能为预测肝衰竭预后的独立因素[10, 13-14, 17],但本研究发现甲胎蛋白、HBV-DNA定量及白蛋白是HBV-ACLF预后的独立影响因素,这是本研究与既往研究最大的不同。分析原因可能与本研究纳入相关实验室指标为患者入院时的初始值有关,死亡组患者住院期间部分指标如凝血酶原时间、国际标准化比值及总胆红素等可能持续升高。
甲胎蛋白是一种常见的糖蛋白,由胚胎时期肝脏合成,胎儿出生后血液内甲胎蛋白便会逐渐流失,正常人血清内甲胎蛋白含量通常较低,其升高多见于肝细胞癌、肝硬化及肝炎后肝细胞再生。研究表明,甲胎蛋白能反映肝细胞再生的能力、预测肝衰竭后受损肝细胞的恢复水平[18-19]。本研究结果显示存活组患者甲胎蛋白水平高于死亡组(P<0.01),且多因素分析显示低甲胎蛋白是青年HBV-ACLF预后的独立危险因素,与既往文献[20]报道一致。还有学者认为入院时较高的甲胎蛋白水平及入院后7 d甲胎蛋白的动态升高均与患者的快速恢复独立相关[21]。
除了γ球蛋白由单核巨噬细胞系统(非肝细胞)合成外,其他血浆蛋白包括白蛋白均在肝脏合成。白蛋白的半衰期为15~19 d,且肝脏具有强大的代偿能力,因此只有当肝脏损害达到一定程度时才会出现白蛋白水平的变化。本研究中死亡组患者白蛋白水平低于存活组(P<0.01),提示死亡组患者肝脏储备功能更差、肝细胞损害更严重,与既往研究[22]报道一致。
HBV-DNA定量与患者体内HBV复制活跃程度相关,长期的高HBV载量与患者发生肝硬化及肝细胞癌有关,还可导致HBV-ACLF患者体内产生过强的免疫应答,使大量的肝细胞坏死,与肝衰竭患者预后直接相关。Jeng等[23]研究发现HBV-DNA含量是预测慢性乙型肝炎急性加重患者肝功能失代偿的独立危险因素,Hsu等[24]观察到治疗前HBV-DNA水平与死亡风险相关。在本研究中,死亡组患者比存活组具有更高的HBV-DNA含量(P=0.04),且为HBV-ACLF不良预后的独立危险因素,与既往研究结果[22-23]一致;本研究结果显示,高HBV-DNA定量的OR较大(19.85),更加凸显入院时HBV-DNA定量水平在预测青年HBV-ACLF患者预后中的作用。
青年患者预期寿命较长,身体各器官功能代偿能力均较中老年人群强大。甲胎蛋白可反映肝脏再生能力,白蛋白反映肝脏合成功能,通过本研究结果可见,HBV-DNA定量与机体自身免疫反应强弱有关,若青年HBV-ACLF患者入院时甲胎蛋白未升高或仅轻度升高、白蛋白明显下降且有较高的HBV-DNA定量水平,往往预示该患者预后不良,可优先将其列入肝移植名单,以改善预后、降低病死率。
综上所述,本研究结果表明血清白蛋白、甲胎蛋白及HBV-DNA定量是青年HBV-ACLF预后的独立影响因素,并建立了预后模型;该模型的预测价值较高,可为青年HBV-ACLF患者是否提前行肝移植准备提供临床参考依据。在肝衰竭患者诊断明确后对其进行动态评估以采取综合治疗措施,并提前筛选出肝移植候选人群,有助于降低肝衰竭病死率、提高生存率。本研究样本量小,且为回顾性分析,所得结论仍需要更大样本量的前瞻性研究验证,以更好地服务于临床。
| [1] |
World Health Organization. Global hepatitis report, 2017[EB/OL]. (2017-04-19)[2021-10-20]. https://www.who.int/publications/i/item/9789241565455.
|
| [2] |
LIU J, LIANG W, JING W, LIU M. Countdown to 2030: eliminating hepatitis B disease, China[J]. Bull World Health Organ, 2019, 97: 230-238. DOI:10.2471/BLT.18.219469 |
| [3] |
CUI F, SHEN L, LI L, WANG H, WANG F, BI S, et al. Prevention of chronic hepatitis B after 3 decades of escalating vaccination policy, China[J]. Emerg Infect Dis, 2017, 23: 765-772. DOI:10.3201/eid2305.161477 |
| [4] |
中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J]. 中华临床感染病杂志, 2018, 11: 401-410. |
| [5] |
BERNAL W, JALAN R, QUAGLIA A, SIMPSON K, WENDON J, BURROUGHS A. Acute-on-chronic liver failure[J]. Lancet, 2015, 386: 1576-1587. DOI:10.1016/S0140-6736(15)00309-8 |
| [6] |
OLSON J C, KAMATH P S. Acute-on-chronic liver failure: concept, natural history, and prognosis[J]. Curr Opin Crit Care, 2011, 17: 165-169. DOI:10.1097/MCC.0b013e328344b42d |
| [7] |
HERNAEZ R, SOLÀ E, MOREAU R, GINÈS P. Acute-on-chronic liver failure: an update[J]. Gut, 2017, 66: 541-553. DOI:10.1136/gutjnl-2016-312670 |
| [8] |
刘艳梅, 刘先进, 陈智娴, 沈毅, 邵建国, 汪徐林, 等. 不同评分系统判断乙型肝炎慢加急性肝衰竭预后的价值[J]. 中华传染病杂志, 2015, 33: 737-741. |
| [9] |
张东敬, 周彬, 侯金林. 慢加急性肝衰竭预后模型的研究进展[J]. 临床肝胆病杂志, 2018, 34: 1351-1356. |
| [10] |
姚雅极, 邹圣强, 胡佳民, 吉芳, 赵群, 周建国, 等. 老年肝衰竭患者预后影响因素分析及其预测模型的构建[J]. 江苏大学学报(医学版), 2021, 31: 143-146, 151. |
| [11] |
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 中华传染病杂志, 2019, 37: 711-736. |
| [12] |
World Health Organization. World health day 2012—ageing and health—toolkit for event organizers[EB/OL]. (2017-04-19)[2021-10-20]. http://apps.who.int/iris/bitstream/handle/10665/70840/WHO_DCO_WHD_2012.1_eng.pdf?sequence=1.
|
| [13] |
李子月, 杨士田, 吴玲玲, 田利英, 李娜, 马路园, 等. 乙型肝炎病毒相关慢加急性肝衰竭患者预后危险因素分析及预后模型建立[J]. 中华传染病杂志, 2019, 37: 737-741. |
| [14] |
龚志伟, 邓存良. 探讨建立乙肝相关慢加急性肝衰竭预后影响因素分析的新模型[J]. 解放军医学院学报, 2020, 41: 269-272, 278. |
| [15] |
LIN W, ZHANG J, LIU X, LIU H, HE J, LI M, et al. A dynamic model for predicting outcome in patients with HBV related acute-on-chronic liver failure[J]. Ann Hepatol, 2018, 17: 392-402. |
| [16] |
孙蓓蓓, 管世鹤, 杨凯, 王爱华, 潘颖, 张浩. 新型预测模型评估慢加急性乙型肝炎肝衰竭患者临床结局的研究[J]. 安徽医科大学学报, 2018, 53: 619-623. |
| [17] |
CARR B I, GUERRA V. Low alpha-fetoprotein levels are associated with improved survival in hepatocellular carcinoma patients with portal vein thrombosis[J]. Dig Dis Sci, 2016, 61: 937-947. |
| [18] |
KAKISAKA K, KATAOKA K, ONODERA M, SUZUKI A, ENDO K, TATEMICHI Y, et al. Alpha-fetoprotein: a biomarker for the recruitment of progenitor cells in the liver in patients with acute liver injury or failure[J/OL]. Hepatol Res, 2015, 45: E12-E20. DOI: 10.1111/hepr.12448.
|
| [19] |
TAO Y, WANG M, CHEN E, TANG H. Liver regeneration: analysis of the main relevant signaling molecules[J/OL]. Mediators Inflamm, 2017, 2017: 4256352. DOI: 10.1155/2017/4256352.
|
| [20] |
WANG X, SHEN C, YANG J, YANG X, QIN S, ZENG H, et al. Alpha-fetoprotein as a predictive marker for patients with hepatitis B-related acute-on-chronic liver failure[J/OL]. Can J Gastroenterol Hepatol, 2018, 2018: 1232785. DOI: 10.1155/2018/1232785.
|
| [21] |
康玮玮, 徐曼曼, 孔明, 刘芳, 朱冰, 游绍莉, 等. 甲胎蛋白在慢加急性肝衰竭临床预后分型中的应用价值[J]. 胃肠病学和肝病学杂志, 2021, 30: 510-515. |
| [22] |
GAO F, ZHANG Q, LIU Y, GONG G, MAO D, GONG Z, et al. Nomogram prediction of individual prognosis of patients with acute-on-chronic hepatitis B liver failure[J]. Dig Liver Dis, 2019, 51: 425-433. |
| [23] |
JENG W J, SHEEN I S, LIAW Y F. Hepatitis B virus DNA level predicts hepatic decompensation in patients with acute exacerbation of chronic hepatitis B[J]. Clin Gastroenterol Hepatol, 2010, 8: 541-545. |
| [24] |
HSU Y C, WU C Y, CHANG C Y, TAI C M, TSENG C H, PERNG D S, et al. Pretreatment viral DNA stratifies mortality risk in patients receiving antiviral therapy for severe acute exacerbation of chronic hepatitis B[J]. Antivir Ther, 2013, 18: 221-228. |
 2022, Vol. 43
2022, Vol. 43


