G蛋白偶联受体(G protein-coupled receptor,GPCR)是细胞表面最大的受体家族,可识别大量的细胞外分子,包括神经递质、激素和趋化因子等[1]。GPCR在多种生物中表达,包括哺乳动物、植物、微生物和无脊椎动物[2]。GPCR广泛分布于人体的中枢神经系统、免疫系统、心血管系统、视网膜等器官和组织,参与机体发育和正常功能的行使。肝损伤是指各种原因所导致的肝功能异常,表现为肝脏形态结构破坏和功能失调。GPCR在多种肝损伤类型中发挥着重要作用,如缺血再灌注肝损伤、胆汁淤积性肝损伤、四氯化碳肝损伤、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)等。本文就参与急慢性肝损伤的GPCR进行综述,以期为探索新的药物靶点提供思路和依据。
1 GPCR的分类与结构、激活和信号转导 1.1 GPCR的分类与结构首次提出的GPCR分类方案根据序列同源性将GPCR分为以下6类:A类(视紫红质样受体家族)、B类(分泌素受体家族)、C类(代谢性谷氨酸受体家族)、D类(真菌交配信息素受体家族)、E类(环腺苷酸受体家族)和F类(平滑卷曲受体家族)[2],研究者们未在脊椎动物中发现D类和E类[2]。另一种分类方案“GRAFS”将脊椎动物GPCR分为以下5类:谷氨酸受体家族、视紫红质样受体家族、黏附受体家族、平滑卷曲受体家族及分泌素受体家族[2]。GPCR包含7个跨膜螺旋,也称为7次跨膜受体[2]。GPCR具有共同的结构,由1个多肽和1个细胞外氨基末端、1个细胞内羧基末端及7个疏水跨膜结构域组成,并通过3个细胞外环和3个细胞内环连接[1]。
1.2 GPCR的激活和信号转导研究表明,GPCR存在多种激活方式。(1)经典的GPCR激活,即GPCR与异三聚体G蛋白偶联后激活下游信号通路[3]。许多GPCR表现出混杂的GPCR-G蛋白偶联模式,即1个GPCR可以与多个G蛋白亚型相互作用。由于高度的序列相似性,1个受体常常与同一家族内的多个Gα亚型结合[1]。例如,5-羟色胺1A受体与3种Gi/o家族蛋白Gi2、Gi3和Go5相互作用[1]。(2)GPCR的偏置激活,即GPCR选择性地激活G蛋白通路或β-制动蛋白(β-arrestin)通路[3]。(3)GPCR的内化激活。该激活方式有2种,一种是GPCR与其激动剂内化后继续信号转导,另一种是位于不同细胞器的GPCR在细胞内被激活[3]。(4)GPCR的二聚化激活。该激活方式也有2种,即GPCR仅在二聚化的状态下介导信号转导或GPCR在二聚化的状态下介导与单体状态下不同的信号转导通路[3]。(5)GPCR的反式激活。其分为配体依赖途径和配体非依赖途径,前者指GPCR激活的信号分子诱导产生内源性配体,配体受体结合激活下游信号;后者指GPCR通过不依赖配体的方式激活下游信号,如磷酸化下游分子或与下游分子形成二聚体[3]。(6)GPCR的双相激活,即早期时相和晚期时相分别由G蛋白或β-制动蛋白介导,继而激活不同的信号通路[3]。
2 肝损伤中的GPCR 2.1 肾上腺素能受体(adrenergic receptor,AR)AR是介导儿茶酚胺作用的一类组织受体,分为α-AR和β-AR。AR可以通过多种方式激活并介导信号转导,如偏置激活β-制动蛋白的β-AR配体卡维地洛,已被证明可以抑制G蛋白介导的儿茶酚胺毒性作用,并刺激β-制动蛋白介导的细胞生存信号通路[3]。内化激活时,β-制动蛋白未与β1-AR形成复合物,而是短暂“亲吻”β1-AR并结合到质膜网格蛋白上,然后激活ERK1/2[3]。β2-AR激活可导致p38 MAPK双相激活,急性早期激活在10 min达到峰值,60 min恢复到基本水平,而弱延迟激活发生在90 min时并持续6 h[3]。
在急慢性肝损伤研究中,目前报道较多的是α-AR。α-AR激动剂可加重对乙酰氨基酚诱导的肝损伤,其拮抗剂可减轻四氯化碳诱导的肝氧化损伤、非酒精性脂肪性肝炎、肝脏坏死、脂肪变性、肝纤维化[4]。β-AR激动剂可减少Fas抗体(Jo2mAb)诱导的肝细胞死亡。交感神经系统通过α-AR信号参与四氯化碳相关的肝脂质过氧化、氧化性DNA损伤和促炎细胞因子产生,化学交感神经切除术基本上阻断了四氯化碳给药后24 h内观察到的肝毒性作用[4]。在脂多糖诱导的肝损伤模型中,右美托咪定通过α2-AR增加糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)/丝裂原活化蛋白激酶磷酸酶1(mitogen activation protein kinase phosphatase 1,MKP-1)/核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)通路活性,减轻肝脏氧化应激和细胞凋亡[5]。
2.2 血管紧张素受体(angiotensin receptor,ATR)ATR包括1~4型(AT1R、AT2R、AT3R、AT4R),目前研究较多的是AT1R和AT2R。AT1R在成人组织中大量存在,而AT2R主要在胎儿发育期间表达并在病理条件下表达上调[6]。AT1R在偏置激活时通过G蛋白途径介导有效的血管收缩和血压升高,并通过β-制动蛋白途径介导潜在的有益作用,包括细胞保护和抗凋亡[3]。双相激活时,AT1R介导的ERK1/2磷酸化在2 min时达到第1个瞬时峰值,然后在120~150 min达到第2个持续峰值[3]。ERK1/2激活的2个阶段都有助于c-Jun转录激活和细胞增殖[3],然而只有ERK1/2激活的第2阶段才对血管紧张素Ⅱ诱导的DNA合成和细胞生长产生影响[3]。
在肝硬化的实验模型中,血管紧张素Ⅱ激活AT1R可以诱导肝星状细胞增殖并在体外上调TGF-β1的表达,AT1R拮抗剂氯沙坦能够降低中度至重度门静脉高压患者的肝静脉压力梯度[7]。也有研究表明血管紧张素Ⅱ激活AT1R,继而磷酸化下游Janus激酶2和随后的RhoA/Rho激酶促进肝纤维化[8]。在硫代乙酰胺诱导的肝纤维化模型中,使用AT1R拮抗剂替米沙坦和氯沙坦可通过抗炎和抗氧化作用减轻肝纤维化[9]。AT2R通常在体内外起到对抗和平衡AT1R介导的作用[10]。AT1R敲除小鼠肝纤维化的发生减少,相反AT2R敲除小鼠却会发生更加严重的肝纤维化,这表明AT2R的激活可能发挥抗纤维化和抗氧化应激的作用[10]。
2.3 蛋白酶激活受体(proteinase-activated receptor,PAR)PAR包括4种亚型:PAR1、PAR2、PAR3、PAR4。PAR1是凝血酶的高亲和力受体,广泛表达于成纤维细胞、巨噬细胞、血小板和内皮细胞[11]。PAR2在内化激活时可结合网格蛋白,继而激活ERK1/2信号[3]。凝血酶结合PAR1/PAR3可导致表皮生长因子受体反式激活[12]。
在缺血再灌肝损伤小鼠模型中,PAR1主要表达于肝窦内皮细胞,且在肝缺血再灌后表达增加,PAR1拮抗剂可减轻肝损伤和肝窦内皮细胞的凋亡[13]。在四氯化碳诱导的肝纤维化模型中,肝星状细胞上表达的PAR1通过促进肝星状细胞的增殖活化和胶原沉积加重肝纤维化[14]。PAR1可导致多种与NAFLD相关的病理变化,包括肝脏脂质积聚、炎症和肝细胞损伤,同样,在2, 3, 7, 8-四氯二苯并-对-二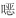
TGR5为GPCR视紫红质样受体家族的成员[19],普遍表达于啮齿动物和人体组织中,可调节能量稳态和葡萄糖代谢[20-21]。TGR5在肝脏中高度表达,特别是在非实质细胞如库普弗细胞、肝窦内皮细胞和胆管细胞[21]。TGR5可调节肝脏微循环、炎症、组织再生、胆汁分泌及胆囊充盈[22]。研究表明,TGR5缺失小鼠更易产生炎症性肝损伤、胆汁淤积性肝损伤、肝纤维化。在原发性硬化性胆管炎患者的胆管上皮细胞中,TGR5水平降低可促进反应性胆管上皮细胞表型的发展,加重胆道损伤[23]。TGR5激动剂可以改善炎症性肝损伤、胆汁淤积性肝损伤、NAFLD,并改善肝脏疾病的肝外并发症,如胆汁淤积性瘙痒[22]。TGR5抑制剂可延缓多囊性肝病和胆管癌的进展[22]。
2.5 鞘氨醇1-磷酸受体(sphingosine 1-phosphate receptor,S1PR)2S1PR属于GPCR超家族视紫红质样受体家族[24]。在哺乳动物中发现其有5种亚型:S1PR1、S1PR2、S1PR3、S1PR4和S1PR5。在啮齿动物和人体肝脏中,S1PR2主要表达在肝细胞、胆管细胞、肝星状细胞、肝肌成纤维细胞、肝窦内皮细胞和巨噬细胞[25]。研究表明,在胆管结扎小鼠模型中,S1PR2在肝脏和胆管细胞中的表达水平升高,S1PR2敲除小鼠胆汁淤积诱导的肝损伤减轻,胆管细胞增殖、炎症和肝纤维化减少[26]。进一步的机制研究发现,S1PR2通过激活ERK1/2-SphK2信号通路导致组蛋白乙酰化增加和参与细胞增殖和代谢基因表达上调,促进肝纤维化;通过激活ERK1/2-NF-κB信号通路增加环氧合酶2等多种炎症因子的表达,促进肝纤维化;或直接通过激活ERK1/2诱导炎症反应,促进肝纤维化[26]。
2.6 G蛋白偶联受体120(G protein-coupled receptor 120,GPR120)GPR120又称游离脂肪酸受体4,主要表达于肠细胞、脂肪细胞和巨噬细胞,GPR120已被公认为代谢性疾病的潜在治疗靶点。有研究表明,GPR120表达降低可能促进了非酒精性脂肪性肝炎进展过程中的炎症反应[27]。GPR120已被确定为ω-3脂肪酸的第1个受体,并介导其抗炎作用[28]。Raptis等[28]研究发现,在缺血再灌注肝损伤模型中,GPR120表达于库普弗细胞,使用GPR120激动剂GW9508能减轻肝损伤,而耗竭库普弗细胞或用siRNA干扰GPR120表达都会消除这种保护作用;进一步研究发现GPR120对肝损伤的保护作用与抑制NF-κB/JNK介导的炎症反应有关。然而在Baker等[29]研究中GPR120似乎并没有肝保护作用,该研究发现在缺血再灌注肝损伤模型中,鱼油(富含ω-3脂肪酸和维生素E)预处理能够减轻GPR120敲除小鼠的肝损伤,这种矛盾结果的出现可能是因为Raptis等[28]使用的GW9508为合成的、非特异性游离脂肪酸受体激动剂,也可能是因为耗竭库普弗细胞产生了额外的影响。
3 小结与展望GPCR是细胞表面最大的受体家族,因其能够调控许多病理生理过程且在细胞表面具有可以成药的靶点,一直是药物靶点研究的重要领域。肝脏是人体的重要器官,具有代谢、解毒、分泌和排泄胆汁等功能。在受到有害因素侵袭后发生肝损伤如缺血再灌注肝损伤、胆汁淤积性肝损伤等的过程中,有许多GPCR通过信号转导发挥作用。通过对GPCR参与肝损伤的研究可为进一步找到潜在的药物靶点提供思路和依据。
| [1] |
HILGER D, MASUREEL M, KOBILKA B K. Structure and dynamics of GPCR signaling complexes[J]. Nat Struct Mol Biol, 2018, 25: 4-12. DOI:10.1038/s41594-017-0011-7 |
| [2] |
JOSEFSSON L G. Evidence for kinship between diverse G-protein coupled receptors[J]. Gene, 1999, 239: 333-340. DOI:10.1016/S0378-1119(99)00392-3 |
| [3] |
WANG W J, QIAO Y H, LI Z J. New insights into modes of GPCR activation[J]. Trends Pharmacol Sci, 2018, 39: 367-386. DOI:10.1016/j.tips.2018.01.001 |
| [4] |
LIN J C, PENG Y J, WANG S Y, LAI M J, YOUNG T H, SALTER D M, et al. Sympathetic nervous system control of carbon tetrachloride-induced oxidative stress in liver through α-adrenergic signaling[J/OL]. Oxid Med Cell Longev, 2016, 2016: 3190617. DOI: 10.1155/2016/3190617.
|
| [5] |
SHA J, ZHANG H, ZHAO Y, FENG X, HU X, WANG C, et al. Dexmedetomidine attenuates lipopolysaccharide-induced liver oxidative stress and cell apoptosis in rats by increasing GSK-3β/MKP-1/Nrf2 pathway activity via the α2 adrenergic receptor[J]. Toxicol Appl Pharmacol, 2019, 364: 144-152. DOI:10.1016/j.taap.2018.12.017 |
| [6] |
TAMURA K, TANAKA Y, TSURUMI Y, AZUMA K, SHIGENAGA A I, WAKUI H, et al. The role of angiotensin AT1 receptor-associated protein in renin-angiotensin system regulation and function[J]. Curr Hypertens Rep, 2007, 9: 121-127. DOI:10.1007/s11906-007-0022-6 |
| [7] |
SILVA A C S E, MIRANDA A S, ROCHA N P, TEIXEIRA A L. Renin angiotensin system in liver diseases: friend or foe?[J]. World J Gastroenterol, 2017, 23: 3396-3406. DOI:10.3748/wjg.v23.i19.3396 |
| [8] |
GRANZOW M, SCHIERWAGEN R, KLEIN S, KOWALLICK B, HUSS S, LINHART M, et al. Angiotensin-Ⅱ type 1 receptor-mediated Janus kinase 2 activation induces liver fibrosis[J]. Hepatology, 2014, 60: 334-348. DOI:10.1002/hep.27117 |
| [9] |
CZECHOWSKA G, CELINSKI K, KOROLCZUK A, WOJCICKA G, DUDKA J, BOJARSKA A, et al. The effect of the angiotensin Ⅱ receptor, type 1 receptor antagonists, losartan and telmisartan, on thioacetamide-induced liver fibrosis in rats[J]. J Physiol Pharmacol, 2016, 67: 575-586. |
| [10] |
DE GASPARO M, CATT K J, INAGAMI T, WRIGHT J W, UNGER T. International union of pharmacology. ⅩⅩⅢ. The angiotensin Ⅱreceptors[J]. Pharmacol Rev, 2000, 52: 415-472. |
| [11] |
VU T K, HUNG D T, WHEATON V I, COUGHLIN S R. Molecular cloning of a functional thrombin receptor reveals a novel proteolytic mechanism of receptor activation[J]. Cell, 1991, 64: 1057-1068. DOI:10.1016/0092-8674(91)90261-V |
| [12] |
HUANG C Y, LIN H J, CHEN H S, CHENG S Y, HSU H C, TANG C H. Thrombin promotes matrix metalloproteinase-13 expression through the PKCδ c-Src/EGFR/PI3K/Akt/AP-1 signaling pathway in human chondrocytes[J/OL]. Mediators Inflamm, 2013, 2013: 326041. DOI: 10.1155/2013/326041.
|
| [13] |
NOGUCHI D, KURIYAMA N, ITO T, FUJII T, KATO H, MIZUNO S, et al. Antiapoptotic effect by PAR-1 antagonist protects mouse liver against ischemia-reperfusion injury[J]. J Surg Res, 2020, 246: 568-583. DOI:10.1016/j.jss.2019.09.044 |
| [14] |
POOLE L G, PANT A, CLINE-FEDEWA H M, WILLIAMS K J, COPPLE B L, PALUMBO J S, et al. Liver fibrosis is driven by protease-activated receptor-1 expressed by hepatic stellate cells in experimental chronic liver injury[J]. Res Pract Thromb Haemost, 2020, 4: 906-917. DOI:10.1002/rth2.12403 |
| [15] |
NAULT R, FADER K A, KOPEC A K, HARKEMA J R, ZACHAREWSKI T R, LUYENDYK J P. From the cover: coagulation-driven hepatic fibrosis requires protease activated receptor-1 (PAR-1) in a mouse model of TCDD-elicited steatohepatitis[J]. Toxicol Sci, 2016, 154: 381-391. DOI:10.1093/toxsci/kfw175 |
| [16] |
RANA R, SHEARER A M, FLETCHER E K, NGUYEN N, GUHA S, COX D H, et al. PAR2 controls cholesterol homeostasis and lipid metabolism in nonalcoholic fatty liver disease[J]. Mol Metab, 2019, 29: 99-113. DOI:10.1016/j.molmet.2019.08.019 |
| [17] |
KIM B M, KIM D H, PARK Y J, HA S, CHOI Y J, YU H S, et al. PAR2 promotes high-fat diet-induced hepatic steatosis by inhibiting AMPK-mediated autophagy[J/OL]. J Nutr Biochem, 2021, 95: 108769. DOI: 10.1016/j.jnutbio.2021.108769.
|
| [18] |
SHEARER A M, RANA R, AUSTIN K, BALEJA J D, NGUYEN N, BOHM A, et al. Targeting liver fibrosis with a cell-penetrating protease-activated receptor-2 (PAR2) pepducin[J]. J Biol Chem, 2016, 291: 23188-23198. DOI:10.1074/jbc.M116.732743 |
| [19] |
MOMBAERTS P. Genes and ligands for odorant, vomeronasal and taste receptors[J]. Nat Rev Neurosci, 2004, 5: 263-278. DOI:10.1038/nrn1365 |
| [20] |
RASK-ANDERSEN M, MASURAM S, SCHIÖTH H B. The druggable genome: evaluation of drug targets in clinical trials suggests major shifts in molecular class and indication[J]. Annu Rev Pharmacol Toxicol, 2014, 54: 9-26. DOI:10.1146/annurev-pharmtox-011613-135943 |
| [21] |
SCHIÖTH H B, FREDRIKSSON R. The GRAFS classification system of G-protein coupled receptors in comparative perspective[J]. Gen Comp Endocrinol, 2005, 142: 94-101. DOI:10.1016/j.ygcen.2004.12.018 |
| [22] |
HÄUSSINGER D, KEITEL V. Role of TGR5 (GPBAR1) in liver disease[J]. Semin Liver Dis, 2018, 38: 333-339. DOI:10.1055/s-0038-1669940 |
| [23] |
REICH M, SPOMER L, KLINDT C, FUCHS K, STINDT J, DEUTSCHMANN K, et al. Downregulation of TGR5 (GPBAR1) in biliary epithelial cells contributes to the pathogenesis of sclerosing cholangitis[J]. J Hepatol, 2021, 75: 634-646. DOI:10.1016/j.jhep.2021.03.029 |
| [24] |
European Association for the Study of the Liver. EASL clinical practice guidelines: management of cholestatic liver diseases[J]. J Hepatol, 2009, 51: 237-267. DOI:10.1016/j.jhep.2009.04.009 |
| [25] |
HIRSCHFIELD G M, HEATHCOTE E J, GERSHWIN M E. Pathogenesis of cholestatic liver disease and therapeutic approaches[J]. Gastroenterology, 2010, 139: 1481-1496. DOI:10.1053/j.gastro.2010.09.004 |
| [26] |
WANG Y Q, AOKI H, YANG J, PENG K S, LIU R P, LI X, et al. The role of sphingosine 1-phosphate receptor 2 in bile-acid-induced cholangiocyte proliferation and cholestasis-induced liver injury in mice[J]. Hepatology, 2017, 65: 2005-2018. DOI:10.1002/hep.29076 |
| [27] |
NAKAMOTO K, SHIMADA K, HARADA S, MORIMOTO Y, HIRASAWA A, TOKUYAMA S. DHA supplementation prevent the progression of NASH via GPR120 signaling[J]. Eur J Pharmacol, 2018, 820: 31-38. DOI:10.1016/j.ejphar.2017.11.046 |
| [28] |
RAPTIS D A, LIMANI P, JANG J H, UNGETHÜM U, TSCHUOR C, GRAF R, et al. GPR120 on Kupffer cells mediates hepatoprotective effects of ω3-fatty acids[J]. J Hepatol, 2014, 60: 625-632. DOI:10.1016/j.jhep.2013.11.006 |
| [29] |
BAKER M A, NANDIVADA P, MITCHELL P D, FELL G L, PAN A, CHO B S, et al. Omega-3 fatty acids are protective in hepatic ischemia reperfusion injury in the absence of GPR120 signaling[J]. J Pediatr Surg, 2019, 54: 2392-2397. DOI:10.1016/j.jpedsurg.2019.04.003 |
 2022, Vol. 43
2022, Vol. 43


