2. 青岛大学附属烟台毓璜顶医院骨科,烟台 264000
2. Department of Orthopaedics, The Affiliated Yantai Yuhuangding Hospital of Qingdao University, Yantai 264000, Shandong, China
脊髓和神经高张力损伤一直以来被认为是外力牵引所致[1],除了脊髓栓系外,尚未有证据显示在人体脊髓系统中存在自发性神经高张力。然而在临床观察中,一些非外伤性神经损伤可能由神经高张力损伤导致,对于脊髓及神经高张力的研究正逐渐成为热点。通过分析神经高张力损伤动物模型相关文献发现,目前造模分析的主要研究方向在于间接发现脊髓血流的变化[2]和神经根张力的机械测定[3]。神经根张力测定仪器对神经根有机械性损伤,多用于尸体研究。而活体脊髓血流的监测目前主要采用放射自显影技术[4],该技术主要是通过观察14C安替比林从血管中渗出的程度判断局部血流情况,是一种间接的血流判定方法,其结果存在一定误差。因此,实验技术本身对于通过脊髓血流变化判定脊髓神经高张力损伤有着较明显的影响。
超声作为一种无创的检查手段,很早在脊柱外科就有应用[5]。由于成年人脊柱骨性结构的阻挡,目前经皮超声检查多应用于幼儿,但有越来越多的学者尝试在成人脊柱手术中应用超声观察和监测脊柱与脊髓[6-7]。然而脊柱和脊髓的超声监测集中在术中精准减压节段的判定和减压效果的评估,且主要为形态学变化的描述。超声造影剂的应用使超声下观察脊髓血流变化成为可能。
动物脊髓牵张模型建立的报道最早见于Dolan等[4]利用猫开展的实验,后来陆续有Dabney等[8]、黄平等[9]在雌性Long-Evans大鼠、日本大耳白兔等小型动物上进行脊髓牵张造模,这些实验主要观察动物脊髓牵张损伤后的运动功能、神经电生理指标、生物化学指标及组织形态学变化。目前未见关于大型哺乳动物脊髓张力变化情况下血流改变的研究报道。本研究借助最新的超声造影技术观察实验广西白猪脊髓不同张力情况下的血流变化,为人脊髓轴向高张力损伤研究提供新思路。
1 材料和方法 1.1 实验动物3头雄性广西白猪(巴马白猪的一种;动物合格证号为20150005003905)由上海甲干生物科技有限公司[实验动物生产许可证号为SCXK(沪)2015-0005]提供,3个月龄,体重分别为36、37和39 kg。实验动物正常饲养于实验室[实验动物使用许可证号为SYXK(沪)2020-0017],饲养及实验操作过程均遵守实验动物管理保护的规定。本研究获得海军军医大学(第二军医大学)第二附属医院实验动物研究伦理委员会审批(2020SL017)。本实验为探索类研究,受经费限制,无法获得更多实验猪,因此实验动物不分组,均接受相同的实验操作。
1.2 实验步骤采用氯胺酮15 mg/kg进行基础麻醉,气管插管后改为异氟烷吸入麻醉。麻醉生效后,留置导尿管,实验猪取俯卧位,将四肢捆绑固定于手术台上,碘伏消毒皮肤,手术区域铺单。实验猪均以L3为中点做后正中切口,依次切开皮肤、深筋膜后向两侧剥离椎旁肌肉。第一步,切除部分关节突及椎板,应用B型超声(Aplio 300,日本TOSHIBA公司)观察、记录形态学和血流动力学参数,观察指标包括硬脊膜直径、M波振幅、造影后血流。第二步,选取猪腰椎L3/4椎间隙,于L3及L4置入双侧椎弓根螺钉,连接棒固定后标记刻度,然后将椎弓根螺钉撑开5 mm并固定,通过超声测量形态学及血流动力学参数。第三步,将猪L3及L4的椎弓根螺钉根据原有刻度短缩5 mm并固定,应用超声测量形态学及血流动力学参数。根据伦理学要求,实验后对实验猪进行安乐死处理,不予唤醒。
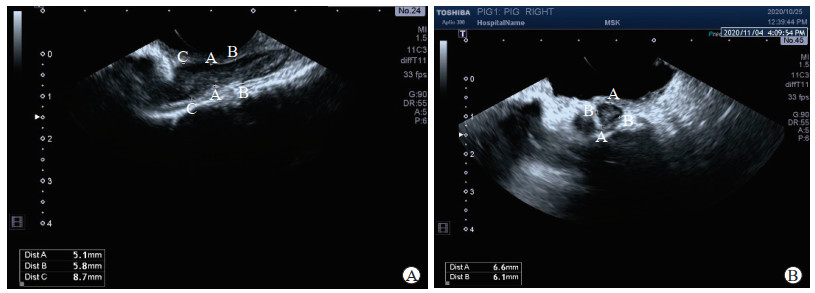
1.3 观察指标 1.3.1 猪脊髓形态学数据测量首先通过超声观察确认监测节段,在脊髓长轴面观察可以明确测量的节段,并在矢状面测量选定椎间盘层面的硬脊膜直径和该椎间盘层面近端5 mm及远端5 mm水平的硬脊膜直径(图 1A)。然后在保持探头无位移的情况下旋转90°测量横断面的硬脊膜直径,包括横断面上横轴及纵轴相互垂直的2个直径(图 1B)。
|
图 1 超声明确猪硬脊膜测量节段并记录硬脊膜直径 A:矢状面测量.线段A代表选定椎间盘层面的硬脊膜直径;线段B代表选定椎间盘层面近端5 mm水平的硬脊膜直径;线段C代表选定椎间盘层面远端5 mm水平的硬脊膜直径.B:横断面测量.线段A和B分别代表横断面上横轴及纵轴相互垂直的2个硬脊膜直径. |
1.3.2 猪脊髓的M波振幅测量
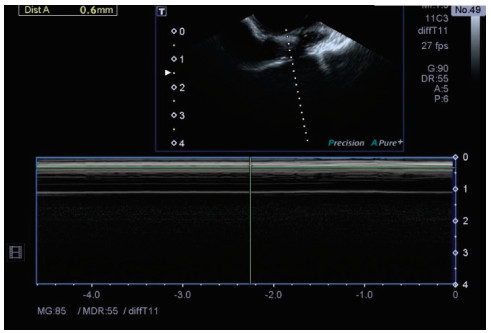
于选定椎间盘层面固定探头,打开M波模式,测量脊髓M波振幅(图 2)。
|
图 2 超声测量猪脊髓的M波振幅 图中斜虚线为探测方向. |
1.3.3 猪脊髓的血流测量
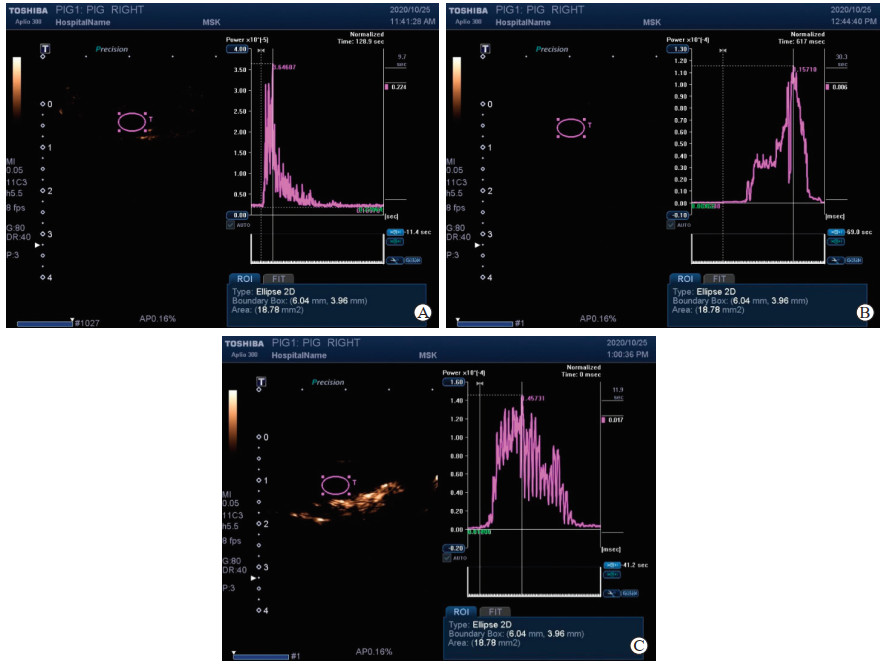
猪脊髓的血供主要来自脊髓背侧动脉和脊髓腹侧动脉发出的周缘支构成的血管网,血管网直径细小,在超声下显示为无回声,难以被检测到,因此血流测量需要进行猪脊髓造影。新一代的超声造影剂由六氟化硫微泡和磷脂包膜组成,体积小,不易破裂,不弥散至组织内,能产生丰富的谐波,易于成像,所以超声造影是监测微循环的首选手段[10]。具体操作:首先用探头确认责任节段后保持稳定,造影时控制猪血压平稳,取等量超声造影剂六氟化硫微泡(1 mL)静脉推注,探头保持同一平面并记录对应节段的血流变化情况。血流动力学数据通过超声仪自带软件分析,从而获得相应的强度-时间曲线(图 3),并分析以下指标。(1)曲线开始时间:自静脉注射造影剂开始到观察区域内出现超声造影剂的时间。(2)达峰时间:自静脉注射造影剂开始到观察区域内超声造影剂达到最高浓度的时间。(3)最大强度:观察区域内超声造影剂达到最高浓度所对应的超声强度值。(4)AUC:测量曲线下的面积,代表一段时间内组织血流灌注量。
|
图 3 超声测量的猪脊髓周围血流造影强度-时间曲线 A:初始状态下的脊髓周围血流造影强度-时间曲线;B:椎间隙撑开5 mm状态下的脊髓周围血流造影强度-时间曲线;C:椎间隙短缩5 mm状态下的脊髓周围血流造影强度-时间曲线.T(椭圆区域)代表测量区域. |
1.4 统计学处理应用SPSS
24.0软件进行数据分析。对所有的测量数据进行汇总,并采用配对t检验对椎间隙撑开、短缩状态下测量的数据与初始状态进行比较。检验水准(α)为0.05。
2 结果 2.1 猪脊髓形态学数据无论从横断面还是矢状面,均观察到撑开状态硬脊膜直径缩小,短缩状态硬脊膜直径增大,与初始状态相比差异均有统计学意义(P均<0.05)。见表 1。
|
|
表 1 3头实验猪脊髓不同张力下的实验数据 |
2.2 猪脊髓的M波振幅
与初始状态相比,猪脊髓的M波振幅在撑开状态下降低(P<0.05),而在短缩状态下增加(P<0.05)。见表 1。
2.3 猪脊髓的血流数据无论是在撑开还是短缩状态,猪脊髓周围血流的曲线开始时间和达峰时间均大于初始状态、最大强度均小于初始状态(P均<0.05)。在单位时间对应的猪脊髓周围血流AUC方面,在短缩状态AUC最大,在撑开状态AUC最小,与初始状态相比差异均有统计学意义(P均<0.05)。见表 1。
3 讨论在脊柱外科中脊髓和神经根张力研究的首位疾病是脊髓栓系综合征,通常认为脊髓栓系导致的脊髓和神经根张力异常增高是其症状出现的病理生理学基础。目前脊髓栓系综合征的治疗仍然非常棘手,常规的终丝松解手术治疗后仍然有复发病例。Kokubun等[11]在1995年证明了脊柱短缩手术对于脊髓栓系综合征的有效性。Grande等[12]在尸体研究中证明了骨性结构的短缩能达到松解脊髓和神经根的效果。本团队研究也发现,脊柱均匀短缩脊髓轴性减压术可缓解脊髓栓系综合征合并脊柱侧凸患者的脊髓轴向压力,恢复脊柱和脊髓的协调性[13]。
本团队在临床中经常见到脊柱退行性疾病患者的影像学压迫不严重但下肢神经根损伤症状严重,以及椎间盘突出患者术中采用了较大的椎间融合器撑开但术后出现更严重的神经根损伤症状的情况,这可能都与过高的脊髓和神经根张力有关,但是缺乏明确的证据支持。Singh等[14]采用静态和动态拉力牵拉大鼠腰骶神经根发现,牵拉时神经根像橡胶一样被拉长,同时横截面积逐渐减小,呈现一定弹性系数。电生理监测发现,随着神经根轴向牵引力增大神经传导速率降低、波幅下降,集合动作电位变小甚至消失,最终出现神经根传导阻滞[15]。当脊髓及神经根长期处于过度牵拉状态时其血流、代谢和电生理等会发生一系列改变,如周围血管变细、神经元缺氧、细胞内线粒体减少、ATP产生减少,从而使脊髓由机械性损伤发展为代谢性损伤并发生变性、坏死、软化、萎缩等病理变化,进而出现一系列神经功能损害的临床表现[16]。这些临床和基础实验结果都提示了脊髓和神经根高张力不仅仅存在于脊髓栓系综合征中,在其他脊柱疾病中也可能存在并会导致严重的临床症状,因此本团队提出了腰骶神经弓弦病的概念[17]。
如何发现和证实活体脊髓及神经根的高张力改变仍然是一个难题。截至目前神经张力测定的研究集中于尸体研究,对于人体活体研究尚未见报道。由于伦理的限制,不能直接应用机械仪器测定神经根张力。活体研究主要是通过14C安替比林放射自显影技术间接反映神经张力的变化。本实验的目的在于观察脊柱骨性结构撑开和短缩对于脊髓血流和活动度的影响,从而判断脊髓和神经张力改变与局部血流及搏动之间的关系。本实验通过超声造影技术测定实验猪椎间盘层面的局部血流,实现了活体状态下更精确的血流测定,能够精准反映脊髓及神经根张力的变化情况。
从实验数据分析来看,椎间隙被撑开5 mm时局部张力处于增高状态,硬脊膜和脊髓均被拉长,硬脊膜直径减小;椎间隙短缩5 mm时局部张力降低,硬脊膜直径增大,在物理学角度符合弹性模量的变化,因此认为先撑开后短缩对于最终短缩状态各参数的影响有限。
硬脊膜和脊髓被动拉长时,脊髓搏动幅度下降;硬脊膜和脊髓在短缩状态下,脊髓搏动幅度相对增大,这证实了神经高张力状态与脊髓生理搏动存在关联。
对脊髓周围血管造影的数据结果解读颇为复杂,由于条件所限,无法确定先撑开后短缩对最后短缩状态数据的测量有无影响,只能进行自身对照。通过统计学分析,在短缩状态脊髓周围血流AUC最大,而撑开状态AUC最小,说明脊髓张力改变与血流AUC相关。推测原因可能是脊髓周围血管由于张力增高被拉长,血管变细,局部流量减少;而脊髓张力降低时,血管直径增大,血流量增加。不同状态其他客观指标(曲线开始时间、达峰时间、最大强度)差异有统计学意义,但数据变化趋势与传统血流数据变化不符合,因此不能作为判断脊髓张力改变的指标。
超声造影技术目前最大的缺陷仍然是不能直接反映人脊髓及神经根张力,而且神经根局部血流在人体内可能存在诸多影响因素。从理论上推断神经根受到牵拉后,周围的微血管同样因张力被拉长,局部血流量减少,但是这种情况是否存在线性对应关系不得而知。本实验为应用超声造影技术在实验猪脊髓血流测量中的探索性研究,因客观条件限制无法获得大量样本进行实验,研究结果也仅为人体的脊髓和神经根张力研究提供一个新的思路。
| [1] |
FRIED L C. Cervical spinal cord injury during skeletal traction[J]. JAMA, 1974, 229: 181-183. DOI:10.1001/jama.1974.03230400043030 |
| [2] |
DOMMISSE G F. The blood supply of the spinal cord. A critical vascular zone in spinal surgery[J]. J Bone Joint Surg Br, 1974, 56: 225-235. |
| [3] |
SAFAIN M G, BURKE S M, RIESENBURGER R I, ZERRIS V, HWANG S W. The effect of spinal osteotomies on spinal cord tension and dural buckling: a cadaveric study[J]. J Neurosurg Spine, 2015, 23: 120-127. DOI:10.3171/2014.11.SPINE14877 |
| [4] |
DOLAN E J, TRANSFELDT E E, TATOR C H, SIMMONS E H, HUGHES K F. The effect of spinal distraction on regional spinal cord blood flow in cats[J]. J Neurosurg, 1980, 53: 756-764. DOI:10.3171/jns.1980.53.6.0756 |
| [5] |
NAIDICH T P, FERNBACH S K, MCLONE D G, SHKOLNIK A. Sonography of the caudal spine and back: congenital anomalies in children[J]. AJR Am J Roentgenol, 1984, 142: 1229-1242. DOI:10.2214/ajr.142.6.1229 |
| [6] |
IMAMURA H, IWASAKI Y, HIDA K, CHO K H, ABE H. Intraoperative spinal sonography in the cervical anterior approach[J]. Neurol Med Chir (Tokyo), 1995, 35: 144-147. DOI:10.2176/nmc.35.144 |
| [7] |
TIAN W, WENG C, LIU B, LI Q, SUN YQ, YUAN Q, et al. Intraoperative 3-dimensional navigation and ultrasonography during posterior decompression with instrumented fusion for ossification of the posterior longitudinal ligament in the thoracic spine[J/OL]. J Spinal Disord Tech, 2013, 26: E227-E234. DOI: 10.1097/BSD.0b013e318286ba39.
|
| [8] |
DABNEY K W, EHRENSHTEYN M, AGRESTA C A, TWISS J L, STERN G, TICE L S, et al. A model of experimental spinal cord trauma based on computer-controlled intervertebral distraction: characterization of graded injury[J]. Spine (Phila Pa 1976), 2004, 29: 2357-2364. DOI:10.1097/01.brs.0000143108.65385.74 |
| [9] |
黄平, 邹国耀, 邹志远. 置入内固定装置轻度持续性牵张对兔脊髓的潜在损伤[J]. 中国组织工程研究与临床康复, 2011, 15: 695-698. |
| [10] |
SCHNEIDER M, ARDITI M, BARRAU M B, BROCHOT J, BROILLET A, VENTRONE R, et al. BR1: a new ultrasonographic contrast agent based on sulfur hexafluoride-filled microbubbles[J]. Invest Radiol, 1995, 30: 451-457. DOI:10.1097/00004424-199508000-00001 |
| [11] |
KOKUBUN S, OZAWA H, AIZAWA T, LY N M, TANAKA Y. Spine-shortening osteotomy for patients with tethered cord syndrome caused by lipomyelomeningocele[J]. J Neurosurg Spine, 2011, 15: 21-27. DOI:10.3171/2011.2.SPINE10114 |
| [12] |
GRANDE A W, MAHER P C, MORGAN C J, CHOUTKA O, LING B C, RADERSTORF T C, et al. Vertebral column subtraction osteotomy for recurrent tethered cord syndrome in adults: a cadaveric study[J]. J Neurosurg Spine, 2006, 4: 478-484. DOI:10.3171/spi.2006.4.6.478 |
| [13] |
徐锡明, 孙璟川, 王元, 孙凯强, 朱健, 孔庆捷, 等. 脊柱均匀短缩脊髓轴性减压术治疗脊髓栓系综合征合并脊柱侧凸的疗效分析[J]. 第二军医大学学报, 2020, 41: 266-271. |
| [14] |
SINGH A, LU Y, CHEN C, CAVANAUGH J M. Mechanical properties of spinal nerve roots subjected to tension at different strain rates[J]. J Biomech, 2006, 39: 1669-1676. DOI:10.1016/j.jbiomech.2005.04.023 |
| [15] |
SINGH A, KALLAKURI S, CHEN C, CAVANAUGH J M. Structural and functional changes in nerve roots due to tension at various strains and strain rates: an in-vivo study[J]. J Neurotrauma, 2009, 26: 627-640. DOI:10.1089/neu.2008.0621 |
| [16] |
YAMADA S, WON D J, PEZESHKPOUR G, YAMADA B S, YAMADA S M, SIDDIQI J, et al. Pathophysiology of tethered cord syndrome and similar complex disorders[J/OL]. Neurosurg Focus, 2007, 23: E6. DOI: 10.3171/FOC-07/08/E6.
|
| [17] |
SHI J G, XU X M, SUN J C, WANG Y, KONG Q J, SHI G D. Theory of bowstring disease: diagnosis and treatment bowstring disease[J]. Orthop Surg, 2019, 11: 3-9. DOI:10.1111/os.12417 |
 2022, Vol. 43
2022, Vol. 43


