海军舰载机飞行的技术难度大,飞行事故发生率高。在发生飞行事故时,飞行员会通过海面迫降或跳伞入海的方式将事故危及范围缩减到最小。然而,研究表明跳伞时的冲击力因作用于骨骼而使开放性骨折的发生风险升高[1]。飞行员坠入海水导致开放性骨折处浸泡在海水中,从而发生特殊环境下的骨折。海水具有高渗、碱性、含有特殊细菌、低温等特点,并含有大量无机盐,其钠、氯离子浓度为人体血浆的4~5倍,渗透压为血浆的5~6倍[2]。海洋细菌具有特殊性,这使得骨折后继发感染的细菌、感染特点和程度均不同于普通开放性骨折后感染[3]。因此,海水浸泡后开放性骨折的愈合过程有别于普通骨折。
海水冲溺伤骨折(bone fracture with seawater immersion,BFSI)是指在海战时躯干或肢体受到冲击力作用而发生的开放性骨折,其骨折断端在海水中浸泡导致一系列局部或全身反应。BFSI患者骨折断端在海水中浸泡会导致愈合过程中出现过度炎症反应和氧化应激等,从而使骨折愈合延迟甚至骨折不愈合。在BFSI中,骨折局部炎症反应加重会导致破骨细胞过度激活,影响早期骨折愈合过程,还会导致愈合的骨骼抵抗应力能力降低。有研究报道,常规清创、骨折固定术、抗感染治疗能一定程度减少海水浸泡骨折愈合延迟或不愈合的发生,但愈合延迟或不愈合的发生率仍高达30%[4]。因此,在常规骨折治疗基础上,探索一种能促进BFSI愈合的治疗方法对于舰载机飞行员发生BFSI后的康复有重大意义。
传统中药冬凌草的主要有效成分冬凌草甲素(oridonin,Ori)是一种以异戊二烯为基本骨架的四环二萜类化合物[5],具有抗多种肿瘤的生物学活性[6]。近年来,人们逐渐认识到Ori强大的抗炎活性、促成骨及抑制破骨的作用,其可通过抑制NOD样受体热蛋白结构域相关蛋白3炎症小体减少炎症因子释放、抑制细胞焦亡等,从而发挥抗炎活性[7];还能通过促进骨形成和抑制骨吸收有效预防骨丢失,从而促进骨折愈合[8]。Ori对BFSI愈合的影响尚未见报道。本研究通过检测BFSI模型小鼠在Ori作用后骨痂组织中巨噬细胞极化状态的改变和炎症因子水平的表达,以及骨痂组织中凋亡相关因子的表达水平,探究Ori对发生BFSI后骨痂形成和生物力学作用的影响。
1 材料和方法 1.1 实验动物及分组6~8周龄雄性C57BL/6小鼠72只购自杭州医学院[实验动物生产许可证号SCXK(浙)2019-0002],饲养于23 ℃动物饲养专用实验室,12 h光/暗循环,自由进食、饮水。将小鼠随机分为骨折(BF)组、骨折+冬凌草甲素(BF+Ori)组、冲溺伤骨折(BFSI)组和冲溺伤骨折+冬凌草甲素(BFSI+Ori)组,每组18只。
1.2 动物模型建立BF、BF+Ori、BFSI、BFSI+Ori组小鼠均予异氟烷吸入麻醉,手术暴露双侧股骨中段,用骨钳造成右侧股骨中段骨折,克氏针插入骨髓腔内。BF组和BF+Ori组双侧暴露伤口予以旷置3 h,BFSI组和BFSI+Ori组双侧暴露伤口均浸泡于20 ℃海水3 h[海水取自中国东海表层海水(0~0.5 m,地理坐标在东经122°28′29″、北纬29°33′8″ 1 km范围内),并进行20 ℃预冷恒温处理]。旷置或浸泡结束后用生理盐水冲洗、碘伏浸泡消毒伤口,逐层缝合肌肉和皮肤。术后当天,BF+Ori组和BFSI+Ori组小鼠予Ori腹腔注射(20 mg·kg-1·d-1),至处死小鼠取标本前1 d停止,分别于术后7、14、21 d获取各组随机6只小鼠的右侧股骨标本。
1.3 X线片检查各组分别在术后14 d随机取6只小鼠,拍摄1次右侧股骨X线片。采用5分放射学评分系统[9]评估骨折愈合情况。
1.4 股骨机械强度试验术后21 d,通过机械强度试验检测每组6只小鼠的股骨骨折后抗机械力性能。在机械测试前,将股骨两端分别嵌入聚甲基丙烯酸甲酯中以确保样本固定在正确的位置和方向,实验仪器采用扭力弹簧测力机(济南凯恩试验机制造有限公司)。
1.5 qPCR检测各组分别于术后14 d取6只拍摄股骨X线片小鼠的骨痂标本,部分标本使用HiPure总RNA提取试剂盒(上海迈跟生物科技有限公司),根据说明书操作指南提取骨痂组织总RNA。使用两步法qPCR预混液试剂盒(货号R323-01,南京诺唯赞生物科技股份有限公司)进行反转录,反应体系为20 μL。在ABI-7500实时PCR系统(美国Applied Biosystems公司)上使用通用型高灵敏度染料法定量PCR检测试剂盒(货号Q711-02,南京诺唯赞生物科技股份有限公司)进行qPCR。采用2-ΔΔCt法计算目的基因的相对表达量。引物序列如下:诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)上游引物序列为5'-CTGGCAAGCCCAAGGTCTAT-3',下游引物序列为5'-GGAGGCTCCGATCAATCCAG-3';环氧合酶2(cyclooxygenase 2,COX2)上游引物序列为5'-TGAGCATCTACGGTTTGCTG-3',下游引物序列为5'-TGCTTGTCTGGAACAACTGC-3';IL-1β上游引物序列为5'-TGACTTCACCATGGA-ACCCG-3',下游引物序列为5'-GACCTGACTTG-GCAGAGGAC-3';cleaved caspase 3上游引物序列为5'-TGGGACTGATGAGGAGA-3',下游引物序列为5'-ACTGGATGAACCACGAC-3';Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)上游引物序列为5'-GCGAATTGGAGATGAACTGG-3',下游引物序列为5'-GTGAGCGAGGCGGTGAGG-AC-3';Bcl-2上游引物序列为5'-GGTGGGGTC-ATGTGTGTGG-3',下游引物序列为5'-CAGCGG-TAGGTGTCGAAGC-3';CD206上游引物序列为5'-CAAGCGATGTGCCTACC-3',下游引物序列为5'-AATGCTGTGGATACTTGCC-3';GAPDH上游引物序列为5'-CCTTCCGTGTTCCTAC-3',下游引物序列为5'-GACAACCTGGTCCTCA-3'。
1.6 蛋白质印迹法采用蛋白质印迹法检测各组小鼠术后14 d获取的另一部分骨痂标本。用RIPA裂解液(上海碧云天生物技术有限公司)提取骨痂组织总蛋白质,采用BCA蛋白测定试剂盒(上海碧云天生物技术有限公司)进行定量分析。取等量的蛋白质经10% SDS-PAGE分离,然后转移到PVDF膜(美国Millipore公司)。用含5%脱脂牛奶的TBST在25 ℃封闭2 h,然后分别加入iNOS一抗(英国Abcam公司,货号ab178945)、CD206一抗(美国CST公司,货号24595)、COX2一抗(美国CST公司,货号12282)、IL-1β一抗(英国Abcam公司,货号ab254360)、Bcl-2一抗(成都正能生物技术有限责任公司,货号381702)、Bax一抗(成都正能生物技术有限责任公司,货号200958)、cleaved caspase 3一抗(美国CST公司,货号9664)、GAPDH一抗(美国CST公司,货号5174)稀释液(稀释比例均为1∶500)于4 ℃孵育过夜。用PBS清洗3次,每次5 min。孵育对应物种二抗。免疫标记检测使用天能成像系统(上海天能科技有限公司)。采用ImageJ软件分析结果。
1.7 抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色各组分别于术后7 d取6只小鼠股骨,采用快速钙液进行脱钙,缺血骨组织切片。切片经二甲苯Ⅰ、Ⅱ脱蜡各5 min,随后经无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇Ⅰ、95%乙醇Ⅱ、80%乙醇逐步水化(各5 min),然后水洗3 min。用TRAP染色液(中国塞维尔生物科技有限公司,货号G1050-50T)于37 ℃避光浸染3 h,用蒸馏水充分水洗;苏木精复染1 min,蒸馏水充分水洗;最后切片经梯度乙醇(80%乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、无水乙醇Ⅱ、无水乙醇Ⅰ)逐步脱水,二甲苯透明,中性树胶封片,置于45 ℃烤片机中烤片1 h。光镜下随机选择3个视野,观察破骨细胞数量。采用ImageJ软件分析结果。
1.8 统计学处理应用SPSS 25.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用方差分析,然后进行方差齐性检验,如果方差齐,多重比较采用最小显著性差异法;如果方差不齐则采用Tamhane's T2检验。检验水准(α)为0.05。
2 结果 2.1 Ori促进BFSI愈合Ori干预过程中小鼠均未发生不良事件,X线片显示BF组与BF+Ori组小鼠骨痂情况相近,BFSI组小鼠骨痂比BF组少,而BFSI+Ori组小鼠骨痂较多(图 1A)。在X线片中,5分放射学评分系统分析结果(图 1B)显示,BFSI组评分低于BF组(P<0.01),表明海水浸泡使小鼠骨折愈合延迟;BFSI+Ori组小鼠评分较BFSI组升高(P<0.01),表明Ori能够较为明显地促进BFSI愈合。力学测试结果(图 1C)显示,BFSI+Ori组小鼠股骨能够比BFSI组小鼠股骨承受更大的扭转力(P<0.01)。以上结果表明,Ori能够促进BFSI小鼠骨折愈合,有利于小鼠股骨功能的恢复。
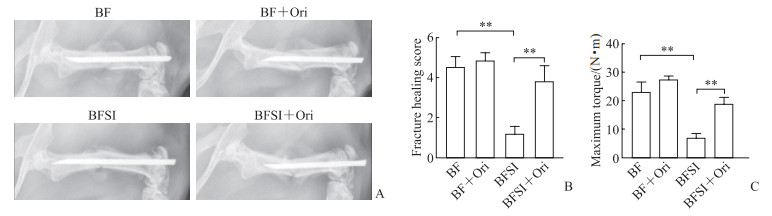
|
图 1 Ori促进BFSI模型小鼠骨折愈合 Fig 1 Ori promotes fracture healing in BFSI mice A: X-ray films of mice 14 d after fracture. Callus in the BFSI group was less than that in the BF group, and callus in the BFSI+Ori group was more than that in the BFSI group. B: Radiographic fracture healing scores. C: Biomechanical test of the healing fractures. **P < 0.01. n=6, x±s. Ori: Oridonin; BFSI: Bone fracture with seawater immersion; BF: Bone fracture. |
2.2 Ori改变BFSI骨痂组织巨噬细胞极化状态并减轻炎症反应
qPCR和蛋白质印迹法检测结果(图 2)显示,BFSI组小鼠骨痂组织中M1型巨噬细胞标志分子iNOS、M2型巨噬细胞标志分子CD206、炎症因子COX2和IL-1β的mRNA和蛋白表达与BF组相比均升高(P<0.05,P<0.01);而BFSI+Ori组小鼠骨痂组织中iNOS、COX2和IL-1β的mRNA和蛋白表达相较于BFSI组均降低,CD206的mRNA和蛋白表达则进一步升高(P<0.05,P<0.01)。以上结果表明,Ori能够降低BFSI小鼠骨痂组织中促炎性的M1巨噬细胞极化和炎症反应,并增强抗炎性的M2巨噬细胞极化。
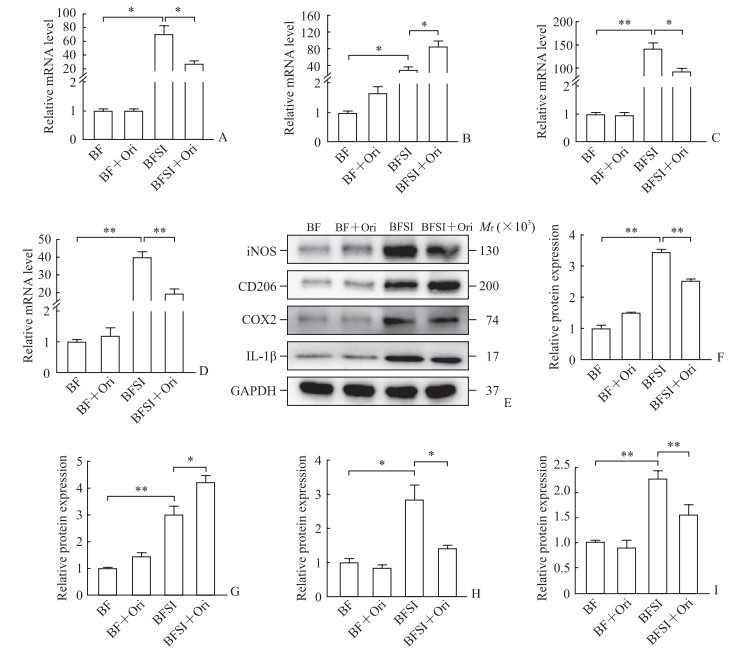
|
图 2 Ori改变BFSI模型小鼠骨痂组织中巨噬细胞极化状态并减轻炎症反应 Fig 2 Ori alters polarization of macrophages and alleviates inflammation in callus tissues of BFSI mice A-D: mRNA expression of iNOS (a marker of M1 macrophages, A), CD206 (a marker of M2 macrophages, B), and inflammatory factors COX2 (C) and IL-1β (D) detected by quantitative polymerase chain reaction; E: Representative Western blotting images; F-I: Relative protein expression of iNOS (F), CD206 (G), COX2 (H), and IL-1β (I) detected by Western blotting. *P < 0.05, **P < 0.01. n=6, x±s. Ori: Oridonin; BFSI: Bone fracture with seawater immersion; BF: Bone fracture; iNOS: Inducible nitric oxide synthase; COX2: Cyclooxygenase 2; IL-1β: Interleukin 1β; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.3 Ori减轻BFSI骨痂组织细胞凋亡
qPCR和蛋白质印迹法检测结果(图 3)显示,与BF组相比,BFSI组小鼠骨痂组织中促凋亡因子cleaved caspase 3、Bax的mRNA和蛋白表达水平均升高,抗凋亡因子Bcl-2的mRNA和蛋白表达水平降低(P均<0.01);而BFSI+Ori组小鼠骨痂组织中cleaved caspase 3、Bax的mRNA和蛋白表达水平与BFSI组相比均降低,Bcl-2的mRNA和蛋白表达水平与BFSI组相比均升高(P<0.05,P<0.01)。这一结果表明Ori能够减轻BFSI骨痂组织细胞凋亡,从而促进骨折愈合。
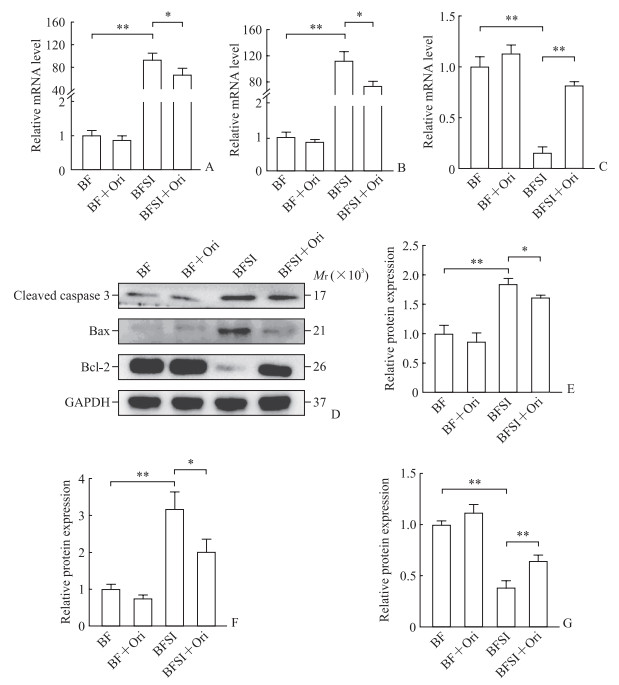
|
图 3 Ori减轻BFSI模型小鼠骨痂组织细胞凋亡 Fig 3 Ori alleviates cell apoptosis in callus tissues of BFSI mice A-C: mRNA expression of pro-apoptotic factors cleaved caspase 3 (A) and Bax (B) and anti-apoptotic factor Bcl-2 (C) detected by quantitative polymerase chain reaction; D: Representative Western blotting images; E-G: Relative protein expression of cleaved caspase 3 (E), Bax (F), and Bcl-2 (G) detected by Western blotting. *P < 0.05, **P < 0.01. n=6, x±s. Ori: Oridonin; BFSI: Bone fracture with seawater immersion; BF: Bone fracture; Bax: Bcl-2-associated X protein; Bcl-2: B-cell lymphoma 2; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.4 Ori抑制BFSI骨折早期破骨细胞过度激活
TRAP染色结果(图 4)显示与BF组相比,BFSI组小鼠软骨-骨边界附近有更多的破骨细胞,而BFSI+Ori组的破骨细胞数量则较BFSI组低(P均<0.01)。这一结果表明Ori能够在BFSI恢复早期抑制过多的破骨细胞产生,有利于骨折愈合。
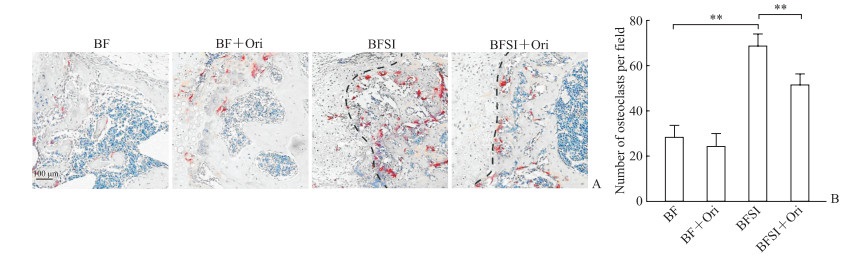
|
图 4 Ori抑制BFSI模型小鼠骨折早期破骨细胞过度激活 Fig 4 Ori curbs overactivation of osteoclasts in early stage of fracture in BFSI mice A: Representative TRAP staining images; B: Quantitative analysis of the osteoclasts. **P < 0.01. n=6, x±s. Ori: Oridonin; BFSI: Bone fracture with seawater immersion; BF: Bone fracture; TRAP: Tartrate-resistant acid phosphatase. |
3 讨论
在现代战争中,BFSI是重要伤情,如何救治此类病例、降低伤残率是一项重要且有挑战的任务。尽早手术清创及大剂量使用广谱抗生素能在很大程度上降低BFSI患者感染率,能治愈大多数患者,但仍有部分患者骨折愈合延迟甚至骨折不愈合,本研究在动物实验中也证明了这一点。因此,需要探索一种具有良好促进BFSI愈合作用的药物。Ori是从植物中分离出来的一种有生物活性的天然物质,具有抑制骨肿瘤进展[10]及抗炎、促进成骨、抑制骨质吸收等作用[8, 11-12],其对BFSI愈合的影响尚未见报道。本实验检测了Ori对BFSI愈合的影响,结果显示BFSI组骨痂少于BF组,而Ori能改善BFSI愈合情况。
普遍认为,炎症反应在骨折最初的血肿炎症机化期募集多种免疫细胞(如巨噬细胞、中性粒细胞等)以抵抗病菌的入侵,有利于骨折愈合,随着骨痂开始形成炎症反应逐步减弱。但是,BFSI会产生不可控制的炎症反应,激活大量破骨细胞,并导致成骨细胞和软骨细胞凋亡[13-14]。
巨噬细胞是参与骨折愈合炎症反应的关键细胞,促炎性的M1型巨噬细胞和抗炎性的M2型巨噬细胞相互平衡,促进骨折愈合[15]。如M1型巨噬细胞过度激活将导致过度的炎症反应,不利于骨折愈合[16]。本实验检测了骨痂组织中M1和M2型巨噬细胞标志分子及炎症因子的表达水平,结果表明Ori能够促进小鼠发生BFSI后M2型巨噬细胞极化,抑制M1型巨噬细胞极化和炎症因子表达。Ori通过适当降低骨折断端炎症水平,发挥了促进骨折愈合的作用。
严重炎症反应会增加骨折断端细胞的凋亡,较高的凋亡水平会导致骨折愈合延迟[17],因此,本实验检测了BFSI骨痂组织中凋亡相关因子的表达。结果显示,BFSI小鼠骨痂组织中凋亡相关基因表达增多、抗凋亡基因表达减少,而Ori逆转了这种表达模式,提示Ori可能通过缓解BFSI愈合过程中的细胞凋亡促进骨折愈合。本实验中Ori在BFSI中抑制细胞凋亡的作用与其在急性肝损伤、心肌缺血损伤等疾病中的作用[18]相似。但在恶性肿瘤中,Ori能够通过诱导或促进肿瘤细胞凋亡达到治疗目的[19]。因此,可以推断Ori在肿瘤组织中促进恶性细胞凋亡而在BFSI等疾病中抑制细胞凋亡,从而发挥其保护效应。
骨折愈合过程包括成骨细胞为主的骨形成和破骨细胞为主的骨吸收。破骨细胞是使人体骨质溶解的唯一细胞,但成骨细胞也可促进破骨细胞的激活和骨吸收作用的发挥[20]。破骨细胞的过度激活会加速骨质吸收,阻碍骨痂形成,不利于早期的骨折愈合[21]。本实验也分析了破骨细胞的激活状态,结果表明Ori降低了骨折愈合过程中破骨细胞的过度激活,有利于改善骨折愈合延迟或不愈合状态,与既往报道结果[8]类似。
综上所述,本研究结果表明中药提取物Ori能够增强抗炎性的M2型巨噬细胞极化、抑制促炎性的M1型巨噬细胞极化,减轻骨折后的炎症反应,减少细胞凋亡,抑制破骨细胞过度激活,促进BFSI的愈合,有利于骨痂的形成,增强BFSI发生后的骨组织对机械力的抵抗能力,这为Ori应用于海战BFSI治疗提供了实验依据。但本实验主要针对BFSI愈合过程中炎症、细胞凋亡等的变化,引起相关表型改变的可能信号通路尚待进一步研究。
| [1] |
谢雄, 梁波, 臧蕴. 跳伞致脊柱压缩性骨折568例[J]. 中华创伤杂志, 1999, 15: 307-308. DOI:10.3760/j:issn:1001-8050.1999.04.024 |
| [2] |
林建宁, 阮狄克. 海水浸泡对开放性骨折组织修复的影响研究[J]. 人民军医, 2009, 52: 15-16. |
| [3] |
韩善桥, 虞积耀, 姜涛, 王大鹏. 创伤合并海水浸泡动物感染实验研究[J]. 实用预防医学, 2011, 18: 1533-1535. DOI:10.3969/j.issn.1006-3110.2011.08.066 |
| [4] |
胡旭, 吴灼金, 杨永林. 四肢开放性骨折海水浸泡后的治疗[J]. 海军医学杂志, 2010, 31: 234-236. DOI:10.3969/j.issn.1009-0754.2010.03.019 |
| [5] |
王申, 耿庆贺, 还涵, 廖瑞霈, 吴新贵. 冬凌草甲素对雄激素缺乏诱导的大鼠骨质疏松症的影响[J]. 江苏医药, 2020, 46: 217-220. |
| [6] |
XU L H, BI Y L, XU Y Z, ZHANG Z C, XU W J, ZHANG S S, et al. Oridonin inhibits the migration and epithelial-to-mesenchymal transition of small cell lung cancer cells by suppressing FAK-ERK1/2 signalling pathway[J]. J Cell Mol Med, 2020, 24: 4480-4493. DOI:10.1111/jcmm.15106 |
| [7] |
XU L, LI L, ZHANG C Y, SCHLUESENER H, ZHANG Z Y. Natural diterpenoid oridonin ameliorates experimental autoimmune neuritis by promoting anti-inflammatory macrophages through blocking Notch pathway[J/OL]. Front Neurosci, 2019, 13: 272. DOI: 10.3389/fnins.2019.00272.
|
| [8] |
ZOU B H, TAN Y H, DENG W D, ZHENG J H, YANG Q, KE M H, et al. Oridonin ameliorates inflammation-induced bone loss in mice via suppressing DC-STAMP expression[J]. Acta Pharmacol Sin, 2021, 42: 744-754. DOI:10.1038/s41401-020-0477-4 |
| [9] |
SHUID A N, MOHAMAD S, MUHAMMAD N, FADZILAH F M, MOKHTAR S A, MOHAMED N, et al. Effects of α-tocopherol on the early phase of osteoporotic fracture healing[J]. J Orthop Res, 2011, 29: 1732-1738. DOI:10.1002/jor.21452 |
| [10] |
陈功森, 倪健, 罗菊元, 曲昌海, 尹兴斌. 基于CNKI的冬凌草甲素研究文献计量学分析[J]. 中国中医药信息杂志, 2019, 26: 104-109. |
| [11] |
ZHOU L, HUANG Y K, ZHAO J L, YANG H L, KUAI F. Oridonin promotes osteogenesis through Wnt/β-catenin pathway and inhibits RANKL-induced osteoclastogenesis in vitro[J/OL]. Life Sci, 2020, 262: 118563. DOI: 10.1016/j.lfs.2020.118563.
|
| [12] |
JIA T, CAI M M, MA X, LI M, QIAO J T, CHEN T X. Oridonin inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by activating PPAR-γ[J]. Int Immunopharmacol, 2019, 69: 382-388. DOI:10.1016/j.intimp.2019.01.049 |
| [13] |
TONG X S, GANTA R R, LIU Z P. AMP-activated protein kinase (AMPK) regulates autophagy, inflammation and immunity and contributes to osteoclast differentiation and functionabs[J]. Biol Cell, 2020, 112: 251-264. DOI:10.1111/boc.202000008 |
| [14] |
ZHANG T, ZHAO K X, HAN W Q, YANG W L, LU X Y, LIU Q, et al. Deguelin inhibits RANKL-induced osteoclastogenesis in vitro and prevents inflammation-mediated bone loss in vivo[J]. J Cell Physiol, 2019, 234: 2719-2729. DOI:10.1002/jcp.27087 |
| [15] |
SCHLUNDT C, EL KHASSAWNA T, SERRA A, DIENELT A, WENDLER S, SCHELL H, et al. Macrophages in bone fracture healing: their essential role in endochondral ossification[J]. Bone, 2018, 106: 78-89. DOI:10.1016/j.bone.2015.10.019 |
| [16] |
HUANG R, VI L, ZONG X H, BAHT G S. Maresin 1resolves aged-associated macrophage inflammation to improve bone regeneration[J]. FASEB J, 2020, 34: 13521-13532. |
| [17] |
SUN Y, XIONG Y, YAN C C, CHEN L, CHEN D, MI B B, et al. Downregulation of microRNA-16-5p accelerates fracture healing by promoting proliferation and inhibiting apoptosis of osteoblasts in patients with traumatic brain injury[J]. Am J Transl Res, 2019, 11: 4746-4760. |
| [18] |
DENG Y L, CHEN C, YU H G, DIAO H, SHI C C, WANG Y G, et al. Oridonin ameliorates lipopolysaccharide/D-galactosamine-induced acute liver injury in mice via inhibition of apoptosis[J]. Am J Transl Res, 2017, 9: 4271-4279. |
| [19] |
GAO S Y, TAN H X, ZHU N, GAO H Y, LV C Y, GANG J, et al. Oridonin induces apoptosis through the mitochondrial pathway in human gastric cancer SGC-7901 cells[J]. Int J Oncol, 2016, 48: 2453-2460. |
| [20] |
QUINN J M, GILLESPIE M T. Modulation of osteoclast formation[J]. Biochem Biophys Res Commun, 2005, 328: 739-745. |
| [21] |
LOI F, CÓRDOVA L A, PAJARINEN J, LIN T H, YAO Z Y, GOODMAN S B. Inflammation, fracture and bone repair[J]. Bone, 2016, 86: 119-130. |
 2022, Vol. 43
2022, Vol. 43


