2. 上海中医药大学针灸推拿学院实验针灸教研室,上海 201203;
3. 复旦大学航空航天系上海市针灸机制与穴位功能重点实验室,上海 200433;
4. 上海中医药大学针灸推拿学院经络腧穴教研室,上海 201203;
5. 上海市针灸经络研究中心,上海 201203
2. Experimental Acupuncture Office, Acupuncture and Moxibustion College, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
3. Shanghai Key Laboratory of Acupuncture Mechanism and Acupoint Function, Department of Aeronautics and Astronautics, Fudan University, Shanghai 200433, China;
4. Meridian and Acupoint Office, Acupuncture and Moxibustion College, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
5. Shanghai Research Center for Acupuncture and Meridians, Shanghai 201203, China
疲劳是一种因过度劳累而导致身体不适的主观感受,严重影响着人们的生活质量和工作效率。疲劳按发生性质可分为生理性疲劳和病理性疲劳。生理性疲劳常表现为乏力倦怠、四肢酸痛和思想难以集中等症状;病理性疲劳包括独立的疾病如疲劳长期累积可发展成慢性疲劳综合征(chronic fatigue syndrome,CFS),或是某些疾病如癌症、抑郁症和多发性硬化症等引发的疲劳症状;生理性疲劳可在休息后恢复,病理性疲劳无法通过休息缓解[1]。最新的meta分析结果显示,中国人群CFS的患病率为12.54%,其中30~40岁人群的患病率达21.57%[2]。现有的药物疗法对伴有多个症状的CFS改善有限[3]。因此,积极研究抗疲劳药物对防治疲劳、降低社会医疗经济负担有着重要意义。嘌呤能信号具有多种功能,在神经传递、神经分泌和细胞再生中均发挥作用[4],近年来越来越多的研究支持其参与疲劳调节。研究表明,浓度依赖性嘌呤能受体激活可影响疲劳的进展,而不同类型的胞外核苷酸酶正是精准控制嘌呤物质比例的关键。由于疲劳发生的复杂性,目前对于这类物质参与疲劳发展的作用和机制尚不完全清楚。本文归纳了嘌呤能信号和胞外核苷酸酶对多种原发疲劳状态包括运动后疲劳和CFS的调节,并探讨了中医药抗疲劳的可能机制,以期为疲劳发病机制的进一步研究及有效防治提供依据。
1 嘌呤能信号及其在疲劳中的作用 1.1 嘌呤能信号物质组成嘌呤能信号的概念最早于1972年提出[5],其组成包括ATP和其水解产物及相应的受体。细胞内ATP主要作用于躯体能量需求过程,如主动运输和生物合成,而细胞外ATP作为重要信号分子,其作用包括有效神经传递、神经元-胶质细胞相互作用、免疫反应和控制等[6]。器官损伤、创伤性休克或某些炎症条件均可导致细胞ATP从胞内向胞外释放。胞外ATP在胞外核苷酸酶作用下水解,依次产生腺苷二磷酸(adenosine diphosphate,ADP)、腺苷一磷酸(adenosine monophosphate,AMP)和腺苷。ATP和ADP浓度依赖性激活P2受体,根据其信号转导机制可分为离子型P2X受体和代谢型P2Y受体。迄今为止,在哺乳动物中已鉴定出7种P2X受体亚型和8种P2Y受体亚型。腺苷则激活代谢型P1受体,可分为A1、A2A、A2B和A3等4个亚型。
1.2 嘌呤能信号与疲劳 1.2.1 ATP/ADP和嘌呤能P2受体ATP能量代谢障碍广泛存在于急、慢性疲劳患者中,并与疾病的严重程度相关,ATP的检测可用于CFS临床管理[7]。ATP代谢异常主要表现为ATP合成减少。有研究者发现,ATP生成受损不仅可导致患者疲劳和运动后不适,还会引起整体的代谢异常(如葡萄糖代谢减退和脑灌注不足)[8]。提前口服ATP可预防运动性ATP及其代谢产物的下降,提高峰值功率和肌肉兴奋性,减轻运动后不适[9]。然而,给予健康受试者肌内注射正常运动代谢物包括质子、乳酸和ATP的组合,可能通过剂量依赖的方式激活感觉神经元P2X受体,导致疲劳感[10]。由此可见,ATP胞内合成障碍和胞外释放可能共同构成了疲劳感觉的产生。
在细胞外,ATP主要通过激活嘌呤能P2受体发挥作用。多项临床研究和动物实验表明,P2X受体亚型特别是P2X4、P2X5和P2X7的激活可以调节疲劳[11-17]。CFS患者基础P2X4、P2X5基因表达水平高于正常受试者[11-12]。在持续中等强度运动后,CFS患者静脉血代谢受体检测结果显示P2X4、P2X5基因表达水平较对照组升高,持续0.5~48 h,并与患者身体疲劳、精神疲劳和疼痛的症状呈高度正相关[13]。与之相反,自行车运动员在高强度训练后0.5~48 h内血液样本中P2X4基因表达下降[14],其疲劳程度的缓解与P2X4基因表达水平的逐渐回升一致。疲劳发生和维持易感性增加的相关基因研究进一步证实P2X4离子通道作为感觉受体在脊髓小胶质细胞中上调,并可能将疲劳发展为疼痛[15]。由此推断,运动后P2X4表达下降可能是机体应对疲劳发生的生理性响应调节,而CFS患者则缺乏此类响应,表现出明显的轻度活动后即感不适。近期研究显示,在C57BL6/J小鼠体内减少肌肉巨噬细胞P2X4蛋白的表达可有效抑制活动诱发的肌肉疲劳,提示P2X4受体可能是一个有效的药理学靶点,参与控制慢性疲劳患者的运动后不适症状[16]。此外,在小鼠尺骨负重疲劳模型中,P2X7基因敲除小鼠无法诱导骨吸收,而经P2X7拮抗剂处理的小鼠同样减弱了邻近骨细胞的再吸收激活,这些结果表明P2X7的激活参与凋亡骨细胞向邻近细胞发出信号以启动吸收和重塑的过程,并提示ATP是介导这一过程的重要信号[17]。
P2Y受体属于G蛋白偶联受体家族。就其特性而言,P2Y1、P2Y11、P2Y12、P2Y13对ADP和ATP敏感,P2Y2对ATP和尿苷三磷酸敏感[18]。研究显示,P2Y1受体参与了外周疲劳进展,但调节趋向性尚不明确。P2Y1的激活可能加重疲劳,用胞内微电极研究胞外ATP对大鼠耳长提肌影响的研究结果发现,20 μmol/L ATP可使大鼠单个肌肉微终板电位下降期延长,增强整个肌肉纤维的电信号,这种作用可被特异性P2Y1受体抑制剂阻断,提示ATP作用于P2Y1受体,抑制氯离子通道发挥保护肌纤维和抗疲劳的作用[19]。与之相反,在突触周围施万细胞中活动诱导的钙离子积聚有助于维持肌力以应对高频刺激,应用外源性ATP和ADP都可激发此种钙响应,而P2Y1突变小鼠则缺乏这种响应,其突触后功能在神经刺激下发生改变[20],这种损伤与运动性肌肉疲劳的易感性有关,表明P2Y1通过调节突触周围钾离子来调节突触后功能和肌肉疲劳。
1.2.2 AMPADP进一步水解生成AMP,AMP的积累可能引发疲劳加剧。研究表明,AMP脱氨可减少剧烈运动时有效糖酵解激活剂ADP和AMP浓度的增加,降低厌氧糖酵解产生ATP的速率。这一过程帮助延缓了肌肉酸化,减轻了细胞损伤和肌肉疲劳,延长了运动时间[21]。此外,当ATP减少,AMP/ATP比值升高,AMP活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)被激活,研究显示AMPK参与从糖原的无氧代谢到血糖和脂肪酸的氧化代谢转换,并对有氧运动的长期代谢适应特别是线粒体含量和氧化代谢的上调有重要作用,而线粒体自噬被证明是疲劳发生的主要机制之一[22],这提示AMP作为嘌呤能信号的重要一环对疲劳调节具有潜在作用。
1.2.3 腺苷和嘌呤能P1受体ATP被释放后,在胞外核苷酸酶的作用下迅速降解为腺苷,作用于P1受体调节疲劳。目前,A1和A2受体被证明参与延缓疲劳。在体外实验中,小鼠比目鱼肌在1×10-8mol/L腺苷环境中出现肌性疲劳的减轻,应用特异性A1受体激动剂可产生相似效果[23]。由于咖啡因是非特异性腺苷受体拮抗剂,腺苷受体的抗疲劳作用逐渐被关注。研究表明,在大鼠侧脑室注射腺苷A1/A2受体激动剂可抑制大鼠的运动疲劳和自发活动,提示咖啡因能在中枢神经系统内发挥特异性作用,至少部分是通过阻断腺苷A1/A2受体来实现的[24]。近期的研究显示,A2受体特别是A2A受体在咖啡因改变大鼠和小鼠运动疲劳和体温调节中发挥作用[25]。在临床试验中,给予11例健康受试者前臂注射腺苷受体抑制剂氨茶碱可加强肌肉交感神经对疲劳握力试验和被动肌肉拉伸的响应,这表明腺苷受体拮抗可加重运动疲劳[26]。
2 胞外核苷酸酶及其在疲劳中的作用 2.1 胞外核苷酸酶的分类及功能细胞外ATP来源于多种途径,包括机械刺激、与其他神经递质一起的囊泡释放或细胞损伤。一旦被释放,ATP将受到膜结合型和可溶性核苷酸酶的快速降解,从而限制其胞外作用。ATP的代谢降解导致细胞外ADP、AMP和腺苷的水平升高,这些代谢产物激活特定受体发挥作用。因此,胞外核苷酸浓度由胞外核苷酸酶精确调控(图 1)。这些酶主要分为四大类,包括胞外核苷酸三磷酸二磷酸水解酶(ecto-nucleoside triphosphate diphosphohydrolase,E-NTPDase)、胞外核苷酸焦磷酸酶/磷酸二酯酶(ecto-nucleotide pyrophosphatase/phospho-diesterase,E-NPP)、碱性磷酸酶(alkaline phosphatase,AP)和胞外-5'-核苷酸酶(ecto-5'-nucleotidase,eN)。此外,在某些细胞类型中,一些特定的胞外核苷酸酶诸如胞外腺苷酸激酶(adenylate kinase,AK)和胞外核苷二磷酸激酶(nucleoside diphosphate kinase,NDPK)也可通过磷酸转移反应促进细胞周围ATP浓度的增加。
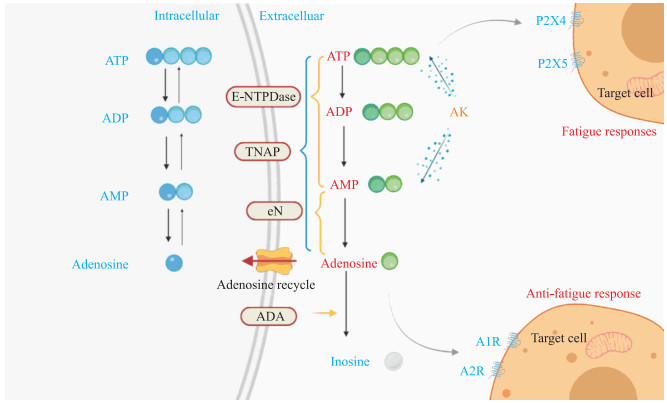
|
图 1 ATP嘌呤能信号和胞外核苷酸酶参与疲劳调节的可能机制 Fig 1 Possible mechanisms of ATP purinergic signaling and ecto-nucleotidases involved in fatigue regulation ATP: Adenosine triphosphate; ADP: Adenosine diphosphate; AMP: Adenosine monophosphate; E-NTPDase: Ecto-nucleoside triphosphate diphosphohydrolase; TNAP: Tissue-nonspecific alkaline phosphatase; eN: Ecto-5'-nucleotidase; ADA: Adenosine deaminase; AK: Adenylate kinase. |
2.2 胞外核苷酸酶与疲劳调节 2.2.1 NTPDase1和eN
E-NTPDase的亚型NTPDase1又称CD39,eN又称CD73。一些研究表明,CD39和CD73通过调控嘌呤能信号参与CFS患者淋巴细胞表型和功能的调节。CD4+CD25+T细胞将ATP代谢为腺苷,通过调节性T细胞(regulatory T cell,Treg)诱导免疫调节反应。在这个过程中,CD39将ATP和ADP水解为AMP,随后CD73将AMP转化为腺苷,因此,CD39和CD73的表达增加与疲劳的免疫调节和抗炎有关[27]。一项对30例CFS患者和25名非疲劳对照者的免疫细胞表型和功能的研究结果显示,与非疲劳对照组相比,CFS组的Treg和CD4+CD73+CD39- T细胞水平升高,而两组的CD4+CD73-CD39+ T细胞水平差异无统计学意义[28]。采用Spearman秩相关系数评估各指标之间的相关性发现,Treg和CD73+ T细胞水平之间存在正相关关系(r=0.444,P=0.014)[28]。
一项体外实验收集了8例肥胖男性完成2种运动后的自体血清,评估其对静息外周血单个核细胞(peripheral blood mononuclear cell,PBMC)炎症特征和T细胞表型的影响,结果显示高强度间歇运动后血清培养导致CD4+CTLA-4+和CD4+CD25+T细胞表达CD39、CD73的频率增加;力竭性运动后血清孵育降低了CD4+CD25+CD73+ T细胞的频率,但增加了CD4+CD25-CD39+ T细胞的频率,提示运动过程中释放的血清因子可以改变T细胞上CD73和CD39表型,参与了不同强度的疲劳条件下血清对PBMC的免疫调节活性[29]。
慢性疲劳作为一种自身免疫相关的炎症性疾病,其特征是自然杀伤(natural killer,NK)细胞活性降低、Treg升高和细胞因子水平失调。CD39的表达是部分T细胞活化的标志,CD4+ T细胞特别是Treg产生低水平的腺苷脱氨酶(adenosine deaminase,ADA)能分解腺苷。高水平的CD73和少量的ADA可增强循环中细胞外腺苷的水平。细胞外腺苷对固有免疫和适应性免疫都有抗炎作用,特别是它可能抑制Th1和Th17细胞的激活[30]。同时,CD73又通过抑制NF-κB活化抑制促炎细胞因子的释放,促进Th2型反应[31],防止长期炎症或损伤。
2.2.2 AP组织非特异性碱性磷酸酶(tissue-nonspecific alkaline phosphatase,TNAP)是AP家族中特征最广泛的成员。TNAP的基因功能突变可引起低碱性磷酸酶血症(hypophosphatasia,HPP)这一代谢性疾病。HPP最常见的临床表现是骨折和肌肉骨骼疼痛,但近年HPP患者持续性的慢性疲劳症状受到关注,TNAP的抗疲劳作用也逐渐被揭示。一项对19例HPP患者临床谱与代谢底物关系进行分析的试验指出,37%的患者存在慢性疲劳,症状的严重程度与残余AP活性水平相关[32]。TNAP可通过将ATP逐步水解以产生腺苷,而腺苷是脊髓伤害性回路的有效抑制剂,TNAP被证实参与疼痛调节[33]。由于疲劳常常先于或伴发于疼痛,TNAP活性降低所致的内源性ATP水解减少可能是HPP患者长期疲劳感受的合理解释[34]。近期有病例报道指出,对1例诊断为HPP的40岁患者采用酶替代疗法,每周皮下注射1次asfotase alfa(一种重组TNAP)治疗6个月后,主观指标健康状况调查简表(SF-36)评分及客观指标6 min步行距离和抓握力均有改善,提示TNAP可作为疲劳患者辅助治疗的潜在靶点[35]。
2.2.3 AKAK可通过催化磷酸基转移生成ATP或ADP(ATP+AMP←→2ADP)。ADP积累对各种酶动力学的直接影响和对ATP水解产生的自由能量下降可能与疲劳产生有关。在高能量需求下,AK的响应通过限制ADP的积累而减轻疲劳。动物实验结果显示,AK1-/-小鼠完整骨骼肌中游离ADP的累积量可达到1.5 mmol/L。从ATP获得的能量减少致使正常钙管理失败,钙离子外泄至细胞质内产生持续性的疲劳。但是,另一方面,AK缺乏增强了线粒体能力,AK1-/-小鼠的肌肉疲劳恢复速度更快,这表明AK1-/-导致线粒体容量的适应性增加,在耗氧要求不高的条件下抗疲劳能力增强明显[36]。这也许可以解释,AK1-/-小鼠虽然肌肉收缩后的松弛减缓,但其整体疲劳模式与对照组小鼠肌肉相似。整个肌肉的收缩性能对ADP积累的耐受性高于骨骼肌中通常发生的情况[37]。有关AK亚型在趾长伸肌和眼外肌的mRNA表达的研究发现,AK在眼外肌中可能介导一种代谢控制的替代策略,以弥补线粒体肌酸激酶低表达削弱了其对细胞能量信号的精细调节及线粒体氧化磷酸化的控制作用,缓解眼部疲劳[38]。
3 嘌呤能信号与中医药抗疲劳CFS在中医学中属"虚劳"范畴,病机主要为五脏功能虚损,机体失于气血濡养致阴阳俱虚。众多科研实践已证实中医针灸对CFS患者有较好的疗效。研究显示,传统针刺或艾灸均能调节脏腑阴阳平衡,缓解CFS躯体疲劳症状,调节患者情绪,改善睡眠[39]。研究疲劳能量代谢的动物实验指出,穴位埋线可恢复运动疲劳大鼠的骨骼肌ATP含量[40],多项针刺和中药抗疲劳的研究[41-42]也支持这一结果。然而,对ATP水解产物的检测则发现,ADP和AMP呈现出与ATP相反的变化趋势。有关芪参益气丸对疲劳诱导的心肌肥厚和功能障碍大鼠作用的研究显示,模型大鼠心肌ADP含量升高,而治疗组ADP的异常增长则被削弱[43]。术后疲劳大鼠经人参皂苷干预后骨骼肌ADP、AMP含量变化的研究也得到相似结果[44]。鉴于ADP、AMP的含量很大程度上受制于胞外核苷酸酶的水解作用,胞外核苷酸酶可能参与中医药调节疲劳的进程。此外,CFS患者在平静时和运动后P2X4、P2X5的基因表达均与健康受试者不同[11, 13],推测P2受体可能是中药和针刺改善疲劳的基因靶点之一。疲劳有多样化的主诉,包括躯体不适和情绪低落,而能量代谢是嘌呤物质的功能之一,嘌呤受体和胞外核苷酸酶作为神经信号传递的重要环节值得进一步探索,以完善中医药抗疲劳的机制。
4 结语多种嘌呤物质和受体参与调节疲劳信号。ATP释放和P2受体的激活可能参与了外周和中枢敏化以产生疲劳感,而腺苷和P1受体则更多发挥抗疲劳效应。胞外核苷酸酶如NTPDase1、eN、TNAP和AK在疲劳调节中的作用也逐渐被揭示,通过控制胞外核苷酸浓度潜在影响P2或P1受体介导的细胞信号转导途径,或通过调控相关钙信号、淋巴细胞表型和功能参与抑制疲劳发展。到目前为止,疲劳基因学研究对嘌呤能受体的关注多集中在P2X,针对性研究胞外核苷酸酶的功能与机制将有助于进一步探索和开发影响嘌呤能信号的靶向疗法,改善疲劳症状。
| [1] |
JASON L A, EVANS M, BROWN M, PORTER N. What is fatigue? Pathological and nonpathological fatigue[J]. PM R, 2010, 2: 327-331. DOI:10.1016/j.pmrj.2010.03.028 |
| [2] |
伍侨, 高静, 柏丁兮, 钟懿珠, 杨直, 江小林, 等. 中国人群慢性疲劳综合征患病率的Meta分析[J]. 右江医学, 2020, 48: 727-735. DOI:10.3969/j.issn.1003-1383.2020.10.002 |
| [3] |
COLLIN S M, HERON J, NIKOLAUS S, KNOOP H, CRAWLEY E. Chronic fatigue syndrome (CFS/ME) symptom-based phenotypes and 1-year treatment outcomes in two clinical cohorts of adult patients in the UK and The Netherlands[J]. J Psychosom Res, 2018, 104: 29-34. DOI:10.1016/j.jpsychores.2017.11.007 |
| [4] |
BURNSTOCK G. Purinergic signalling: past, present and future[J]. Braz J Med Biol Res, 2009, 42: 3-8. |
| [5] |
HONORE P, WADE C L, ZHONG C M, HARRIS R R, WU C, GHAYUR T, et al. Interleukin-1alphabeta gene-deficient mice show reduced nociceptive sensitivity in models of inflammatory and neuropathic pain but not post-operative pain[J]. Behav Brain Res, 2006, 167: 355-364. DOI:10.1016/j.bbr.2005.09.024 |
| [6] |
YEGUTKIN G G. Nucleotide- and nucleoside-converting ectoenzymes: important modulators of purinergic signalling cascade[J]. Biochim Biophys Acta, 2008, 1783: 673-694. DOI:10.1016/j.bbamcr.2008.01.024 |
| [7] |
BOOTH N E, MYHILL S, MCLAREN-HOWARD J. Mitochondrial dysfunction and the pathophysiology of myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS)[J]. Int J Clin Exp Med, 2012, 5: 208-220. |
| [8] |
TOMAS C, BROWN A, STRASSHEIM V, ELSON J L, NEWTON J, MANNING P. Cellular bioenergetics is impaired in patients with chronic fatigue syndrome[J/OL]. PLoS One, 2017, 12: e0186802. DOI: 10.1371/journal.pone.0186802.
|
| [9] |
PURPURA M, RATHMACHER J A, SHARP M H, LOWERY R P, SHIELDS K A, PARTL J M, et al. Oral adenosine-5'-triphosphate (ATP) administration increases postexercise ATP levels, muscle excitability, and athletic performance following a repeated sprint bout[J]. J Am Coll Nutr, 2017, 36: 177-183. DOI:10.1080/07315724.2016.1246989 |
| [10] |
POLLAK K A, SWENSON J D, VANHAITSMA T A, HUGHEN R W, JO D, WHITE A T, et al. Exogenously applied muscle metabolites synergistically evoke sensations of muscle fatigue and pain in human subjects[J]. Exp Physiol, 2014, 99: 368-380. DOI:10.1113/expphysiol.2013.075812 |
| [11] |
KEECH A, VOLLMER-CONNA U, BARRY B K, LLOYD A R. Gene expression in response to exercise in patients with chronic fatigue syndrome: a pilot study[J/OL]. Front Physiol, 2016, 7: 421. DOI: 10.3389/fphys.2016.00421.
|
| [12] |
LIGHT A R, BATEMAN L, JO D, HUGHEN R W, VANHAITSMA T A, WHITE A T, et al. Gene expression alterations at baseline and following moderate exercise in patients with chronic fatigue syndrome and fibromyalgia syndrome[J]. J Intern Med, 2012, 271: 64-81. DOI:10.1111/j.1365-2796.2011.02405.x |
| [13] |
WHITE A T, LIGHT A R, HUGHEN R W, VANHAITSMA T A, LIGHT K C. Differences in metabolite-detecting, adrenergic, and immune gene expression after moderate exercise in patients with chronic fatigue syndrome, patients with multiple sclerosis, and healthy controls[J]. Psychosom Med, 2012, 74: 46-54. DOI:10.1097/PSY.0b013e31824152ed |
| [14] |
VANHAITSMA T A, LIGHT A R, LIGHT K C, HUGHEN R W, YENCHIK S, WHITE A T. Fatigue sensation and gene expression in trained cyclists following a 40 km time trial in the heat[J]. Eur J Appl Physiol, 2016, 116: 541-552. DOI:10.1007/s00421-015-3311-9 |
| [15] |
LIGHT K C, WHITE A T, TADLER S, IACOB E, LIGHT A R. Genetics and gene expression involving stress and distress pathways in fibromyalgia with and without comorbid chronic fatigue syndrome[J/OL]. Pain Res Treat, 2012, 2012: 427869. DOI: 10.1155/2012/427869.
|
| [16] |
OLIVEIRA-FUSARO M C, GREGORY N S, KOLKER S J, RASMUSSEN L, ALLEN L A H, SLUKA K A. P2X4 receptors on muscle macrophages are required for development of hyperalgesia in an animal model of activity-induced muscle pain[J]. Mol Neurobiol, 2020, 57: 1917-1929. DOI:10.1007/s12035-019-01852-x |
| [17] |
CHEUNG W Y, FRITTON J C, MORGAN S A, SEREF-FERLENGEZ Z, BASTA-PLJAKIC J, THI M M, et al. Pannexin-1 and P2X7-receptor are required for apoptotic osteocytes in fatigued bone to trigger RANKL production in neighboring bystander osteocytes[J]. J Bone Miner Res, 2016, 31: 890-899. DOI:10.1002/jbmr.2740 |
| [18] |
IDZKO M, FERRARI D, ELTZSCHIG H K. Nucleotide signalling during inflammation[J]. Nature, 2014, 509: 310-317. DOI:10.1038/nature13085 |
| [19] |
VOSS A A. Extracellular ATP inhibits chloride channels in mature mammalian skeletal muscle by activating P2Y1 receptors[J]. J Physiol, 2009, 587: 5739-5752. DOI:10.1113/jphysiol.2009.179275 |
| [20] |
HEREDIA D J, FENG C Y, HENNIG G W, RENDEN R B, GOULD T W. Activity-induced Ca2+ signaling in perisynaptic Schwann cells of the early postnatal mouse is mediated by P2Y1 receptors and regulates muscle fatigue[J/OL]. Elife, 2018, 7: e30839. DOI: 10.7554/eLife.30839.
|
| [21] |
KORZENIEWSKI B. AMP deamination delays muscle acidification during heavy exercise and hypoxia[J]. J Biol Chem, 2006, 281: 3057-3066. DOI:10.1074/jbc.M510418200 |
| [22] |
HARDIE D G. AMP-activated protein kinase: a key system mediating metabolic responses to exercise[J]. Med Sci Sports Exerc, 2004, 36: 28-34. DOI:10.1249/01.MSS.0000106171.38299.64 |
| [23] |
READING S A, BARCLAY J K. A1 receptor activation decreases fatigue in mammalian slow-twitch skeletal muscle in vitro[J]. Can J Physiol Pharmacol, 2001, 79: 496-501. DOI:10.1139/y01-018 |
| [24] |
DAVIS J M, ZHAO Z W, STOCK H S, MEHL K A, BUGGY J, HAND G A. Central nervous system effects of caffeine and adenosine on fatigue[J]. Am J Physiol Regul Integr Comp Physiol, 2003, 284: R399-R404. DOI:10.1152/ajpregu.00386.2002 |
| [25] |
AGUIAR A S, SPECK A E, CANAS P M, CUNHA R A. Neuronal adenosine A2A receptors signal ergogenic effects of caffeine[J/OL]. Sci Rep, 2020, 10: 13414. DOI: 10.1038/s41598-020-69660-1.
|
| [26] |
CUI J, LEUENBERGER U A, BLAHA C, YODER J, GAO Z H, SINOWAY L I. Local adenosine receptor blockade accentuates the sympathetic responses to fatiguing exercise[J]. Am J Physiol Heart Circ Physiol, 2010, 298: H2130-H2137. DOI:10.1152/ajpheart.00083.2010 |
| [27] |
DEAGLIO S, DWYER K M, GAO W D, FRIEDMAN D, USHEVA A, ERAT A, et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression[J]. J Exp Med, 2007, 204: 1257-1265. DOI:10.1084/jem.20062512 |
| [28] |
BRENU E W, HUTH T K, HARDCASTLE S L, FULLER K, KAUR M, JOHNSTON S, et al. Role of adaptive and innate immune cells in chronic fatigue syndrome/myalgic encephalomyelitis[J]. Int Immunol, 2014, 26: 233-242. DOI:10.1093/intimm/dxt068 |
| [29] |
DORNELES G P, DA SILVA I M, SANTOS M A, ELSNER V R, FONSECA S G, PERES A, et al. Immunoregulation induced by autologous serum collected after acute exercise in obese men: a randomized cross-over trial[J/OL]. Sci Rep, 2020, 10: 21735. DOI: 10.1038/s41598-020-78750-z.
|
| [30] |
LAPPAS C M, RIEGER J M, LINDEN J. A2A adenosine receptor induction inhibits IFN-gamma production in murine CD4+ T cells[J]. J Immunol, 2005, 174: 1073-1080. DOI:10.4049/jimmunol.174.2.1073 |
| [31] |
ROMIO M, REINBECK B, BONGARDT S, HÜLS S, BURGHOFF S, SCHRADER J. Extracellular purine metabolism and signaling of CD73-derived adenosine in murine Treg and Teff cells[J]. Am J Physiol Cell Physiol, 2011, 301: C530-C539. DOI:10.1152/ajpcell.00385.2010 |
| [32] |
LEFEVER E, WITTERS P, GIELEN E, VANCLOOSTER A, MEERSSEMAN W, MORAVA E, et al. Hypophosphatasia in adults: clinical spectrum and its association with genetics and metabolic substrates[J]. J Clin Densitom, 2020, 23: 340-348. DOI:10.1016/j.jocd.2018.12.006 |
| [33] |
STREET S E, SOWA N A. TNAP and pain control[J]. Subcell Biochem, 2015, 76: 283-305. |
| [34] |
MARTINS L, DE ALMEIDA A B, DOS SANTOS E J L, FOSTER B L, MACHADO R A, KANTOVITZ K R, et al. A novel combination of biallelic ALPL mutations associated with adult hypophosphatasia: a phenotype-genotype association and computational analysis study[J]. Bone, 2019, 125: 128-139. DOI:10.1016/j.bone.2019.05.005 |
| [35] |
KOYAMA H, YASUDA S, KAKOI S, OHATA Y, SHIMIZU Y, HASEGAWA C, et al. Effect of asfotase alfa on muscle weakness in a Japanese adult patient of hypophosphatasia with low ALP levels[J]. Intern Med, 2020, 59: 811-815. DOI:10.2169/internalmedicine.3298-19 |
| [36] |
HANCOCK C R, BRAULT J J, WISEMAN R W, TERJUNG R L, MEYER R A. 31P-NMR observation of free ADP during fatiguing, repetitive contractions of murine skeletal muscle lacking AK1[J]. Am J Physiol Cell Physiol, 2005, 288: C1298-C1304. DOI:10.1152/ajpcell.00621.2004 |
| [37] |
HANCOCK C R, JANSSEN E, TERJUNG R L. Skeletal muscle contractile performance and ADP accumulation in adenylate kinase-deficient mice[J]. Am J Physiol Cell Physiol, 2005, 288: C1287-C1297. DOI:10.1152/ajpcell.00567.2004 |
| [38] |
MCMULLEN C A, HAYESS K, ANDRADE F H. Fatigue resistance of rat extraocular muscles does not depend on creatine kinase activity[J/OL]. BMC Physiol, 2005, 5: 12. DOI: 10.1186/1472-6793-5-12.
|
| [39] |
张晶晶, 黎波, 杜元灏, 李晶, 查庆平, 陈林玲. 针灸治疗慢性疲劳综合征的优势方案筛选研究[J]. 中国中医基础医学杂志, 2020, 26: 1123-1126, 1217. |
| [40] |
史晓宇, 宋越, 冯敏, 高珍珍, 杨英. 穴位埋线对运动性疲劳大鼠能量代谢水平的影响[J]. 中国畜牧兽医, 2021, 48: 747-754. |
| [41] |
马斯, 陈以国. 针刺及人参煎剂对疲劳模型大鼠抗疲劳作用实验研究[J]. 亚太传统医药, 2015, 11: 14-15. |
| [42] |
郑秀琴, 刘文珂, 阮明玉, 胡军, 周佩娟. 针灸对运动性疲劳的能量代谢调节作用述评[J]. 广州中医药大学学报, 2019, 36: 532-536. |
| [43] |
HUANG R, CUI Y C, WEI X H, PAN C S, LI Q, HE S Y, et al. A novel traditional Chinese medicine ameliorates fatigue-induced cardiac hypertrophy and dysfunction via regulation of energy metabolism[J]. Am J Physiol Heart Circ Physiol, 2019, 316: H1378-H1388. |
| [44] |
谈善军, 周锋, 余震, 杜璐迪, 叶星照, 章晓东, 等. 术后疲劳综合征大鼠骨骼肌能量代谢特点及人参皂苷Rb1的干预研究[J]. 中国中药杂志, 2011, 36: 3489-3493. |
 2022, Vol. 43
2022, Vol. 43


