miRNA是一类长约18~25个核苷酸的高度保守的非编码小分子RNA,它们基于碱基互补配对原则特异性结合靶基因mRNA上的序列,通过调节、翻译或降解靶mRNA来调控基因表达,在许多生理病理过程中起着重要作用[1-2]。研究表明,miRNA-144能够调控核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)的表达[3],而Nrf2在维持食管黏膜屏障功能、抗氧化应激及减轻炎症反应等方面发挥重要作用[4-6]。据报道,Nrf2与NF-κB之间具有潜在的交联及拮抗作用,可共同调控一些下游靶基因参与反流性食管炎(reflux esophagitis,RE)的疾病进程[6],且Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB经典信号通路介导的炎症反应持续激活促进食管黏膜细胞凋亡是RE重要的病理特征[7]。
本课题组前期研究发现,在利用前胃结扎联合幽门限制法构建的RE大鼠模型中,通过尾静脉注射miRNA-144抑制剂(miRNA-144 antagomir)抑制miRNA-144表达可缓解大鼠的RE进程,但其具体机制尚未完全明确[8]。近年来研究发现,miRNA-144能够在糖尿病、急性肺损伤和恶性肿瘤(如肺癌、胰腺癌等)等多种疾病中发挥促炎及促凋亡作用[9-12]。本研究主要探究在RE大鼠中抑制miRNA-144表达对食管组织TLR4/NF-κB信号通路的影响,探讨miRNA-144抑制剂是否通过TLR4/NF-κB信号通路减轻食管黏膜损伤,明确miRNA-144抑制剂对RE的治疗价值。
1 材料和方法 1.1 实验动物18只同系雄性清洁级SD大鼠购自上海斯莱克实验动物有限公司[实验动物生产许可证号:SCXK(沪)2017-0005],6周龄,体重220~250 g,委托本院比较医学科实验动物中心饲养[实验动物使用许可证号:SYXK(闽)2018-0006]。
1.2 试剂miRNA-144 antagomir由上海吉玛制药技术有限公司提供,SYBR Green PCR混合物试剂盒购自厦门生命互联技术有限公司,PCR引物由中国华大基因公司合成。IL-6、TNF-α ELISA检测试剂盒购自上海碧云天生物技术有限公司,IL-8 ELISA检测试剂盒购自上海巧伊生物技术有限公司。TUNEL细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。cleaved caspase 3(Asp175)兔多克隆抗体购自美国CST公司,Ki-67兔多克隆抗体购自英国Abcam公司,兔抗大鼠密封蛋白3(claudin 3,CLDN3)多克隆抗体购自美国ThermoFisher Scientific公司,GAPDH抗体购自英国Abcam公司,兔超敏二步法免疫组织化学染色试剂盒、DAB显色剂购自北京中杉金桥生物技术有限公司。miRNA提取试剂盒购自德国Qiagen公司,十二烷基硫酸钠(sodium dodecylsulfate,SDS)、三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]、甘氨酸购自生工生物工程(上海)股份有限公司,30%甲叉双丙烯酰胺购自厦门鹭隆生物科技发展有限公司。
1.3 大鼠RE模型的构建及给药按照完全随机法将18只雄性SD大鼠分为假手术组、RE组、RE联合miRNA-144抑制剂治疗组(miRNA-144抑制剂组),每组6只。术前用1%戊巴比妥钠40 mg/kg腹腔注射麻醉大鼠,麻醉成功的大鼠呈仰卧位将四肢固定于手术板上。RE组和miRNA-144抑制剂组大鼠采用前胃结扎联合幽门限制法建立慢性RE模型[13],假手术组大鼠充分暴露胃底及幽门周围组织后即关腹。术后大鼠禁食24 h,不禁水。
假手术组、RE组大鼠在术后第1、2、3天分别于尾静脉注射0.9%氯化钠溶液1 mL,miRNA-144抑制剂组大鼠在术后第1、2、3天分别于尾静脉注射miRNA-144 antagomir 5OD(1 mL)。术后第14天处死所有大鼠,取食管组织标本,肉眼观察食管黏膜损伤情况,采用ImageJ软件评估食管的溃疡病变占比。将食管组织标本置于0.4%甲醛溶液中固定,24 h内对标本进行石蜡包埋并切片,H-E染色观察食管黏膜的病理改变。
1.4 qPCR检测miRNA-144及TLR4/NF-κB通路相关基因的表达将大鼠食管组织研磨成粉末,用TRIzol总RNA抽提试剂盒(德国Qiagen公司)对各组食管组织进行RNA提取,检测RNA的纯度及浓度;采用反转录PCR试剂盒(德国Qiagen公司)合成cDNA,置于-20 ℃保存。严格按照SYBR Green PCR混合物试剂盒产品说明书进行qPCR操作。PCR反应条件:94 ℃ 30 s;95 ℃15 s,60 ℃ 20 s,72 ℃ 25 s,共进行40个循环。采用2-ΔΔCt法计算目的基因的相对表达量。反应体系(共20 µL):cDNA 8 µL,2×UltraSYBR混合物10 µL,引物2 µL。引物序列如下:TLR4上游引物为5'-CTCACAACTTCAGTGGCTGGATTTA-3',下游引物为5'-GTCTCCACAGCCACCAGATTCTC-3';NF-κB上游引物为5'-CATGCGTTTCCGTTACAA-GTG-3',下游引物为5'-GTGCGTCTTAGTGGTA-TCTGTGCT-3';核因子κB抑制蛋白α(inhibitor ofnuclear factor κB α,IκBα)上游引物为5'-TGACC-ATGGAAGTGATTGGTCAG-3';下游引物为5'-GA-TCACAGCCAAGTGGAGTGGA-3';β-肌动蛋白(β-actin)上游引物为5'-GGAGATTACTGCCCT-GGCTCCTA-3',下游引物为5'-GACTCATCGTAC-TCCTGCTTGCTG-3';miRNA-144-3p上游引物为5'-TACAGTATAGATGATGTACT-3',下游引物为试剂盒中的5'-Uni-miRNA qPCR引物;U6上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-AACGCTTCACGAATTTGCGT-3'。
1.5 ELISA检测食管组织中炎症因子的表达取长度为1.5~2.0 cm的大鼠食管组织,制成食管组织匀浆,离心后取食管组织上清液,根据ELISA检测试剂盒说明书进行检测,将酶标仪调至450 nm波长测样本光密度,通过样品的光密度值和标准曲线计算食管组织中IL-6、IL-8、TNF-α的含量。
1.6 TUNEL法检测食管组织的细胞凋亡情况将石蜡包埋的大鼠食管组织样品进行切片,厚度为4 μm,脱蜡至水。参照TUNEL细胞凋亡检测试剂盒实验步骤进行操作:滴加蛋白酶K抗原修复20 min,PBS冲洗3次;加入过氧化物酶转化剂室温孵育20 min,PBS洗涤3次;滴加50 μL现配的TUNEL反应混合液,保持切片湿润,37 ℃孵箱中避光孵育1 h,PBS洗涤1次;滴加标记反应终止液,室温孵育10 min,PBS洗涤3次后进行DAB显色;用苏木精染色液对细胞核进行染色,光镜下见淡棕色或深棕色细胞为阳性细胞。利用Image Pro Plus 6.0软件进行阳性细胞半定量分析,评价细胞凋亡情况。
1.7 免疫组织化学染色检测食管组织中cleaved caspase 3、Ki-67的表达取大鼠食管组织蜡块进行连续切片,厚度为4 μm,展片,捞片;置60 ℃温箱中烤片过夜;采用链霉亲和素-过氧化物酶连接法进行免疫组织化学染色,在光镜下观察cleaved caspase 3、Ki-67染色情况,利用ImageJ软件进行阳性细胞半定量分析,计算平均光密度值。
1.8 蛋白质印迹法检测食管组织中CLDN3蛋白的表达用蛋白裂解液提取所取组织的总蛋白,BCA法对总蛋白进行定量,取100 μg总蛋白加入预先配制好的浓缩胶中进行SDS-PAGE,后将蛋白转印至PVDF膜上。转膜后的PVDF膜在5%脱脂牛奶(TBST配制)中室温封闭1 h。TBST洗膜3次,置入用封闭液按照合适比例稀释的一抗中[CLDN3一抗1∶500,GAPDH一抗1∶2 000],4 ℃孵育过夜;TBST洗膜3次,置入以1∶2 000比例稀释的二抗山羊抗兔IgG中,室温摇床孵育1 h;TBST洗膜3次后加入ECL显色液显影。利用ImageJ软件分析蛋白条带的灰度值,以CLDN3与GAPDH灰度值的比值作为CLDN3的表达水平。
1.9 统计学处理应用SPSS 16.0软件进行数据分析,呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析(多重比较采用最小显著性差异法);呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,采用多样本的非参数秩和检验(Kruskal-Wallis秩和检验)。检验水准(α)为0.05。
2 结果 2.1 miRNA-144抑制剂能抑制大鼠食管组织中miRNA-144的表达qPCR检测结果显示,与假手术组大鼠相比,RE大鼠的食管组织中miRNA-144水平上调(9.96±1.95 vs 7.49±1.05,P<0.01),而注射miRNA-144抑制剂可抑制RE大鼠食管组织中miRNA-144的表达(3.11±1.53 vs 9.96±1.95,P<0.01)。
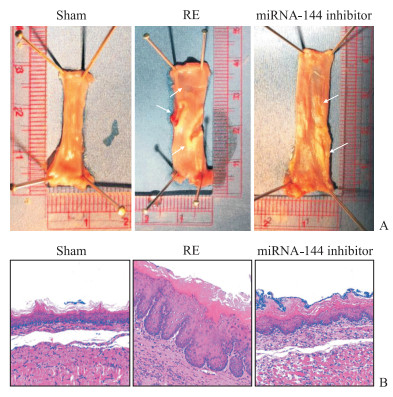
2.2 miRNA-144抑制剂可减轻RE大鼠的食管病变程度如图 1A所示,假手术组大鼠食管黏膜光滑完整,色淡红,有光泽;RE组大鼠食管黏膜粗糙、充血明显,可见食管多发溃疡,溃疡表面血管裸露。miRNA-144抑制剂组大鼠食管黏膜充血程度较RE组减轻,溃疡面积减少,溃疡表面未见血管裸露。定量分析结果显示,假手术组大鼠食管溃疡面积占比为0.97%(0.85%,1.04%);与RE组比较,miRNA-144抑制剂组大鼠食管溃疡面积占比降低,差异有统计学意义[3.58%(3.23%,4.73%)vs 8.39%(7.60%,9.71%),P<0.05]。
|
图 1 抑制miRNA-144表达改善RE大鼠食管黏膜损伤 Fig 1 miRNA-144 inhibition attenuates the injury of esophageal mucosa in RE rats A: Gross observation of esophageal mucosa (arrows indicate esophageal mucosa injury); B: Pathological changes of esophageal mucosa detected by hematoxylin-eosin staining (100×). miRNA: MicroRNA; RE: Reflux esophagitis. |
H-E染色结果(图 1B)显示,假手术组大鼠食管组织上皮细胞排列紧密规整,鳞状上皮基底层可见2层细胞,未见明显炎症细胞浸润及RE;RE组食管大鼠组织可见固有膜乳头延长、上皮细胞间隙增宽、鳞状上皮基底层增厚(4~5层细胞),伴有黏膜下层炎症细胞浸润等RE的表现;miRNA-144抑制剂组病变程度较RE组减轻。
2.3 miRNA-144抑制剂对RE大鼠体内TLR4/NF-κB信号通路的影响qPCR检测结果(图 2)显示,与假手术组相比,RE组大鼠食管组织中TLR4、NF-κB、IκBα mRNA表达水平均升高(P<0.05,P<0.01);与RE组相比,miRNA-144抑制剂组大鼠食管组织中的TLR4、NF-κB、IκBα mRNA表达水平均下降(P均<0.05)。

|
图 2 各组大鼠食管组织中TLR4/NF-κB信号通路相关基因的表达 Fig 2 Expression of genes related to TLR4/NF-κB signaling pathway in esophagus tissues of rats in each group *P < 0.05, **P < 0.01. n=6, x±s. TLR4: Toll-like receptor 4;NF-κB: Nuclear factor κB; IκBα: Inhibitor of nuclear factor κB α; RE: Reflux esophagitis; miRNA: MicroRNA. |
2.4 miRNA-144抑制剂对RE大鼠食管组织炎症细胞因子含量的影响
ELISA检测结果(表 1)显示,与假手术组比较,RE组大鼠食管组织中IL-6、IL-8、TNF-α的含量增加(P均<0.05);与RE组相比,miRNA-144抑制剂组大鼠食管组织中IL-6、IL-8、TNF-α的含量下降(P均<0.05)。
|
|
表 1 各组大鼠食管组织中IL-6、IL-8、TNF-α的含量 Tab 1 Contents of IL-6, IL-8 and TNF-α in esophageal tissues of rats in each group |
2.5 抑制miRNA-144表达对RE大鼠食管黏膜细胞凋亡、增殖的影响
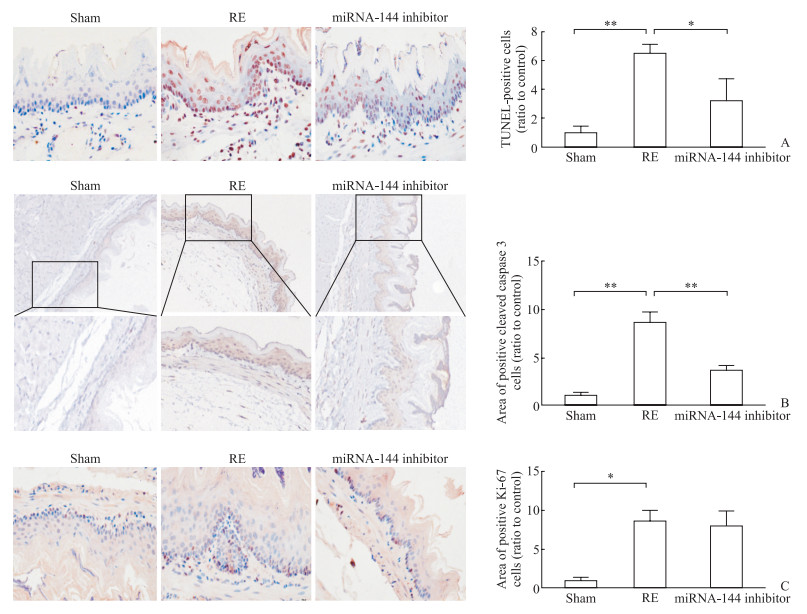
TUNEL细胞凋亡检测结果(图 3A)显示,与假手术组比较,RE组大鼠食管黏膜细胞凋亡水平升高(P<0.01),而抑制miRNA-144表达可降低RE大鼠食管黏膜细胞凋亡水平(P<0.05)。免疫组织化学染色结果显示,凋亡相关蛋白cleaved caspase 3阳性反应定位于细胞质及核周。与RE组相比,miRNA-144抑制剂可抑制大鼠食管组织中cleaved caspase 3表达的增加(P<0.01,图 3B),这与TUNEL检测结果一致;RE组大鼠食管组织中Ki-67阳性细胞数与miRNA-144抑制剂组相比差异无统计学意义(P>0.05,图 3C)。
|
图 3 抑制miRNA-144表达对RE大鼠食管黏膜细胞凋亡与增殖的影响 Fig 3 Effect of inhibition of miRNA-144 on apoptosis and proliferation of esophageal mucosal cells in RE rats A: Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling (TUNEL) assay (400×); B: Expression of cleaved caspase 3 detected by immunohistochemistry staining (Upper: 100×; Lower: 400×); C: Expression of Ki-67 detected by immunohistochemistry staining (400×). *P < 0.05, **P < 0.01. n=6, x±s. miRNA: MicroRNA; RE: Reflux esophagitis. |
2.6 miRNA-144抑制剂对RE大鼠食管黏膜上皮屏障功能的影响
蛋白质印迹法检测结果显示,与假手术组比较,RE组大鼠食管组织中CLDN3蛋白的表达减少(0.17±0.05 vs 0.52±0.06,P<0.01);与RE组比较,miRNA-144抑制剂组大鼠食管组织中CLDN3蛋白的表达升高(0.34±0.07 vs 0.17±0.05,P<0.01)。
3 讨论胃食管反流病(gastroesophageal reflux disease,GERD)为胃十二指肠内容物反流入食管后,诱发免疫介导的炎症反应及氧化应激、诱导食管黏膜上皮细胞凋亡,进而损伤食管复层鳞状上皮构成的黏膜屏障,导致食管黏膜出现糜烂或溃疡,其进一步发展可引起食管狭窄或巴雷特食管,部分患者甚至可发生食管癌变。尽早采取干预及治疗措施可为临床GERD患者带来福音。GERD的病理生理机制复杂,氧化应激、免疫介导、食管高敏感、食管黏膜屏障等一直该领域研究的热点。临床上,即使采用足剂量、足疗程的质子泵抑制剂,仍有高达40%的GERD患者治疗失败[14],故单纯以质子泵抑制剂治疗GERD存在一定的局限性,亟需探索新的治疗策略和方法。
本课题组前期研究证实,miRNA-144可通过调控Nrf2在蛋白层面的表达影响RE的疾病进程[8]。Nrf2作为调节细胞抗氧化应激的重要转录因子,有研究表明其与NF-κB信号通路之间具有潜在的交联及拮抗作用,且Nrf2与NF-κB可共同调控一些下游靶基因[包括血红素氧合酶1(heme oxygenase 1,HO-1)、谷氨酸半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、G蛋白转录因子α2(G protein α2,Gα2)和IL-8等]的转录和功能[6]。TLR4/NF-κB作为一经典的信号通路,可参与细胞凋亡与增殖的调控及炎症反应[7]。据报道,Nrf2基因敲除小鼠在创伤性脑损伤后其肺部的NF-κB活性及炎症反应明显增加[15]。在慢性结肠炎小鼠模型中,Nrf2的抗氧化应激作用可减轻NF-κB通路介导的炎症反应和细胞凋亡[16]。有学者发现,在GERD进程中,NF-κB和Nrf2可参与调节食管屏障功能;NF-κB通路参与GERD模型大鼠中的食管黏膜损伤,予NF-κB特异激动剂处理可促进体内的炎症反应,增加模型大鼠的食管黏膜细胞凋亡,加重食管黏膜损伤程度;反之,抑制NF-κB通路可减轻GERD大鼠的食管黏膜细胞凋亡,改善食管黏膜细胞的功能[7]。研究表明,GERD患者食管黏膜中的氧化应激相关因子如活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)、环氧合酶(cyclooxygenase,COX)、一氧化氮合酶(nitric oxide synthase,NOS)、髓过氧化物酶(myeloperoxidase,MPO)和缺氧诱导因子(hypoxia inducible factor,HIF)的表达水平显著增加,NF-κB通路可被这些氧化应激相关因子激活,并进一步促进炎症介质IL-6、IL-8、IL-1β、趋化因子等的合成与分泌,加重食管黏膜的损伤,甚至诱发食管癌[7, 17]。本实验结果表明,与假手术组相比,RE组大鼠食管组织中TLR4/NF-κB通路激活;而下调miRNA-144表达可抑制TLR4/NF-κB通路活化。与假手术组相比,RE组大鼠食管组织中的炎症介质IL-6、IL-8、TNF-α含量升高,凋亡相关蛋白cleaved caspase 3及TUNEL细胞凋亡检测结果显示持续未缓解的炎症反应可诱发细胞凋亡,这与Fang等[18]的研究结果一致;另本研究发现,通过抑制RE大鼠体内miRNA-144表达后,其食管组织中的炎症介质水平下降,食管黏膜细胞凋亡水平降低,表明miRNA-144抑制剂可能通过抑制TLR4/NF-κB通路有效减少炎症介质的分泌,抑制细胞凋亡,促进RE大鼠食管黏膜损伤的修复。
在诱导上皮细胞凋亡后,紧密连接(tight junction,TJ)蛋白以一种独特的方式发生蛋白水解,这与TJ的破坏密切相关[19]。TJ是构成食管黏膜机械屏障的最重要结构。CLDN是TJ最主要的组成成分,负责调控上皮屏障功能及上皮极性[20-21],在维持食管上皮屏障功能的完整性上具有重要作用[22]。既往研究显示,重金属及H2O2诱导的氧化应激可造成TJ结构和功能的改变[23-24]。在慢性RE动物模型中,Oguro等[25]证实CLDN3表达的减少是反映RE的敏感指标之一。本研究发现,RE组大鼠食管组织中CLDN3蛋白的表达少于假手术组,表明食管黏膜屏障受损;而miRNA-144抑制剂组大鼠食管组织中CLDN3的蛋白表达高于RE组,提示miRNA-144抑制剂可通过保护食管黏膜上皮屏障功能进而缓解RE疾病进程。由此,本实验结果进一步证实抑制食管黏膜细胞凋亡、改善食管黏膜屏障对治疗RE的重要作用。
综上所述,本研究结果显示miRNA-144抑制剂可能通过抑制TLR4/NF-κB信号通路,有效减少炎症介质分泌,抑制细胞凋亡,改善食管黏膜屏障功能,进而缓解RE大鼠食管损伤。本研究结果为miRNA-144抑制剂治疗RE提供了有力证据,并为未来临床治疗RE提供了新策略。然而,其更深入的分子生物学机制仍有待进一步探究。
| [1] |
HA M J, KIM V N. Regulation of microRNA biogenesis[J]. Nat Rev Mol Cell Biol, 2014, 15: 509-524. DOI:10.1038/nrm3838 |
| [2] |
PILLAI R S, BHATTACHARYYA S N, FILIPOWICZ W. Repression of protein synthesis by miRNAs: how many mechanisms?[J]. Trends Cell Biol, 2007, 17: 118-126. DOI:10.1016/j.tcb.2006.12.007 |
| [3] |
RAVIRAJSINH N J, MALITA A J, AMMAR A A, FOLAMI L P, MENAKA C T, DIANA G, et al. Inhibiting microRNA-144 potentiates Nrf2-dependent antioxidant signaling in RPE and protects against oxidative stress-induced outer retinal degeneration[J/OL]. Redox Biol, 2020, 28: 101336. DOI: 10.1016/j.redox.2019.101336.
|
| [4] |
CHEN H, HU Y H, FANG Y, DJUKIC Z, YAMAMOTO M, SHAHEEN N J, et al. Nrf2 deficiency impairs the barrier function of mouse oesophageal epithelium[J]. Gut, 2014, 63: 711-719. DOI:10.1136/gutjnl-2012-303731 |
| [5] |
WOODLAND P, SIFRIM D. Oesophageal mucosal barrier: a key factor in the pathophysiology of non-erosive reflux disease (NERD) and a potential target for treatment[J]. Gut, 2014, 63: 705-706. DOI:10.1136/gutjnl-2013-305101 |
| [6] |
CHEN H, FANG Y, LI W B, ORLANDO R C, SHAHEEN N, CHEN X L. NFκB and Nrf2 in esophageal epithelial barrier function[J/OL]. Tissue Barriers, 2013, 1: e27463. DOI: 10.4161/tisb.27463.
|
| [7] |
YU H X, WANG X L, ZHANG L N, ZHANG J, ZHAO W. Involvement of the TLR4/NF-κB signaling pathway in the repair of esophageal mucosa injury in rats with gastroesophageal reflux disease[J]. Cell Physiol Biochem, 2018, 51: 1645-1657. DOI:10.1159/000495652 |
| [8] |
林燕芳, 王雯, 王宝珊, 姚荔嘉, 柳刚. miR-144在大鼠反流性食管炎中的作用和机制[J]. 临床消化病杂志, 2019, 31: 1-5. |
| [9] |
LI H B, SHI H J, GAO M, MA N, SUN R Q. Long non-coding RNA CASC2 improved acute lung injury by regulating miR-144-3p/AQP1 axis to reduce lung epithelial cell apoptosis[J/OL]. Cell Biosci, 2018, 8: 15. DOI: 10.1186/s13578-018-0205-7.
|
| [10] |
YU M L, LIU Y, ZHANG B L, SHI Y C, CUI L, ZHAO X X. Inhibiting microRNA-144 abates oxidative stress and reduces apoptosis in hearts of streptozotocin-induced diabetic mice[J]. Cardiovasc Pathol, 2015, 24: 375-381. DOI:10.1016/j.carpath.2015.06.003 |
| [11] |
CHEN S S, LI P, LI J, WANG Y Y, DU Y W, CHEN X N, et al. miR-144 inhibits proliferation and induces apoptosis and autophagy in lung cancer cells by targeting TIGAR[J]. Cell Physiol Biochem, 2015, 35: 997-1007. DOI:10.1159/000369755 |
| [12] |
LI J, SUN P S, YUE Z Y, ZHANG D Z, YOU K, WANG J G. miR-144-3p induces cell cycle arrest and apoptosis in pancreatic cancer cells by targeting proline-rich protein 11 expression via the mitogen-activated protein kinase signaling pathway[J]. DNA Cell Biol, 2017, 36: 619-626. DOI:10.1089/dna.2017.3656 |
| [13] |
OMURA N, KASHIWAGI H, CHEN G, SUZUKI Y, YANO F, AOKI T. Establishment of surgically induced chronic acid reflux esophagitis in rats[J]. Scand J Gastroenterol, 1999, 34: 948-953. DOI:10.1080/003655299750025020 |
| [14] |
SCARPELLINI E, ANG D, PAUWELS A, DE SANTIS A, VANUYTSEL T, TACK J. Management of refractory typical GERD symptoms[J]. Nat Rev Gastroenterol Hepatol, 2016, 13: 281-294. |
| [15] |
JIN W, ZHU L, GUAN Q, CHEN G, WANG Q F, YIN H X, et al. Influence of Nrf2 genotype on pulmonary NF-kappaB activity and inflammatory response after traumatic brain injury[J]. Ann Clin Lab Sci, 2008, 38: 221-227. |
| [16] |
LI W G, KHOR T O, XU C J, SHEN G X, JEONG W S, YU S W, et al. Activation of Nrf2-antioxidant signaling attenuates NFκB-inflammatory response and elicits apoptosis[J]. Biochem Pharmacol, 2008, 76: 1485-1489. |
| [17] |
NEJAT PISH-KENARI F, QUJEQ D, MAGHSOUDI H. Some of the effective factors in the pathogenesis of gastro-oesophageal reflux disease[J]. J Cell Mol Med, 2018, 22: 6401-6404. DOI:10.1111/jcmm.13939 |
| [18] |
FANG Y, CHEN H, HU Y H, DJUKIC Z, TEVEBAUGH W, SHAHEEN N J, et al. Gastroesophageal reflux activates the NF-κB pathway and impairs esophageal barrier function in mice[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305: G58-G65. DOI:10.1152/ajpgi.00438.2012 |
| [19] |
BOJARSKI C, WEISKE J, SCHÖNEBERG T, SCHRÖDER W, MANKERTZ J, SCHULZKE J D, et al. The specific fates of tight junction proteins in apoptotic epithelial cells[J]. J Cell Sci, 2004, 117: 2097-2107. DOI:10.1242/jcs.01071 |
| [20] |
TSUKITA S, FURUSE M. Pores in the wall: claudins constitute tight junction strands containing aqueous pores[J]. J Cell Biol, 2000, 149: 13-16. DOI:10.1083/jcb.149.1.13 |
| [21] |
TSUKITA S, TANAKA H, TAMURA A. The claudins: from tight junctions to biological systems[J]. Trends Biochem Sci, 2019, 44: 141-152. |
| [22] |
KIA L, PANDOLFINO J E, KAHRILAS P J. Biomarkers of reflux disease[J]. Clin Gastroenterol Hepatol, 2016, 14: 790-797. |
| [23] |
JEONG C H, SEOK J S, PETRIELLO M C, HAN S G. Arsenic downregulates tight junction claudin proteins through p38 and NF-κB in intestinal epithelial cell line, HT-29[J]. Toxicology, 2017, 379: 31-39. DOI:10.1016/j.tox.2017.01.011 |
| [24] |
HASHIMOTO K, OSHIMA T, TOMITA T, KIM Y, MATSUMOTO T, JOH T, et al. Oxidative stress induces gastric epithelial permeability through claudin-3[J]. Biochem Biophys Res Commun, 2008, 376: 154-157. |
| [25] |
OGURO M, KOIKE M, UENO T, ASAOKA D, MORI H, NAGAHARA A, et al. Dissociation and dispersion of claudin-3 from the tight junction could be one of the most sensitive indicators of reflux esophagitis in a rat model of the disease[J]. J Gastroenterol, 2011, 46: 629-638. |
 2022, Vol. 43
2022, Vol. 43


