2. 重庆医科大学附属第一医院放射科,重庆 400016
2. Department of Radiology, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
童年创伤经历是抑郁症发生的一个重要社会心理因素[1],也是其难治与易复发的重要原因之一[2]。有研究者指出,有童年创伤经历的抑郁症可能是抑郁症的一种重要功能亚型,具有独特的发病机制、临床特征、病程及预后[3]。调查显示,在中国有童年创伤经历的抑郁症占比较高[4],值得重视。
童年时期的创伤经历会导致个体形成适应不良的心理应对机制、低下的自我价值认同及在人际关系中的不安全感,是个体容易罹患精神疾病与形成不良人格的重要原因[5],并且这些影响会持续到成年,长远地影响其人格发展[6]。研究表明个体的抑郁与神经质水平相关[7]。神经质是一种相对稳定的人格因素,经历童年创伤个体的神经质水平较高[8],抑郁症状更加多样化[9]。
童年创伤经历可能作为应激源引起大脑结构和功能改变,并与个体后期精神障碍的发生有关[10]。研究发现有童年创伤经历的抑郁症患者存在结构与静息态脑区激活的改变[11],也有研究探索了抑郁症患者神经质人格与脑功能连接(functional connectivity,FC)的关系[12],但同时探索童年创伤对抑郁症患者静息态脑区激活及人格特征影响的研究匮乏。本团队前期探索了有童年创伤经历的抑郁症患者与健康对照组脑区激活的差异[13],但因实验条件的限制未严格控制健康对照组童年创伤经历的有无,也未设置无童年创伤经历抑郁症患者组。本研究旨在通过更严格的纳入和排除标准,进一步匹配研究对象人口学信息、抑郁严重程度,比较初发未治的有或无童年创伤经历的抑郁症患者静息态功能磁共振成像(functional magnetic resonance imaging,fMRI)监测的磁共振脑区激活自发低频振幅(magnetic resonance brain spontaneous amplitude of low-frequency fluctuation,mALFF)信号值与大五人格的差异,并进一步以差异脑区为种子点向全脑做FC分析,为探索有童年创伤经历的抑郁症神经影像学机制及临床干预靶点奠定基础。
1 资料和方法 1.1 研究对象选取2019年5月至2021年3月在重庆医科大学附属第一医院精神科门诊就诊的初发未治抑郁症患者为研究对象,采用匹配病例对照研究设计。纳入标准:(1)符合国际疾病分类第10版(international classification of diseases-10,ICD-10)单相抑郁发作诊断标准[14];(2)年龄18~50岁; (3)初中及以上文化程度; (4)童年期创伤问卷简表(childhood trauma questionnaire-short form,CTQ-SF)调查结果中至少1项为阳性; (5)入组前能够配合身体检查,理解并配合问卷填写、头颅fMRI检查等; (6)BMI为18.5~<24 kg/m2;(7)自愿参加本研究并签署知情同意书。排除标准:(1)患有脑器质性疾病者及影像学数据不合格者; (2)合并其他精神疾病者,包括持续伴精神病性症状的抑郁发作、双相抑郁障碍、创伤后应激障碍(post-traumatic stress disorder,PTSD)、严重人格障碍(如边缘性人格障碍)等; (3)合并严重躯体疾病的患者,包括高血压、糖尿病、冠心病、甲状腺疾病等; (4)伴有酒精或物质依赖; (5)存在严重自杀观念、自伤行为及自杀未遂者; (6)服用过抗抑郁药物或有电抽搐治疗史者,或正在接受系统心理治疗或经颅磁刺激治疗者等; (7)3个月内经历较大手术者或2周内处于持续感冒发热等状态; (8)正在接受糖皮质激素类药物治疗的患者; (9)孕妇或哺乳期妇女; (10)左利手者; (11)有MRI扫描禁忌症,无法完成MRI扫描或无法在密闭空间独处超过1 h者。
1.2 分组根据纳入和排除标准,通过CTQ-SF及童年经历访谈确定抑郁症患者是否有童年创伤。根据CTQ-SF各分量表得分,定义抑郁症患者至少满足分量表得分中的1项(情感忽视≥15分,躯体忽视≥10分,性虐待≥8分,躯体虐待≥10分,情感虐待≥13分)即确定为有童年创伤经历,患者可能经历单一或多重童年创伤。若患者以上分量表均为阴性,则认为该患者无童年创伤经历。
本研究共纳入初发未治有童年创伤经历的抑郁症组(观察组)48例,初发未治无童年创伤经历的抑郁症组(对照组)27例。排除观察组在MRI扫描过程中存在大脑病变、结构异常的患者1例,头动过大的患者4例及对照组头动过大的患者2例后,符合条件的观察组有43例,对照组有25例。进一步匹配两组患者人数、年龄、性别、受教育年限等人口学信息及抑郁严重程度,最后纳入统计的两组患者各25例。
本研究于2019年1月14日通过重庆医科大学附属第一医院伦理委员会审批(审查批号:2019-011)。
1.3 一般人口学信息和心理评估指标所有患者在入组时完成汉密尔顿抑郁量表24项(Hamilton depression scale-24,HAMD-24)测评和大五人格问卷(neuroticism extraversion openness five-factor inventory,NEO-FFI)调查。此外,采用CTQ-SF对抑郁症患者的童年创伤经历类型和程度进行定量评估,设计社会人口学问卷以了解抑郁症患者的一般情况。
1.3.1 社会人口学调查问卷包含患者的年龄、性别、受教育年限等。
1.3.2 CTQ-SF[15]该问卷在临床和非临床被试调查中均具有可行性,共有28个条目(25个临床条目,3个效度条目),将儿童期创伤分为5个分量表:躯体虐待、情感虐待、性虐待、躯体忽视、情感忽视。该量表的内部一致性系数为0.893。
1.3.3 HAMD-24[16]采用HAMD-24作为评定患者抑郁症状严重程度的他评量表。由2名经过一致性培训并合格的精神科研究生对患者进行联合检查,使用规定的指导语。检查结束后由2名检查者独立评分,他们并不清楚患者的分组情况,避免了主观评分,评分后计算Kappa值>0.6即为有效评分,其信度为0.88~0.99,效度为0.92。
1.3.4 NEO-FFI[17]采用NEO-FFI评定患者人格特质,该问卷共60个条目,包含5个分量表(神经质、外向性、开放性、宜人性、责任心)。每个分量表含12个条目,每条目均采用5点计分,得分越高说明其越具有该人格特质。各分量表的内部一致性系数分别为0.87、0.82、0.89、0.85、0.82。
1.4 MRI数据采集与预处理 1.4.1 MRI数据采集所有患者MRI数据均通过GE Signa HDx 3.0 T磁共振成像仪(美国GE MedicalSystems公司)采集。采取标准的8通道头部线圈扫描,扫描前去除患者外衣及身上的金属物品,在患者头部双侧放入泡沫软垫以固定头部,限制其在MRI扫描中可能的头部运动; 嘱患者闭目并保持静止,在扫描过程中维持清醒状态且不要想事情。如扫描中发现患者躯体或头部活动则重新扫描; 扫描结束时询问患者是否在扫描期间入睡,如患者入睡则重新扫描或去除该患者数据。扫描过程先行常规水平面T1加权成像(T1 weighted imaging,T1WI)、T2加权成像(T2 weighted imaging,T2WI)及T2加权液体衰减反转恢复(T2 weighted-fluid attenuated inversion recovery,T2WI-FLAIR)序列扫描以排除患者可能的大脑病变或结构异常,如患者存在以上问题则排除该患者数据并建议其至相关科室就诊。然后进行静息态fMRI扫描,采用平面回波成像(echo planar imaging,EPI)序列,共采集240帧图像,持续时间480 s,采集参数:重复时间2 000 ms,回波时间30 ms,视野240 mm×240 mm,层厚5 mm,层间距0 mm,翻转角90°,矩阵64 mm×64 mm,层数为33层。
1.4.2 fMRI数据预处理参考王培佳等[18] fMRI mALFF数据预处理方法及Ge等[19]FC的数据预处理方法,利用SPM 8软件包(http://www.fil.ion.ucl.ac.uk/spm/)和RESTPlus软件包(http://www.restfmri.net/forum/RESTPlusV1.2)进行静止状态fMRI数据预处理。预处理步骤包括原始数据格式转换、删除前10个时间点数据(以避免如开机头动等原因带来的数据不稳定)、时间层校正、头动校正(剔除头动位移超过2 mm、旋转超过1°的患者)、空间标准化(选取SPM 8软件包自带蒙特利尔标准空间EPI配准)、配准后的图像以3 mm×3 mm×3 mm的分辨率重新切片、高斯核空间平滑(全宽半高为6 mm)、回归协变量(回归脑白质信号、脑脊液信号及全脑平均信号)、去线性漂移及滤波(0.01~0.08 Hz),最后计算标准化的低频振幅(amplitude of low-frequency fluctuation,ALFF)值并获得mALFF信号值及经Fisher Z变换的基于全脑体素的z-FC值。
1.5 统计学处理 1.5.1 研究对象样本量的估算根据本研究目的,基于全脑的分析中体素较多且对每个体素计算其效应量困难,因此通过观察组和对照组患者主要问卷大五人格差异指标神经质得分来计算样本量。样本量计算公式n1=n2=2σ2/(μ2-μ1)2×f(α, β),公式中σ2为两组的合并标准差; μ1与μ2分别为两组的均数; α为第Ⅰ类错误概率,β为第Ⅱ类错误概率,设置α为0.05、β为0.2。根据预实验结果,观察组5例[神经质分量表得分为(44.00±3.87)分],对照组5例[神经质分量表得分为(40.20±3.77)分],计算得两组所需样本量至少各17例。
1.5.2 人口学及量表评估指标应用SPSS 25.0软件对数据进行分析。满足正态分布的计量资料以x±s表示,采用独立样本t检验及Pearson相关分析; 不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,采用Mann-Whitney U检验及Spearman相关分析。计数资料以例数和百分数表示,组间比较采用χ2检验。检验水准(α)为0.05。
1.5.3 fMRI数据的统计分析利用SPM 12软件包(http://www.fil.ion.ucl.ac.uk/spm/)对预处理后的MRI数据进行分析,行独立样本t检验,利用RESTPlus软件包,采用高斯随机场(Gauss random field,GRF)进行多重比较校正。基于全脑的掩模(MASK),将体素水平设置为P<0.001、团块水平设置为P<0.05的团块定义为两组间差异有统计学意义的团块。利用xjview 9.6软件包(http://www.alivelearn.net/xjview)分别制作差异有统计学意义脑区的MASK,再利用RESTPlus软件包提取每例患者脑区的mALFF信号值,将这些信号值与大五人格中神经质分量表进行Pearson或Spearman相关分析。
将左侧海马脑区MASK作为种子点计算所得的两组患者的z-FC信号值在SPM 12软件包中进行独立样本t检验,再利用RESTPlus软件包进行体素水平P<0.001、团块水平P<0.05的GRF多重比较校正,定义通过以上校正的脑区为两组FC差异有统计学意义的脑区。
2 结果 2.1 两组患者的基本人口学信息和抑郁严重程度比较如表 1所示,观察组和对照组患者的年龄、性别、受教育年限及HAMD-24得分差异均无统计学意义(P均>0.05)。
|
|
表 1 两组抑郁症患者基本信息比较 Tab 1 Comparison of basic information of patients with depression between 2 groups |
2.2 两组患者NEO-FFI各分量表得分比较
如表 2所示,观察组患者NEO-FFI神经质分量表得分高于对照组,差异有统计学意义(P<0.01);其余4个分量表得分两组间比较差异均无统计学意义(P均>0.05)。
|
|
表 2 两组抑郁症患者NEO-FFI评分比较 Tab 2 Comparison of NEO-FFI scores of patients with depression between 2 groups |
2.3 两组患者mALFF信号值差异有统计学意义的脑区
观察组和对照组患者头动数据中,位移在X、Y、Z方向差异有统计学意义(P<0.05);旋转角度在Yaw方向差异有统计学意义(P<0.05),在Pitch、Roll方向差异无统计学意义(P>0.05)。以两组患者头动数据作为协变量,在静息状态下观察组相较于对照组患者存在mALFF信号值较低的2个脑区,一个脑区包括左侧海马及左侧海马旁回[团块大小138;峰值点蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)坐标(-24,-39,-6),t=-6.319 3],另一个脑区包括右侧楔前叶[团块大小123;峰值点MNI坐标(21,-48,24),t=-6.091 7],通过体素水平P<0.001、团块水平P<0.05的GRF校正未发现两组在杏仁核、前额叶皮质、前扣带回等脑区激活差异有统计学意义。见图 1。
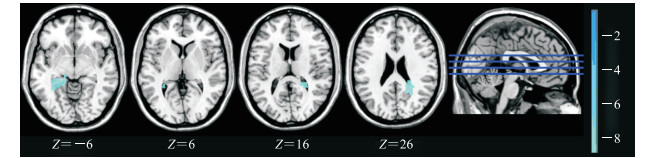
|
图 1 观察组与对照组mALFF信号值差异有统计学意义的脑区 Fig 1 Brain areas where the difference in mALFF values is statistically significant between observation group and control group The Z value in the figure represents the axis coordinates of the brain profile in the MNI space; the color bars represent the different activation levels of the 2 groups, light blue represents that the brain activation of the observation group is less than the control group, the lighter the color, the greater the difference. Observation group: Depression patients with childhood traumatic experience; Control group: Depression patients without childhood traumatic experience. mALFF: Magnetic resonance brain spontaneous amplitude of low-frequency fluctuation; MNI: Montreal Neurological Institute. |
2.4 两组患者差异脑区mALFF信号值与NEO-FFI神经质分量表得分的相关性
将观察组和对照组患者具有差异性的指标即左侧海马/左侧海马旁回脑区、右侧楔前叶mALFF信号值分别与NEO-FFI神经质分量表得分进行相关分析。因左侧海马/左侧海马旁回脑区、右侧楔前叶mALFF信号值不服从正态分布,故采用Spearman相关分析。结果显示,左侧海马/左侧海马旁回脑区mALFF信号值与神经质分量表得分呈负相关(r=-0.397,P<0.01),右侧楔前叶mALFF信号值与神经质分量表得分也呈负相关(r=-0.401,P<0.01)。
2.5 两组患者脑FC差异有统计学意义的脑区将以上mALFF结果中的左侧海马脑区作为种子点,基于全脑体素水平,以两组患者头动数据作为协变量,行静息态FC分析。结果发现,经体素水平P<0.001、团块水平P<0.05的GRF校正后,观察组较对照组右侧颞上回连接增加[团块大小92;峰值点MNI坐标(42,12,-24),t=4.216];左侧中央后回连接减弱[团块大小163;峰值点MNI坐标(-45,-21,30),t=-5.216],见图 2。
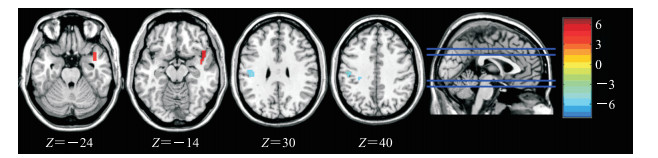
|
图 2 观察组与对照组FC差异有统计学意义的脑区(以左侧海马脑区为种子点,P<0.05) Fig 2 Brain areas where the differences of FC between observation group and control group is statistically significant (using the left hippocampus as the seed point, P < 0.05) The Z value in the figure represents the axial coordinates of the brain section in MNI space; the color bars represent different FC between the 2 groups. The red part of the brain area is the right superior temporal gyrus, and the blue part of the brain area is the left central posterior gyrus. Observation group: Depression patients with childhood traumatic experience; Control group: Depression patients without childhood traumatic experience. FC: Functional connectivity; MNI: Montreal Neurological Institute. |
3 讨论
有学者提出抑郁症发生的心理层次可能存在着“点燃”假说[20],生活压力可能会增强个体对压力的长期易感,降低达到抑郁发作所需的压力阈值,因此个体在遭受相对较小的生活事件后也可能引起抑郁发作。本研究发现,在抑郁程度相同的情况下,有童年创伤经历的抑郁症患者神经质人格倾向水平更高。神经质水平可间接反映个体在压力应激事件中感知负性体验的能力。既往研究发现神经质水平较高的个体更易感知负性生活事件带来的威胁及压力[21],因此,我们推测个体的童年创伤经历及增高的神经质水平使其更易感受生活事件的威胁与压力,且可能是其在今后生活中易患抑郁症的重要社会心理因素。
海马在人出生后开始发育,并对生命早期的应激高度敏感[22]。研究发现每个应激事件都会在海马上留下“印记”,使其更易感受应激源的影响[23]。长期的应激会导致海马神经元萎缩与突触抑制[24],有人认为这可能是在静息状态下抑郁症患者海马激活减低的原因之一[25]。本研究发现,有童年创伤经历的抑郁症患者较无童年创伤经历的患者左侧海马/左侧海马旁回脑区静息态mALFF信号值更低,这提示有童年创伤经历的抑郁症患者海马功能可能受到更大的影响。有研究发现额顶网络通过抑制海马活动阻止侵入性记忆进入意识[26],说明人体可能存在主动遗忘负面记忆的机制。也有研究发现海马旁回在个体对自传体记忆的编码与提取过程中激活增强[27]。本研究中有童年创伤经历的抑郁症患者左侧海马/左侧海马旁回激活降低,提示可能存在一种屏蔽创伤记忆闯入的保护性功能,可以帮助其适当处理创伤记忆,避免出现如PTSD患者的闪回现象。这从侧面反映出有童年创伤经历的抑郁症可能与PTSD[28]有不同的神经影像学机制。
本研究发现,患者左侧海马/左侧海马旁回脑区的静息态mALFF信号值与其神经质得分呈负相关,这与文献报道[29]的结果类似。作为衡量个体感知压力的人格特质,神经质得分与左侧海马/左侧海马旁回脑区mALFF信号值的负相关关系从侧面印证了抑郁症患者海马功能的强弱影响其知觉压力的体验。因此,我们认为有童年创伤经历的抑郁症患者相较无童年创伤经历的患者海马功能受损程度更大,但同时可能形成一种记忆保护功能,以减少对童年创伤记忆的过度唤起,减少童年创伤经历对患者的进一步影响,并在临床表现上区别于同样具有童年创伤经历的PTSD患者; 另一方面提示该类患者在面对负性生活事件时更易感受压力并产生应激反应,当应激事件难以处理及应激反应过于强烈时易导致抑郁症的反复发作。
本研究还发现,有童年创伤经历的抑郁症患者右侧楔前叶静息态mALFF信号值较无童年创伤经历的患者低,这与文献报道[11, 30]的结果类似。但一项对有无童年创伤经历的健康人群进行任务态fMRI的研究发现,在应激任务期间有童年创伤经历的健康被试较无童年创伤经历的健康被试楔前叶激活增加[31]。这可能是研究对象与实验范式与本研究不同所致,本研究中被试均为抑郁症患者,且为静息态下检测。楔前叶作为默认模式网络(default mode network,DMN)的重要脑区,其作用为检索自传体记忆并将其匹配至当下环境中[32],当个体回忆其自传体记忆时楔前叶激活增加[33]。本研究中抑郁症患者右侧楔前叶的mALFF信号值与NEO-FFI神经质分量表得分呈负相关,说明神经质水平较高的抑郁症患者其检索自传体记忆及适应当下环境的能力可能较弱。有童年创伤经历的抑郁症患者具有较高的神经质水平,可能反映其对自传体记忆有更强的压抑,这也与前文我们推测有童年创伤经历的抑郁症患者可能存在对创伤记忆过度唤起的屏蔽功能相呼应。
鉴于本研究发现海马可能在有童年创伤经历的抑郁症患者中扮演着重要作用,以左侧海马脑区作为种子点向全脑做FC,发现有童年创伤经历的抑郁症患者较无童年创伤经历的患者左侧海马与右侧颞上回连接增加,这与文献报道[34]的结果类似。但也有研究发现健康个体在经历急性应激后海马与颞上回连接减弱[35]。这可能与诊断或创伤的类型(如海马与颞上回的FC是一个动态变化过程,其是否随急性应激发展为慢性创伤过程而变化)有关,未来应进一步深入研究。本研究还发现有童年创伤经历的抑郁症患者左侧海马与左侧中央后回连接减弱。有研究认为海马与中央后回的FC可能表明内感受系统参与抑郁症的发生、发展,其连接增加可能是海马识别内感受信号并以此信号为线索对记忆进行存储和检索[36]。因此,本研究发现海马与中央后回连接减弱可能也从侧面反映了有童年创伤经历的抑郁症患者对其记忆的压抑。
本研究发现两组抑郁症患者在杏仁核、前额叶皮质、前扣带回等脑区不存在激活差异。有研究发现抑郁症患者较健康对照组静息态杏仁核激活增加[37],本团队前期研究也发现通过统计学回归方法处理了童年创伤这一影响因素后,抑郁症患者较健康对照组静息态杏仁核激活增加[13]。结合本研究结果,我们推测静息态杏仁核活动差异可能存在于抑郁症患者与健康被试间,而有或无童年创伤经历的抑郁症患者静息态下其杏仁核活动可能都处于较高的激活状态。另有一些研究指出抑郁症患者在对负性信息加工时出现前额叶[38]及前扣带回[39]各亚区不同的激活改变,但本研究未发现类似变化,可能与本研究检查的患者是在静息态而非任务态下的脑区活动有关。
综上所述,本研究发现初发未治的有与无童年创伤经历的抑郁症患者存在着神经质及左侧海马/海马旁回脑区、右侧楔前叶静息态fMRI脑功能激活的差异,并且发现两组患者在左侧海马分别与右侧颞上回及左侧中央后回的FC差异。相关性分析发现,患者神经质水平越高左侧海马/海马旁回脑区、右侧楔前叶脑激活越弱,提示有童年创伤经历的抑郁症患者以上脑区功能受损更重、神经质水平更高、面对生活事件时更易感知负性压力,可能存在区别于PTSD的脑区记忆的神经影像学保护机制,以减少平日对童年创伤记忆的过度唤起。本研究存在一定的局限性:横断面研究、未设健康人群对照、样本量较小、无神经内分泌等生物学指标等。未来可以扩大样本量,纳入有与无童年创伤经历的健康对照组,采集更多层次的生理和心理指标进行更全面的研究,以得出可重复的研究结果; 也可进行相关的路径分析,探索神经质等心理指标和脑区结构与功能多模态指标作为童年创伤对抑郁症发生的中介调节作用; 还可进行临床干预及其效果追踪研究的纵向研究等,为探索有童年创伤经历的抑郁症的疗效预测因子提供更直接的循证依据,为进一步探索临床干预靶点奠定基础。
| [1] |
NELSON J, KLUMPARENDT A, DOEBLER P, EHRING T. Childhood maltreatment and characteristics of adult depression: meta-analysis[J]. Br J Psychiatry, 2017, 210: 96-104. DOI:10.1192/bjp.bp.115.180752 |
| [2] |
CONGIO A C, NORCIA M, URBANO M R, VERRI W A Jr, VARGAS NUNES S O. Association of clinical features and biomarkers with treatment-resistant depression[J]. Neurol Psychiatry Brain Res, 2020, 36: 32-38. DOI:10.1016/j.npbr.2020.02.004 |
| [3] |
HEIM C, PLOTSKY P M, NEMEROFF C B. Importance of studying the contributions of early adverse experience to neurobiological findings in depression[J]. Neuropsychopharmacology, 2004, 29: 641-648. DOI:10.1038/sj.npp.1300397 |
| [4] |
XIE P, WU K, ZHENG Y J, GUO Y B, YANG Y L, HE J F, et al. Prevalence of childhood trauma and correlations between childhood trauma, suicidal ideation, and social support in patients with depression, bipolar disorder, and schizophrenia in Southern China[J]. J Affect Disord, 2018, 228: 41-48. DOI:10.1016/j.jad.2017.11.011 |
| [5] |
SPINHOVEN P, ELZINGA B M, VAN HEMERT A M, DE ROOIJ M, PENNINX B W. Childhood maltreatment, maladaptive personality types and level and course of psychological distress: a six-year longitudinal study[J]. J Affect Disord, 2016, 191: 100-108. DOI:10.1016/j.jad.2015.11.036 |
| [6] |
阎燕燕, 孟宪璋. 童年创伤和虐待与成年精神障碍[J]. 中国临床心理学杂志, 2005, 13: 208-209. DOI:10.3969/j.issn.1005-3611.2005.02.029 |
| [7] |
PAULUS D J, VANWOERDEN S, NORTON P J, SHARP C. Emotion dysregulation, psychological inflexibility, and shame as explanatory factors between neuroticism and depression[J]. J Affect Disord, 2016, 190: 376-385. DOI:10.1016/j.jad.2015.10.014 |
| [8] |
WANG J J, HE X L, CHEN Y S, LIN C W. Association between childhood trauma and depression: a moderated mediation analysis among normative Chinese college students[J]. J Affect Disord, 2020, 276: 519-524. DOI:10.1016/j.jad.2020.07.051 |
| [9] |
LEE M A, SONG R. Childhood abuse, personality traits, and depressive symptoms in adulthood[J]. Child Abuse Negl, 2017, 65: 194-203. DOI:10.1016/j.chiabu.2017.02.009 |
| [10] |
TAKESIAN A E, HENSCH T K. Balancing plasticity/stability across brain development[J]. Prog Brain Res, 2013, 207: 3-34. |
| [11] |
WANG W, KANG L J, ZHANG N, GUO X, WANG P L, ZONG X F, et al. The interaction effects of suicidal ideation and childhood abuse on brain structure and function in major depressive disorder patients[J/OL]. Neural Plast, 2021, 2021: 7088856. DOI: 10.1155/2021/7088856.
|
| [12] |
WU X R, HE H, SHI L, XIA Y M, ZUANG K X, FENG Q Y, et al. Personality traits are related with dynamic functional connectivity in major depression disorder: a resting-state analysis[J]. J Affect Disord, 2019, 245: 1032-1042. DOI:10.1016/j.jad.2018.11.002 |
| [13] |
DU L, WANG J J, MENG B, YONG N, YANG X Y, HUANG Q L, et al. Early life stress affects limited regional brain activity in depression[J/OL]. Sci Rep, 2016, 6: 25338. DOI: 10.1038/srep25338.
|
| [14] |
范肖冬, 蒋向东, 于欣, 刘平, 译. ICD-10精神与行为障碍分类[M]. 北京: 人民卫生出版社, 1993: 97-101.
|
| [15] |
傅文青, 姚树桥, 于宏华, 赵幸福, 李茹, 李英, 等. 儿童期创伤问卷在中国高校大学生中应用的信效度研究[J]. 中国临床心理学杂志, 2005, 13: 40-42. |
| [16] |
张明园, 何燕玲. 精神科量表评定手册[M]. 长沙: 湖南科学技术出版社, 2015: 143-148.
|
| [17] |
黄希庭. 人格手册: 理论与研究[M]. 2版. 上海: 华东师范大学出版社, 2003: 151-156.
|
| [18] |
王培佳, 王尔东, 郁仁强, 胡潇予, 周俊鑫, 黄杰, 等. 心理剧联合药物对伴童年创伤抑郁症患者焦虑抑郁、应对方式及自发低频振幅的影响[J]. 第三军医大学学报, 2020, 42: 111-118. |
| [19] |
GE S Y, HU Q F, GUO Y J, XU K, XIA G W, SUN C Y. Potential alterations of functional connectivity analysis in the patients with chronic prostatitis/chronic pelvic pain syndrome[J]. Neural Plast, 2021, 2021: 6690414. DOI:10.1155/2021/6690414 |
| [20] |
MONROE S M, HARKNESS K L. Life stress, the "kindling" hypothesis, and the recurrence of depression: considerations from a life stress perspective[J]. Psychol Rev, 2005, 112: 417-445. DOI:10.1037/0033-295X.112.2.417 |
| [21] |
LIU S, LITHOPOULOS A, ZHANG C Q, GARCIA-BARRERA M A, RHODES R E. Personality and perceived stress during COVID-19 pandemic: testing the mediating role of perceived threat and efficacy[J/OL]. Pers Individ Dif, 2021, 168: 110351. DOI: 10.1016/j.paid.2020.110351.
|
| [22] |
LESCHIK J, LUTZ B, GENTILE A. Stress-related dysfunction of adult hippocampal neurogenesis—an attempt for understanding resilience?[J/OL]. Int J Mol Sci, 2021, 22: 7339. DOI: 10.3390/ijms22147339.
|
| [23] |
LECEI A, VAN WINKEL R. Hippocampal pattern separation of emotional information determining risk or resilience in individuals exposed to childhood trauma: linking exposure to neurodevelopmental alterations and threat anticipation[J]. Neurosci Biobehav Rev, 2020, 108: 160-170. DOI:10.1016/j.neubiorev.2019.11.010 |
| [24] |
CHAUDHURY D, LIU H, HAN M H. Neuronal correlates of depression[J]. Cell Mol Life Sci, 2015, 72: 4825-4848. DOI:10.1007/s00018-015-2044-6 |
| [25] |
LI G S, LIU Y J, ZHENG Y T, WU Y, LI D N, LIANG X Y, et al. Multiscale neural modeling of resting-state fMRI reveals executive-limbic malfunction as a core mechanism in major depressive disorder[J/OL]. Neuroimage Clin, 2021, 31: 102758. DOI: 10.1016/j.nicl.2021.102758.
|
| [26] |
GAGNEPAIN P, HULBERT J, ANDERSON M C. Parallel regulation of memory and emotion supports the suppression of intrusive memories[J]. J Neurosci, 2017, 37: 6423-6441. DOI:10.1523/JNEUROSCI.2732-16.2017 |
| [27] |
VIARD A, DESGRANGES B, EUSTACHE F, PIOLINO P. Factors affecting medial temporal lobe engagement for past and future episodic events: an ALE meta-analysis of neuroimaging studies[J]. Brain Cogn, 2012, 80: 111-125. DOI:10.1016/j.bandc.2012.05.004 |
| [28] |
MARY A, DAYAN J, LEONE G, POSTEL C, FRAISSE F, MALLE C, et al. Resilience after trauma: the role of memory suppression[J/OL]. Science, 2020, 367: eaay8477. DOI: 10.1126/science.aay8477.
|
| [29] |
SERVAAS M N, VAN DER VELDE J, COSTAFREDA S G, HORTON P, ORMEL J, RIESE H, et al. Neuroticism and the brain: a quantitative meta-analysis of neuroimaging studies investigating emotion processing[J]. Neurosci Biobehav Rev, 2013, 37: 1518-1529. DOI:10.1016/j.neubiorev.2013.05.005 |
| [30] |
刘志芬, 乔丹, 张爱霞, 康丽君, 徐一凡, 张克让. 经历童年虐待抑郁症患者静息态功能磁共振成像研究[J]. 中华精神科杂志, 2019, 52: 320-324. DOI:10.3760/cma.j.issn.1006-7884.2019.05.005 |
| [31] |
ZHONG X, MING Q S, DONG D F, SUN X Q, CHENG C, XIONG G, et al. Childhood maltreatment experience influences neural response to psychosocial stress in adults: an fMRI study[J/OL]. Front Psychol, 2020, 10: 2961. DOI: 10.3389/fpsyg.2019.02961.
|
| [32] |
ZHONG X, PU W D, YAO S Q. Functional alterations of fronto-limbic circuit and default mode network systems in first-episode, drug-naïve patients with major depressive disorder: a meta-analysis of resting-state fMRI data[J]. J Affect Disord, 2016, 206: 280-286. |
| [33] |
ST JACQUES P L, SZPUNAR K K, SCHACTER D L. Shifting visual perspective during retrieval shapes autobiographical memories[J]. NeuroImage, 2017, 148: 103-114. |
| [34] |
SAXBE D, KHODDAM H, PIERO L D, STOYCOS S A, GIMBEL S I, MARGOLIN G, et al. Community violence exposure in early adolescence: longitudinal associations with hippocampal and amygdala volume and resting state connectivity[J/OL]. Dev Sci, 2018, 21: e12686. DOI: 10.1111/desc.12686.
|
| [35] |
SHIELDS G S, MCCULLOUGH A M, RITCHEY M, RANGANATH C, YONELINAS A P. Stress and the medial temporal lobe at rest: functional connectivity is associated with both memory and cortisol[J]. Psychoneuroendocrinology, 2019, 106: 138-146. |
| [36] |
VEGA J N, TAYLOR W D, GANDELMAN J A, BOYD B D, NEWHOUSE P A, SHOKOUHI S, et al. Persistent intrinsic functional network connectivity alterations in middle-aged and older women with remitted depression[J/OL]. Front Psychiatry, 2020, 11: 62. DOI: 10.3389/fpsyt.2020.00062.
|
| [37] |
LAI C H. Fronto-limbic neuroimaging biomarkers for diagnosis and prediction of treatment responses in major depressive disorder[J/OL]. Prog Neuropsychopharmacol Biol Psychiatry, 2021, 107: 110234. DOI: 10.1016/j.pnpbp.2020.110234.
|
| [38] |
OPEL N, REDLICH R, GROTEGERD D, DOHM K, ZAREMBA D, MEINERT S, et al. Prefrontal brain responsiveness to negative stimuli distinguishes familial risk for major depression from acute disorder[J]. J Psychiatry Neurosci, 2017, 42: 343-352. |
| [39] |
PIZZAGALLI D A, ROBERTS A C. Prefrontal cortex and depression[J]. Neuropsychopharmacology, 2022, 47: 225-246. |
 2022, Vol. 43
2022, Vol. 43


