2. 上海中医药大学附属上海市中西医结合医院植物药与疾病分子生物学实验室,上海 200082;
3. 上海中医药大学研究生院,上海 201210
2. Laboratory of Phytomedicine and Disease Biochemistry, Shanghai Traditional Chinese Medicine-Integrated Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200082, China;
3. Graduate School, Shanghai University of Traditional Chinese Medicine, Shanghai 201210, China
糖尿病(diabetes mellitus,DM)是一种慢性代谢性疾病,其患病率在全球范围内呈上升趋势。糖尿病心肌病(diabetic cardiomyopathy,DCM)可引起心功能损害,导致心力衰竭甚至死亡,约有12%的DM患者合并DCM[1]。DCM的发病机制不明,疾病早期无明显症状,因而很容易被临床忽视和漏诊。目前对DCM既无灵敏、特异的生物学诊断指标,也无有效的药物治疗方法[1]。1974年著名的Framingham对DM心力衰竭风险的研究表明,在校正年龄、高血压、肥胖、血脂异常和冠状动脉疾病等危险因素后,男性DM患者的心力衰竭风险是正常男性的2.4倍,女性DM患者的心力衰竭风险是正常女性的5倍[2]。目前将DCM定义为排除冠心病、瓣膜性心脏病和高血压等其他相关致病因素后,DM患者出现的心室功能障碍;DCM诊断的最低标准包括左心室舒张功能障碍和/或左心室射血分数降低、病理性左心室肥厚和间质纤维化[3],治疗方法主要是以控制血糖及改善心力衰竭为主[4]。
Hippo信号通路是一种信号级联反应,最初是在果蝇中发现[5]。在哺乳动物中Hippo信号通路是由丝氨酸/苏氨酸激酶、转录共激活因子和转录因子构成。在激酶级联反应中哺乳动物Ste20样激酶(mammalian sterile 20-like protein kinase,Mst)1/2与适配蛋白salvador相互作用后磷酸化多个蛋白,包括salvador、大肿瘤抑制基因1/2(large tumor suppressor 1/2,Lats1/2)和单级纺锤体-结合蛋白1 (monopolar spindle-one binder 1,MOB1),增加Lats1/2和MOB1的相互作用,磷酸化的Lats1/2在多个位点上磷酸化转录共激活因子Yes相关蛋白(Yes-associated protein,Yap)和PDZ结合基序转录共激活因子(transcriptional coactivator with PDZ-binding motif,Taz),使其滞留在细胞质并随后被泛素化降解;相反,上游激酶失活会导致Yap和Taz的核易位,并与多种转录因子包括转录增强因子结构域家族成员(transcriptional enhancer factor domain family member,Tead)1~4相互作用,导致下游靶基因的活化,调控细胞增殖、存活和分化等[6]。这一信号通路的失调与多种疾病的病理生理有关。研究表明,Hippo信号通路受机体代谢的影响,包括肥胖、2型糖尿病、非酒精性脂肪肝、心血管疾病及肿瘤等[7]。
红景天是传统中草药,为景天科植物红景天Rhodiola rosea Limn. 或大花红景天Rhodiola euryphylla(Frod.)S.H.Fu.的根茎,归肺、心经,具有健脾益气、清肺止咳、活血化瘀的功效。红景天苷(salidroside,SAL)为红景天的重要成分。
本研究试图通过链脲佐菌素(streptozotocin,STZ)诱导的SD大鼠DM模型,观察Hippo信号通路在DM模型大鼠心脏损害发病中的作用机制,同时给予SAL干预并观察其可能的药理作用。
1 材料和方法 1.1 实验动物20只SPF级雄性SD大鼠由基尔顿生物科技(上海)有限公司提供[实验动物生产许可证号:SCXK(沪)2017-0005],4周龄,体重159~191 g。大鼠适应性饲养2周后随机分为空白对照组、DM模型组(STZ组)和SAL干预组(SAL组)。动物饲养于SPF级动物实验室[实验动物使用许可证号:SYXK(沪)2016-0004],室温控制在(22±2)℃,相对湿度控制在50%,人工光照,明暗各12 h。实验操作通过上海中医药大学动物伦理委员会审批(PZSHUTCM200417004)。
1.2 药物与试剂SAL(FY1289B0510),南通经纬生物科技有限公司;STZ(WXBD0304V),美国Sigma公司;TUNEL检测试剂盒(11684817910),瑞士Roche公司;Mst1/2抗体(DF5869)、磷酸化(phosphorylated,p)-Mst1/2抗体(AF2367)、Yap抗体(AF6328)和p-Yap(AF33 28)抗体,美国Affinity公司;Lats1/2抗体(Bs-2904R)和p-Lats1/2抗体(Bs-7913R),美国Bioss公司;GAPDH抗体(60004-1-1G),美国Proteintech公司;TNF-α(ab234570)、IL-1β(ab255730)和IL-6(ab236712)ELISA检测试剂盒,英国Abcam公司;反转录试剂盒(K1622),加拿大Fermentas公司;SYBR Green荧光定量PCR试剂盒(K0223),美国ThermoFisher公司。一般实验室耗材由基尔顿生物科技(上海)有限公司提供。
1.3 血标本制备处死的大鼠解剖腹腔,分离暴露腹主动脉,抽取2.5 mL血液,分离血清后即置于-25 ℃冰箱保存,3 h后置于-80 ℃冰箱保存备用。
1.4 心脏标本摘取处死的大鼠解剖胸腔,分离心脏,取出后用0.9%氯化钠溶液5 mL冲洗1次,滤纸吸干,称各组心脏质量并记录,心重指数测定备用[心重指数=心脏质量(g)/体重(g)×1 000]。心尖组织用于观察心肌组织病理学改变,左心房组织用于测定心肌细胞凋亡率,左心室组织用于心肌组织内炎症因子测定,右心室组织用于心肌组织凋亡和Hippo信号通路检测,右心房组织用于检测心肌组织Yap mRNA表达水平。
1.5 DM动物模型制作及分组在禁食不禁水条件下饲养24 h后,15只大鼠分别一次性腹腔注射STZ(65 mg/kg)诱导DM模型,其余5只大鼠腹腔注射生理盐水(空白对照组)。分别在造模第3、7、21天各测定1次随机血糖,以3次随机血糖测定值均≥11.1 mmol/L作为DM造模成功的标准。在3周观察期中,2只大鼠死亡;3只大鼠3次随机血糖测定值均<11.1 mmol/L,判定为造模失败,另行分置动物饲养笼饲养。造模成功的10只大鼠再次随机分为STZ组和SAL组,每组5只。
1.6 SAL干预在STZ建模第22天后,各组大鼠予隔天灌胃治疗1次,共10次,每次灌胃剂量均为2 mL/只大鼠。空白对照组和STZ组给予生理盐水灌胃,SAL组给予SAL(55 mg/kg)灌胃。造模第45天,各组大鼠予10%水合氯醛(3 mL/kg)腹腔注射麻醉处死。
1.7 相关指标检查 1.7.1 心脏病理检查将大鼠心脏组织脱水后,石蜡包埋,连续切片,厚度为4~5 μm。行H-E和Masson染色观察心肌组织的病理改变,行TUNEL染色检测细胞凋亡率。
1.7.2 外周血及心肌组织中TNF-α、IL-1β和IL-6检测取大鼠左心室组织,加入生理盐水3 mL匀浆器匀浆,离心后取上清1 mL备用。外周血离心,收集上清1 mL备用。TNF-α、IL-1β和IL-6的检测按ELISA试剂盒说明书操作。
1.7.3 蛋白质印迹法检测将大鼠右心室组织剪碎为小组织块,加入RIPA蛋白裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂),采用BCA法进行蛋白定量。取50 μg蛋白上样进行SDS-PAGE,半干转膜法转至PVDF膜。5%脱脂牛奶(检测磷酸化蛋白用BSA)室温封闭1 h,分别加入特异性一抗4 ℃孵育过夜(Mst1/2、p-Mst1/2、Lats1/2、p-Lats1/2、Yap和p-Yap抗体按1∶1 000比例稀释),TBST洗膜,加入荧光二抗室温孵育1 h。电化学发光法显色,以GAPDH为内参照计算各目的蛋白的相对表达量。
1.7.4 RT-PCR检测心肌组织中Yap mRNA表达取大鼠右心房组织,提取总RNA;反转录合成cDNA;建立总体积25 μL反应体系进行PCR。PCR反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸10 s,反复40个循环。以GAPDH为内参。Yap上游引物序列为5'-CTG-GACCCAAGGCTTGACC-3',下游引物序列为5'-GC-TAATTCCCGCTCTGACG-3';GAPDH上游引物序列为5'-GGAGTCTACTGGCGTCTTCAC-3',下游引物序列为5'-ATGAGCCCTTCCACGATGC-3'。采用2-ΔΔCt法分析Yap mRNA的表达水平。
1.8 统计学处理应用SPSS 21.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 心重指数各组间大鼠心重指数差异有统计学意义(F=19.987,P<0.01)。与空白对照组(2.29±0.13)相比,STZ组大鼠心重指数增高(3.63±0.44),差异有统计学意义(t=-6.38,P<0.01);SAL干预后,大鼠心重指数与STZ组比较下降(3.02±0.35),差异有统计学意义(t=2.90,P=0.015);但经SAL干预后的大鼠心重指数仍高于空白对照组(t=3.52,P=0.005)。结果提示SAL对DM模型大鼠的心脏质量增加有抑制作用。
2.2 各组大鼠心肌组织病理学改变STZ组与SAL组大鼠心肌组织均显示结构异常。H-E染色结果显示,空白对照组(图 1A)大鼠心肌细胞排列整齐,细胞核结构清晰;STZ组(图 1B)大鼠心肌细胞排列紊乱,结构模糊,细胞核部分溶解,部分可见炎症细胞聚集;SAL组(图 1C)大鼠心肌细胞排列和炎症细胞浸润明显减轻。Masson染色结果显示,空白对照组(图 1D)大鼠心肌细胞间质见少量胶原纤维;STZ组(图 1E)大鼠心肌细胞数量明显减少,心肌细胞间质中见大量胶原纤维,部分心肌细胞周围胶原纤维呈团块状聚集分布;SAL组(图 1F)大鼠心肌细胞结构尚清晰,间质见少量炎症细胞浸润,心肌组织可见轻度胶原纤维增生。病理结果显示,SAL可改善DM模型大鼠的心肌细胞完整性,并可减少心脏组织内纤维增生。
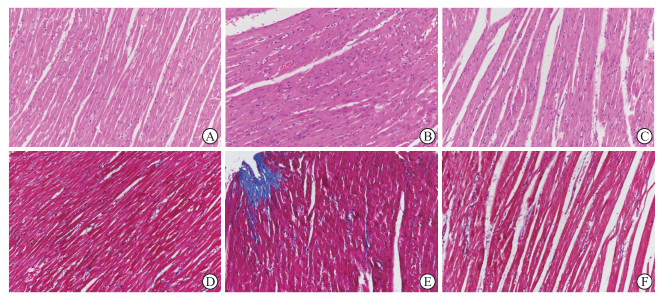
|
图 1 SAL对DM模型大鼠心肌组织病理学改变的影响(200×) Fig 1 Effect of SAL on myocardial histopathological changes in DM model rats (200×) A, D: Blank control group; B, E: STZ group; C, F: SAL group. A-C: Hematoxylin-eosin staining; D-F: Masson staining. SAL: Salidroside; DM: Diabetes mellitus; STZ: Streptozotocin. |
2.3 SAL对DM模型大鼠心肌细胞凋亡的影响
结果显示各组大鼠心肌细胞凋亡率差异有统计学意义(F=44.599,P<0.001)。STZ组大鼠心肌细胞凋亡率[(27.54±3.12)%]与空白对照组[(11.74±2.49)%]相比升高(t=9.30,P<0.01),而SAL组大鼠心肌细胞凋亡率[(22.03±2.39)%]较STZ组降低(t=-3.24,P=0.007)。
2.4 SAL对DM模型大鼠外周血及心肌组织中炎症因子的影响各组大鼠外周血中炎症因子TNF-α、IL-1β和IL-6表达水平差异均有统计学意义(P均<0.01)。与空白对照组比较,STZ组大鼠外周血中TNF-α、IL-1β和IL-6表达水平均升高,差异均有统计学意义(t=-11.12,P<0.01;t=-5.34,P=0.01;t=-4.13,P<0.01)。SAL干预后,大鼠外周血中TNF-α和IL-6表达水平下降,与STZ组比较差异有统计学意义(t=4.67,P=0.001;t=3.02,P=0.011),SAL对IL-1β表达虽然有一定的抑制作用,但差异无统计学意义(t=1.41,P=0.185)。见表 1。
|
|
表 1 DM模型大鼠外周血和心肌组织中炎症因子的表达 Tab 1 Expression of inflammation factors in peripheral blood and myocardial tissues of DM model rats |
各组大鼠心肌组织中炎症因子TNF-α、IL-1β和IL-6表达水平差异均有统计学意义(P均<0.05)。与空白对照组比较,STZ组大鼠心肌组织中TNF-α、IL-1β和IL-6表达水平均升高,差异均有统计学意义(t=-5.87,P<0.01;t=-3.44,P=0.005;t=-4.64,P=0.001)。SAL干预后,大鼠心肌组织中TNF-α表达水平下降,与STZ组比较差异有统计学意义(t=3.45,P=0.005);IL-6表达水平也较STZ组下降(t=2.39,P=0.034)。与外周血炎症因子测定结果类似,SAL对IL-1β表达也有一定的抑制作用,但差异无统计学意义(t=1.94,P=0.076)。见表 1。
2.5 SAL对DM模型大鼠心肌组织中Hippo信号通路的影响结果如图 2、表 2所示,在Hippo通路的检测中,各组间大鼠心肌组织中Mst1/2、p-Mst1/2、Lats1/2、p-Lats1/2、Yap和p-Yap的表达水平差异均有统计学意义(P均<0.05)。

|
图 2 蛋白质印迹法检测SAL对DM模型大鼠心肌组织中Hippo信号通路相关蛋白表达的影响 Fig 2 Effect of SAL on expression of Hippo signaling pathway-related proteins in myocardial tissues of DM model rats detected by Western blotting SAL: Salidroside; DM: Diabetes mellitus; BC: Blank control; STZ: Streptozotocin; Mst1/2: Mammalian sterile 20-like protein kinase 1/2; p-Mst1/2: Phosphorylated mammalian sterile 20-like protein kinase 1/2; Lats1/2: Large tumor suppressor 1/2; p-Lats1/2: Phosphorylated large tumor suppressor 1/2; Yap: Yes-associated protein; p-Yap: Phosphorylated Yes-associated protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
|
|
表 2 DM模型大鼠心肌组织中Hippo信号通路相关蛋白的表达 Tab 2 Expression of Hippo signaling pathway-related proteins in myocardial tissues of DM model rats |
与空白对照组比较,STZ组大鼠心肌组织中Mst1/2、Lats1/2和Yap表达水平均升高(t=-4.05,P<0.01;t=-2.62,P<0.05;t=-6.40,P<0.01),而p-Mst1/2、p-Lats1/2和p-Yap的表达水平均降低(t=6.40、5.66、8.01,P均<0.01)。见表 2。
SAL干预后,大鼠心肌组织中Mst1/2的表达水平与STZ组比较有降低趋势,但差异无统计学意义(t=1.84,P=0.09),而Lats1/2和Yap表达水平均较STZ组下降(t=2.48,P=0.029;t=3.89,P=0.002);SAL干预后,大鼠心肌组织中p-Mst1/2、p-Lats1/2和p-Yap表达水平均升高(t=-2.53,P=0.026;t=-2.27,P=0.042;t=-4.32,P=0.001)。见表 2。
同时,与空白对照组比较,STZ组大鼠心肌组织Yap/p-Yap比值升高(t=-11.04,P<0.01),SAL干预后Yap/p-Yap比值下降(t=7.99,P<0.01)。见表 2。
2.6 SAL对DM模型大鼠心肌组织中Yap mRNA的影响RT-PCR检测结果显示,各组大鼠心肌组织中Yap mRNA差异有统计学意义(F=13.238,P=0.001);与空白对照组(1.00±0.58)比较,STZ组大鼠心肌组织中Yap mRNA表达升高(4.07±1.60;t=-4.78,P<0.01);SAL干预后,Yap mRNA表达水平下降(1.47±0.45;t=4.04,P=0.002),但仍较空白对照组高。
3 讨论本实验参照Tang等[8]DCM造模方案用STZ诱导DM大鼠,成功复制并建立了DM大鼠模型。本课题组前期研究表明,SAL通过抑制心肌组织中JNK/激活蛋白1(activator protein 1,AP-1)和MAPK信号通路减轻了DM模型大鼠心脏组织病变,并减少了心肌纤维化[9-10]。本实验旨在探讨SAL是否对DM模型大鼠心肌炎症因子和Hippo信号通路相关蛋白产生影响。
目前DM导致DCM的确切发病机制尚不明确,但有多项研究指出炎症和氧化应激是主要发病机制。在高糖环境下,炎症因子和氧化应激可导致心肌肥厚[11]。在DCM疾病进程中慢性炎症起着重要的促进作用,Al-Rasheed等[12]报道,TNF-α可促进心肌肥厚和心功能紊乱,其机制主要与炎症因子减少细胞外基质降解和增加基质合成有关。这也是辛伐他汀治疗DCM的药物靶点之一。Li等[13]报道,使用内皮素诱导的心肌肥厚体外实验中TNF-α、IL-1β和IL-6表达水平上调,依那西普可降低炎症因子水平,减轻心肌肥厚。
本实验中,DM模型大鼠心重指数增加,考虑DM模型大鼠存在DCM倾向。给予SAL干预后心重指数下降,较STZ组差异有统计学意义(P<0.05)。实验结果提示,SAL能够抑制DM模型大鼠的心脏增大和质量增加,可能具有改善心肌肥厚的作用。实验中DM模型大鼠外周血和心肌组织中TNF-α、IL-1β和IL-6表达水平均升高,差异均有统计学意义(P<0.05,P<0.01);给予SAL干预后TNF-α和IL-6表达水平下降,与STZ组比较差异有统计学意义(P<0.05,P<0.01),但对于IL-1β没有明显抑制作用。本实验结果与文献结果[11-13]类似,也与辛伐他汀和依那西普作用相似,但SAL对STZ诱导的DM模型大鼠IL-1β的抑制作用较弱,可能SAL的作用靶点与辛伐他汀和依那西普不同,有待进一步深入研究。
Hippo信号通路是一种新发现的信号级联反应,目前对DM影响的研究较少,在心肌细胞中的相关研究更少。本实验发现,与空白对照组比较,STZ组大鼠心肌组织中Hippo上游激酶Mst1/2和Lats1/2表达升高,效应分子Yap表达上调,并以Mst1/2和Yap表达升高最为显著(P均<0.01);而p-Mst1/2、p-Lats1/2和p-Yap的表达水平均降低(P均<0.01)。实验结果表明Hippo信号通路全面参与了STZ诱导的DM模型大鼠心脏组织病理过程,其中以Hippo通路中磷酸化的激酶降低最为显著,非磷酸化的激酶以Mst1/2和Yap表达升高为显著,STZ诱导的DM模型大鼠心肌组织中Hippo信号通路呈过度抑制状态,可能与DCM病变有关,与文献[14-16]报道结果一致。SAL可活化上下游激酶从而激活Hippo信号通路,通过增加细胞凋亡及减少细胞增殖改善心肌肥厚,对DM模型大鼠心脏起保护作用。SAL对Yap/p-Yap比值的调节可能是保护DM模型大鼠心脏功能的关键。
与既往文献研究不同,本次对Hippo信号通路上下游各个主要激酶及磷酸化激酶均进行了检测,以全面反映STZ诱导的DM模型大鼠心脏Hippo信号通路的变化。Liu等[14]研究提示,STZ诱导的大鼠DM模型Hippo通路相关蛋白Mst1和Mst2表达上调。DCM以心肌微血管内皮细胞(cardiac microvascular endothelial cell,CMEC)损伤和心肌细胞功能障碍为特征。有研究采用内皮细胞特异性Mst1转基因小鼠(endothelial-specific Mst1 transgenic mice,Tg-Mst1EC)制作DM模型,与非转基因小鼠相比,转基因小鼠心功能和DM病情恶化更严重,心肌细胞中Mst1蛋白含量升高[15]。CMEC可释放高浓度的Mst1外泌体,抑制心肌细胞自噬、促进细胞凋亡和抑制心肌细胞中的葡萄糖代谢[15]。Yap是Hippo信号通路中的关键效应激酶,DM病变时心肌细胞中Yap持续激活,并通过活化Tead1诱导心肌细胞逆分化,加剧DM模型小鼠心力衰竭。因此,有研究认为Yap和Tead1是DM心力衰竭潜在的治疗靶点[16]。本实验发现,SAL抑制了DM模型大鼠心肌组织Yap表达,同时提高了p-Yap表达,从而降低Yap/p-Yap比值,有效抑制了Yap激活,可能具有保护DM模型大鼠心脏功能的作用。
本实验结果表明,STZ诱导的DM模型大鼠存在炎症因子表达上调、心重指数升高、心肌细胞过度凋亡和心脏间质纤维化等现象,表明STZ诱导的DM有DCM的发病趋势和倾向。并且实验表明Hippo信号通路参与了DM导致的心肌细胞损害,SAL对这些损害有一定的治疗作用,但目前仍不能明确SAL的直接药理作用靶点。目前认为,肥胖、2型糖尿病和代谢综合征与较低程度慢性炎症或称之为代谢性炎症密切相关[17]。SAL是中药红景天中的一个重要化学单体成分,而中草药很大一部分功能是免疫调节,本实验未能明确SAL对炎症因子的抑制或直接对心脏的保护作用,仍需在代谢组学或蛋白质组学方面深入研究。
心肌组织炎症和应激可导致心肌细胞数量减少,并最终导致心力衰竭,这是临床心血管疾病主要的致死原因。改善心肌细胞存活和促进心肌细胞再生是心力衰竭治疗的主要目标,但出生后心脏很少存在心肌多能干细胞,心肌再生可能性很小。Hippo通路是一种进化保守的信号机制,通过控制细胞凋亡和增殖来调节器官大小。SAL对Yap/p-Yap比值的调节可能是保护DM模型大鼠心脏功能的关键,但SAL抑制Yap和上调p-Yap的具体途径和机制尚不明确。维护正常心脏组织中Yap/p-Yap比值最优是今后的研究重点,这涉及如何确定SAL的用药时间、剂量和适应证。
| [1] |
OBAID N, HADIDY S E, BADRY M E, KHALED H. The outcome of diabetic patients with cardiomyopathy in critical care unit: hospital and short-term outcome in a period of six months to one year[J]. Open Access Maced J Med Sci, 2019, 7: 2796-2801. DOI:10.3889/oamjms.2019.655 |
| [2] |
KANNEL W B, HJORTLAND M, CASTELLI W P. Role of diabetes in congestive heart failure: the Framingham study[J]. Am J Cardiol, 1974, 34: 29-34. DOI:10.1016/0002-9149(74)90089-7 |
| [3] |
LORENZO-ALMORÓS A, TUÑÓN J, OREJAS M, CORTÉS M, EGIDO J, LORENZO Ó. Diagnostic approaches for diabetic cardiomyopathy[J/OL]. Cardiovasc Diabetol, 2017, 16: 28. DOI: 10.1186/s12933-017-0506-x.
|
| [4] |
叶加虎, 孙虹, 朱平. 糖尿病心肌病的药物治疗进展[J]. 中华老年心脑血管病杂志, 2020, 22: 551-552. DOI:10.3969/j.issn.1009-0126.2020.05.027 |
| [5] |
ZHOU Q, LI L, ZHAO B, GUAN K L. The Hippo pathway in heart development, regeneration, and diseases[J]. Circ Res, 2015, 116: 1431-1447. |
| [6] |
MENG Z P, MOROISHI T, GUAN K L. Mechanisms of Hippo pathway regulation[J]. Genes Dev, 2016, 30: 1-17. DOI:10.1101/gad.274027.115 |
| [7] |
ARDESTANI A, LUPSE B, MAEDLER K. Hippo signaling: key emerging pathway in cellular and whole-body metabolism[J]. Trends Endocrinol Metab, 2018, 29: 492-509. DOI:10.1016/j.tem.2018.04.006 |
| [8] |
TANG S G, LIU X Y, WANG S P, WANG H H, JOVANOVIĆ A, TAN W. Trimetazidine prevents diabetic cardiomyopathy by inhibiting Nox2/TRPC3-induced oxidative stress[J]. J Pharmacol Sci, 2019, 139: 311-318. DOI:10.1016/j.jphs.2019.01.016 |
| [9] |
岳星星, 谢春毅. 红景天苷对糖尿病大鼠心肌组织中JNK/AP-1信号通路和TGF-β1 mRNA表达的影响[J]. 中华中医药杂志, 2018, 33: 4722-4726. |
| [10] |
王文聪, 谢春毅. SAL对DM心肌病MAPK信号通路作用机制[J]. 世界中西医结合杂志, 2016, 11: 1365-1368. |
| [11] |
FRATI G, SCHIRONE L, CHIMENTI I, YEE D, BIONDI-ZOCCAI G, VOLPE M, et al. An overview of the inflammatory signalling mechanisms in the myocardium underlying the development of diabetic cardiomyopathy[J]. Cardiovasc Res, 2017, 113: 378-388. DOI:10.1093/cvr/cvx011 |
| [12] |
AL-RASHEED N M, AL-RASHEED N M, HASAN I H, AL-AMIN M A, AL-AJMI H N, MOHAMAD R A, et al. Simvastatin ameliorates diabetic cardiomyopathy by attenuating oxidative stress and inflammation in rats[J/OL]. Oxid Med Cell Longev, 2017, 2017: 1092015. DOI: 10.1155/2017/1092015.
|
| [13] |
LI Q, YU Q, NA R, LIU B. Etanercept protects rat cardiomyocytes against hypertrophy by regulating inflammatory cytokines secretion and cell apoptosis[J/OL]. Braz J Med Biol Res, 2017, 50: e5868. DOI: 10.1590/1414-431X20175868.
|
| [14] |
LIU M J, LIU S Q, TAN W T, TANG F, LONG J R, LI Z N, et al. Gaseous signalling molecule SO2 via Hippo-MST pathway to improve myocardial fibrosis of diabetic rats[J]. Mol Med Rep, 2017, 16: 8953-8963. DOI:10.3892/mmr.2017.7714 |
| [15] |
HU J Q, WANG S J, XIONG Z Y, CHENG Z, YANG Z, LIN J, et al. Exosomal Mst1 transfer from cardiac microvascular endothelial cells to cardiomyocytes deteriorates diabetic cardiomyopathy[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864: 3639-3649. DOI:10.1016/j.bbadis.2018.08.026 |
| [16] |
IKEDA S, MUKAI R S, MIZUSHIMA W, ZHAI P Y, OKA S I, NAKAMURA M, et al. Yes-associated protein (YAP) facilitates pressure overload-induced dysfunction in the diabetic heart[J]. JACC Basic Transl Sci, 2019, 4: 611-622. DOI:10.1016/j.jacbts.2019.05.006 |
| [17] |
ARNORIAGA-RODRÍGUEZ M, FERNÁNDEZ-REAL J M. Microbiota impacts on chronic inflammation and metabolic syndrome-related cognitive dysfunction[J]. Rev Endocr Metab Disord, 2019, 20: 473-480. DOI:10.1007/s11154-019-09537-5 |
 2022, Vol. 43
2022, Vol. 43


