2. 海军军医大学(第二军医大学)第二附属医院血液科,上海 200003;
3. 海军军医大学(第二军医大学)卫生勤务学系卫生统计学教研室,上海 200433
2. Department of Hematology, The Second Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200003, China;
3. Department of Health Statistics, Faculty of Health Services, Naval Medical University (Second Military Medical University), Shanghai 200433, China
淀粉样变性是不可溶淀粉样蛋白在细胞外基质异常沉积的一组疾病[1],其中以系统性轻链型淀粉样变性(systemic immunoglobulin light-chain amyloidosis,AL)最常见。AL是由于单克隆Ig轻链(κ、λ)错误折叠形成淀粉样蛋白而广泛沉积于组织器官,造成肾脏、心脏、肝脏等多器官组织结构破坏及功能障碍[2]。心功能是AL患者重要的预后影响因素,心功能减低提示AL患者预后不良[3]。超声心动图是评估AL患者心脏功能最重要的成像方法之一,在部分心功能正常的AL患者中超声心动图测量发现肺动脉压力升高,然而,肺动脉压力升高对预后的影响目前仅见于极少数小样本报道[4-5]。本研究通过分析93例心功能正常的初诊AL患者的临床资料,探讨肺动脉高压(pulmonary hypertension,PH)在心功能正常AL患者预后中的作用。
1 资料和方法 1.1 研究对象选择2014年6月至2021年12月在海军军医大学(第二军医大学)第二附属医院诊治的AL患者93例。纳入标准:(1)符合2021年中华医学会提出的AL诊断标准[6],并有至少1处病理活检证据:肾脏、皮下脂肪、舌腺或心内膜等活检标本刚果红染色阳性且偏振光下呈苹果绿色双折光;(2)初发AL患者;(3)在初次化疗前接受经胸超声心动图检查,且左心室射血分数正常(>50%)。排除标准:(1)有其他可明确导致PH的病因,如先天性心脏病、中重度慢性阻塞性肺疾病、中重度限制型肺疾病、先天性肺组织病变、胸壁畸形、类癌综合征、慢性肝病、睡眠呼吸暂停综合征、艾滋病或使用厌食药物等[7];(2)无意愿参加本研究的患者。PH的诊断参照2009年美国心脏病学会推荐的超声心动图评估PH定义[8]。本研究通过海军军医大学(第二军医大学)第二附属医院伦理委员会审批,所有入组患者均签署知情同意书。
1.2 临床及实验室检查资料收集入组患者的性别、年龄等一般临床资料,以及血常规、血肌酐、N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)、心肌肌钙蛋白T、血清游离轻链等生物化学指标。根据《系统性轻链型淀粉样变性诊断和治疗指南(2021年修订)》[6],AL患者发生心脏浸润的诊断标准为超声心动图提示平均心室壁厚度>12 mm且排除其他心脏疾病,或在没有肾功能不全及心房颤动时NT-proBNP>332 ng/L。
1.3 超声心动图检查所有入组患者均采用美国GE Healthcare公司Vivid 7型超声诊断仪(探头频率为2.5~4.0 MHz)进行系统的经胸超声心动图检查。按照美国超声心动图学会指南标准[9]测量左心室壁厚度、左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)和左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左心室射血分数、三尖瓣环收缩期位移、右心室面积变化分数。通过脉冲多普勒法测量二尖瓣口舒张早期血流速度峰值(E)、二尖瓣口舒张晚期血流速度峰值(A),并计算E/A。左心室心肌质量指数(left ventricular mass index,LVMI)根据美国超声心动图学会的公式,由软件自动计算。LVMI(g/m2)={0.8×1.04×[(舒张末期室间隔厚度+LVEDD+舒张末期左室后壁厚度)3-LVEDD3]+0.6}/(1 000×体表面积)[10]。三尖瓣环收缩期位移>16 mm且右心室面积变化分数>35%认为右心室收缩功能正常。采用连续多普勒法记录三尖瓣最大反流速度(V),通过公式估测右心室收缩压:右心室收缩压=4V2+右心房压力。除外右心室流出道梗阻、肺动脉瓣狭窄等情况,认为肺动脉压力等于右心室收缩压。通常受检者的V>2.8 m/s和/或三尖瓣峰值跨瓣压差>31 mmHg(1 mmHg=0.133 kPa)则认为存在PH[8]。
1.4 随访采用住院病历查询及电话联系的方式进行随访,随访截止日期为2021年12月31日。总生存期定义为从初诊至死亡或随访截止日期的时间;无进展生存期定义为从诊断至疾病进展、复发或死亡的时间。
1.5 统计学处理应用SPSS 25.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验。非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Wilcoxon秩和检验。计数资料以例数和百分数表示,两组间比较采用χ2检验或Fisher确切概率法。两组患者使用Kaplan-Meier法计算总生存率和无进展生存率,并绘制生存曲线。采用Cox比例风险回归模型,在校正性别、年龄、心脏是否浸润、血肌酐、NT-proBNP、心肌肌钙蛋白T、LVESD、LVEDD、左心室壁厚度、左心室射血分数、E/A比值、心包积液、每搏输出量、每搏指数、心肌质量、LVMI、心脏指数、心肌收缩指数等因素后,分析PH对AL患者生存预后的影响。检验水准(α)为0.05。
2 结果 2.1 一般资料共纳入93例AL患者,年龄为41~80岁,平均年龄为(61.13±9.40)岁,其中男64例(68.82%);17例(18.28%)伴有PH、76例(81.72%)无PH,两组患者左心室收缩功能及右心室收缩功能均正常。17例PH患者中轻度PH 13例(经三尖瓣反流估测肺动脉压力为38~49 mmHg),轻中度PH 4例(经三尖瓣反流估测肺动脉压力为50~55 mmHg)。PH组发生心脏浸润的患者比例、NT-proBNP水平、左心室壁厚度、发生心包积液比例均高于无PH组(P均<0.05);两组的性别、年龄、血肌酐、心肌肌钙蛋白T、LVESD、LVEDD、左心室射血分数、E/A比值、每搏输出量、每搏指数、心肌质量、LVMI、心脏指数、心肌收缩指数等差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 伴或不伴PH的AL患者的基线资料 Tab 1 Baseline data of AL patients with or without PH |
2.2 两组患者生存状况比较
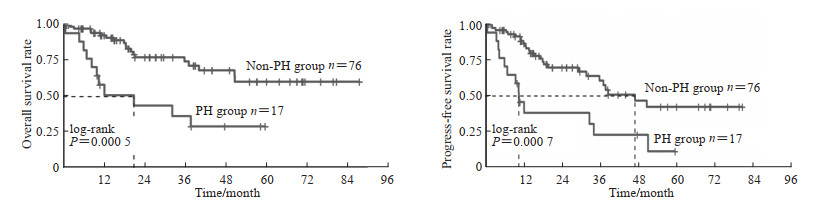
中位随访时间为19.4(1.0~87.0)个月,随访期间33例(35.48%)患者死亡。Kaplan-Meier生存分析结果(图 1)显示,PH组的总生存期和无进展生存期均短于无PH组(P=0.000 5、0.000 7)。无PH组中位总生存期未达到,1、2和4年总生存率分别为93%、77%和68%;PH组中位总生存期为20.9(9.93,NA)个月(NA表示上四分位数无法算出),1、2和4年的总生存率分别为58%、44%和36%。无PH组中位无进展生存期为47.0(35.87,NA)个月,1、2和4年无进展生存率分别为87%、70%和47%;PH组中位无进展生存期为10.5(6.93,NA)个月,1、2和4年无进展生存率分别为46%、38%和23%。
|
图 1 伴或不伴PH的AL患者的Kaplan-Meier生存曲线 Fig 1 Kaplan-Meier survival curves of AL patients with or without PH PH: Pulmonary hypertension; AL: Systemic immunoglobulin light-chain amyloidosis. |
2.3 PH对生存预后的影响
单因素Cox比例风险回归模型分析结果显示,PH组AL患者死亡的风险是无PH组患者的3.49倍(HR=3.49,95% CI 1.64~7.41,P=0.001 2),PH组患者疾病进展的风险是无PH组患者的3.04倍(HR=3.04,95% CI 1.55~5.94,P=0.001 2)。校正其他基线资料后,多因素Cox比例风险回归模型分析结果显示,PH组AL患者死亡的风险是无PH组患者的4.93倍(HR=4.93,95% CI 1.41~17.23,P=0.012 4),PH组患者疾病进展的风险是无PH组患者的3.53倍(HR=3.53,95% CI 1.22~10.20,P=0.019 6)。根据患者超声心动图是否提示伴有心脏浸润(心脏淀粉样变性)进行亚组多因素Cox比例风险回归模型分析,校正因素和主分析一致,在无心脏浸润的亚组中,伴PH的患者仅2例,故未进行比较;在存在心脏浸润的亚组中,伴PH的AL患者死亡风险是无PH患者的13.23倍(HR=13.23,95% CI 2.35~74.93,P=0.003 4),伴PH患者疾病进展的风险是无PH患者的3.58倍(HR=3.58,95% CI 1.09~11.71,P=0.035 3)。
3 讨论AL是一种系统性疾病,可累及心脏、肾脏、软组织、胃肠道及自主神经系统等多个组织器官,引起肾病综合征、限制型心肌病、肝脏肿大、周围神经病变等,患者临床表现多隐匿,极易被漏诊和误诊[11]。AL的发病率较低,年发病率约为12/1 000 000[2],高发年龄为50~70岁。AL存在较大异质性,患者生存期差异大,中位生存时间为30 d~5年[12],AL患者预后的影响因素一直是研究的热点问题。
心脏功能是影响淀粉样变性预后极为重要的因素。2004年,Dispenzieri等[13]提出基于心脏特异性血清标志物NT-proBNP和心肌肌钙蛋白T/I的淀粉样变性患者预后分期系统,即梅奥2004分期系统。2012年,Kumar等[14]研究发现血清游离轻链差值也是预后的影响因素,将血清游离轻链差值纳入梅奥2004分期系统,形成梅奥2012分期系统。梅奥分期系统对于指导原发性淀粉样变性患者的治疗和预后评估有重要意义。然而,对于存在肾功能不全、体液过负荷的患者,上述血清学指标的检测会受到干扰,无法准确评估,影响临床预后分期。因此,一些学者逐步聚焦于检查结果相对稳定的超声心动图。
超声心动图操作便捷、无创、无辐射,且可动态、重复检查,是临床评估淀粉样变性患者心脏结构、功能最常用且能常规开展的检查方法。文献报道,部分超声心动图参数如每搏指数[15]、左心室与右心室面积比值[16]、心肌功能指数[17]等是淀粉样变性患者的独立预后因素。当患者左心室射血分数减低时,通常提示患者病情严重,已进入终末期阶段。2017年,Barros-Gomes等[18]对150例左心室射血分数正常的AL患者进行研究,发现超声心动图测得的心肌二维整体纵向应变是影响患者预后的独立危险因素。在左心室射血分数正常的AL患者中,心肌整体纵向应变减低与预后不良相关。以-14.81为最佳临界值,整体纵向应变减低的患者死亡风险增加2.68倍。该研究也是迄今纳入AL患者例数最多的研究。本研究纳入93例左心室射血分数正常的AL患者,研究结果显示,经胸超声心动图测得伴PH的AL患者死亡风险是无PH患者的4.93倍,伴PH患者疾病进展的风险是无PH患者的3.53倍。较之心肌应变的测定,PH的检测是经胸超声心动图检查的常规项目,操作更为简易,结果更为稳定,临床应用更广,实施性更强。
PH是AL一种较为少见的并发症。对于AL患者,尽管淀粉样物质可在肺间质沉积,然而在临床上典型的肺淀粉样变性罕见[19]。通常情况下,血管平滑肌受血管舒张物质(如一氧化氮)和血管收缩物质(如内皮素)调控。当发生血管内皮功能不全时,异常的内皮细胞会表达低水平一氧化氮合酶及高水平的内皮素,从而促进血管收缩和平滑肌增生,引起PH[20]。因此,尽管AL患者发生PH的具体机制尚不清楚,多数研究者仍认为淀粉样物质沉积在血管壁可导致血管内皮功能障碍,特别是在没有严重淀粉样物质在肺间质沉积的情况下,淀粉样物质在血管壁沉积会影响肺循环中血管内皮功能,从而导致血管收缩,引起PH[4]。伴发PH的AL患者通常预后不良,但相关参考信息较少,多为个案报告或病例系列研究,缺少系统性临床研究,因此PH对AL患者的预后作用尚不明确。
Dingli等[4]回顾梅奥医学中心伴有PH且左心室射血分数正常的5例系统性淀粉样变性患者,其中4例为AL患者,1例为继发于家族性地中海热的淀粉样蛋白A沉积病。在该研究中5例患者的总体中位生存时间为2.8年,与该中心淀粉样变性患者的总体中位生存时间(2.0年)差异无统计学意义(P=0.11)。但该5例患者在出现PH后中位生存时间约为73 d,认为在系统性淀粉样变性病程中出现PH提示患者病情进入终末期。本研究纳入93例初发且心功能正常的AL患者,在初发阶段伴有PH的患者有17例,是现有纳入初发AL伴PH患者最多的研究。这17例患者的左心室及右心室收缩功能均正常,且PH仅为轻度或轻中度,一般状况较好。然而,本研究结果显示伴PH患者的死亡风险和疾病进展风险均较无PH患者增高,特别是在伴有心肌淀粉样变性的患者中,伴PH的患者预后显著劣于无PH的患者。
本研究为回顾性研究,最终纳入AL患者93例,今后仍需开展大样本量、前瞻性临床研究进一步明确PH对AL的预后意义。
综上所述,在左心室收缩功能正常的初诊AL患者中,伴PH的患者中位无进展生存期和中位总生存期更短,PH是AL患者生存预后的独立危险因素,特别是在累及心肌的AL患者中伴PH的患者预后更差。在临床工作中应重视超声心动图测得的肺动脉压力值提供的预后参考信息,以指导临床实践。
| [1] |
FALK R H, COMENZO R L, SKINNER M. The systemic amyloidoses[J]. N Engl J Med, 1997, 337: 898-909. DOI:10.1056/NEJM199709253371306 |
| [2] |
GERTZ M A, DISPENZIERI A. Systemic amyloidosis recognition, prognosis, and therapy: a systematic review[J]. JAMA, 2020, 324: 79-89. DOI:10.1001/jama.2020.5493 |
| [3] |
FALK R H. Diagnosis and management of the cardiac amyloidoses[J]. Circulation, 2005, 112: 2047-2060. DOI:10.1161/CIRCULATIONAHA.104.489187 |
| [4] |
DINGLI D, UTZ J P, GERTZ M A. Pulmonary hypertension in patients with amyloidosis[J]. Chest, 2001, 120: 1735-1738. DOI:10.1378/chest.120.5.1735 |
| [5] |
EDER L, ZISMAN D, WOLF R, BITTERMAN H. Pulmonary hypertension and amyloidosis-an uncommon association: a case report and review of the literature[J]. J Gen Intern Med, 2007, 22: 416-419. DOI:10.1007/s11606-006-0052-9 |
| [6] |
中国系统性轻链型淀粉样变性协作组, 国家肾脏疾病临床医学研究中心, 国家血液系统疾病临床医学研究中心. 系统性轻链型淀粉样变性诊断和治疗指南(2021年修订)[J]. 中华医学杂志, 2021, 101: 1646-1656. DOI:10.3760/cma.j.cn112137-20210302-00534 |
| [7] |
KROWKA M J. Pulmonary hypertension: diagnostics and therapeutics[J]. Mayo Clin Proc, 2000, 75: 625-630. |
| [8] |
BADESCH D B, CHAMPION H C, GOMEZ SANCHEZ M A, HOEPER M M, LOYD J E, MANES A, et al. Diagnosis and assessment of pulmonary arterial hypertension[J]. J Am Coll Cardiol, 2009, 54(1 Suppl): S56-S66. |
| [9] |
LANG R M, BADANO L P, MOR-AVI V, AFILALO J, ARMSTRONG A, ERNANDE L, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J/OL]. J Am Soc Echocardiogr, 2015, 28: 1-39. e14. DOI: 10.1016/j.echo.2014.10.003.
|
| [10] |
QUIÑONES M A, OTTO C M, STODDARD M, WAGGONER A, ZOGHBI W A, Doppler Quantification Task Force of the Nomenclature and Standards Committee of the American Society of Echocardiography . Recommendations for quantification of Doppler echocardiography: a report from the Doppler Quantification Task Force of the Nomenclature and Standards Committee of the American Society of Echocardiography[J]. J Am Soc Echocardiogr, 2002, 15: 167-184. |
| [11] |
MCCAUSLAND K L, WHITE M K, GUTHRIE S D, QUOCK T, FINKEL M, LOUSADA I, et al. Light chain (AL) amyloidosis: the journey to diagnosis[J]. Patient, 2018, 11: 207-216. |
| [12] |
GERTZ M A. Immunoglobulin light chain amyloidosis: 2018 update on diagnosis, prognosis, and treatment[J]. Am J Hematol, 2018, 93: 1169-1180. |
| [13] |
DISPENZIERI A, GERTZ M A, KYLE R A, LACY M Q, BURRITT M F, THERNEAU T M, et al. Serum cardiac troponins and N-terminal pro-brain natriuretic peptide: a staging system for primary systemic amyloidosis[J]. J Clin Oncol, 2004, 22: 3751-3357. |
| [14] |
KUMAR S, DISPENZIERI A, LACY M Q, HAYMAN S R, BUADI F K, COLBY C, et al. Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements[J]. J Clin Oncol, 2012, 30: 989-995. |
| [15] |
MILANI P, DISPENZIERI A, SCOTT C G, GERTZ M A, PERLINI S, MUSSINELLI R, et al. Independent prognostic value of stroke volume index in patients with immunoglobulin light chain amyloidosis[J/OL]. Circ Cardiovasc Imaging, 2018, 11: e006588. DOI: 10.1161/CIRCIMAGING.117.006588.
|
| [16] |
PATEL A R, DUBREY S W, MENDES L A, SKINNER M, CUPPLES A, FALK R H, et al. Right ventricular dilation in primary amyloidosis: an independent predictor of survival[J]. Am J Cardiol, 1997, 80: 486-492. |
| [17] |
TEI C, DUJARDIN K S, HODGE D O, KYLE R A, TAJIK A J, SEWARD J B. Doppler index combining systolic and diastolic myocardial performance: clinical value in cardiac amyloidosis[J]. J Am Coll Cardiol, 1996, 28: 658-664. |
| [18] |
BARROS-GOMES S, WILLIAMS B, NHOLA L F, GROGAN M, MAALOUF J F, DISPENZIERI A, et al. Prognosis of light chain amyloidosis with preserved LVEF: added value of 2D speckle-tracking echocardiography to the current prognostic staging system[J]. JACC Cardiovasc Imaging, 2017, 10: 398-407. |
| [19] |
UTZ J P, SWENSEN S J, GERTZ M A. Pulmonary amyloidosis. The Mayo Clinic experience from 1980 to 1993[J]. Ann Intern Med, 1996, 124: 407-413. |
| [20] |
FISHMAN A P. Etiology and pathogenesis of primary pulmonary hypertension: a perspective[J]. Chest, 1998, 114(3 Suppl): 242S-247S. |
 2022, Vol. 43
2022, Vol. 43


