肺气肿病理特征为终末细支气管及肺泡的永久性异常扩大,扩大的肺泡腔破裂相互融合形成肺大疱。慢性小气道炎症是小气道黏膜及周围组织的慢性非特异型炎症。目前国内外研究结果均显示在肺气肿发生之前已存在慢性小气道炎症表现,并且气流受限越严重小气道数量越少,慢性小气道炎症还与吸烟显著相关[1-2]。这2种病理变化广泛存在于慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者中,因此COPD的影像学表型分为肺气肿型和慢性支气管型[3-4]。影像学对于肺气肿及气道的评估从视觉评估逐渐发展到定量评估,大大提高了疾病诊断的准确性,但是目前CT仍无法做到直观观察小气道病变,肺功能检查(pulmonary function test,PFT)也无法在早期检测到肺周围潜在病理改变。通过呼吸双相配准方法得到的参数响应图(parameter response mapping,PRM)定量参数既弥补了传统CT依赖视觉评估的不足,也能同时评价肺气肿及小气道病变[5],并且与肺功能相关[6-8],已成为目前的研究热点。然而关于PRM的研究主要集中在随访期间功能性小气道的定量评估、PRM与肺功能的相关性、PRM与功能性MRI的匹配及疾病进展评估等方面[9-12]。参加胸部三大疾病(肺癌、慢性阻塞性肺疾病及冠心病)筛查的人群中存在一定比例的肺气肿及小气道炎症患者,其CT定量研究报道也较少。本研究利用PRM定量分析胸部三大疾病筛查人群的肺部信息,并根据有无肺气肿或吸烟史进行分组、分层分析,探究PRM参数、肺气肿与气流受限的关系。
1 资料和方法 1.1 病例资料本研究在中国临床试验注册中心注册(ChiCTR2000035283)。回顾性纳入2018年8月至2021年7月在我院进行低剂量CT胸部三大疾病(肺癌、慢性阻塞性肺疾病及冠心病)筛查的受试者。纳入标准:具有双呼吸相胸部CT检查结果。排除标准:(1)胸部CT图像上有明显的呼吸运动或金属伪影;(2)无薄层(1 mm)医学数字成像和通信标准(digital imaging and communications in medicine,DICOM)格式图像;(3)有基础肺部疾病,如肺癌、严重肺间质纤维化、严重肺结核、哮喘、大面积肺部感染、急性肺栓塞或肺梗死;(4)胸廓畸形;(5)胸腔积液;(6)胸部手术史。本研究通过我院伦理委员会审批(2018SL028)。所有受试者均使用肺功能检测仪(Multi-Function all Spirometer HI-801,日本CHEST株式会社)进行PFT,操作符合质控要求。肺功能参数包括第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、FEV1占用力肺活量(forced vital capacity,FVC)的百分比(FEV1/FVC)和FEV1占预计值的百分比等,本研究纳入肺功能通气指标FEV1。收集患者PFT和问卷调查信息。问卷调查由社区人群在进行PFT之前填写,调查内容包括性别、年龄、身高、体重、吸烟史、病史及临床症状等。
1.2 呼吸双相胸部CT检查方法检查前对受试者进行吸气、呼气及屏气训练。受检者取仰卧位,双臂高举过头顶,采用荷兰Philips公司Brilliance 256层iCT仪分别进行最大吸气末、最大呼气末胸部CT检查。扫描区域为胸廓入口至双侧肾上腺水平。扫描参数:准直为128×0.625 mm,管电压为120 kV,Z轴和3D自动管电流调制,DoseRight级别3,螺距为0.70,层厚为1 mm,层间隔为1 mm,视野为350 mm×350 mm,矩阵为512×512,高分辨率和标准分辨率算法。
1.3 PRM数据分析将所有薄层CTDICOM原始图像传输到图像后处理工作站[A-VIEW软件,粟海信息科技(苏州)有限公司]进行分析,获得PRM参数,包括全肺总体积、肺气肿体积、功能小气道病变体积、正常肺组织体积及后3个指标分别占全肺总体积的百分比;右肺总体积、肺气肿体积、功能小气道病变体积、正常肺组织体积及后3个指标分别占右肺总体积的百分比;左肺总体积、肺气肿体积、功能小气道病变体积、正常肺组织体积及后3个指标分别占左肺总体积的百分比。阈值设定:肺气肿区域为吸气末CT值<-950 HU、呼气末CT值<-856 HU的区域;功能小气道病变区域为吸气末CT值>-950 HU、呼气末CT值<-856 HU的区域,代表无肺气肿的气体潴留区域;正常肺组织区域为吸气末CT值≥-950 HU、呼气末CT值≥-856 HU的区域。肺气肿指数(emphysema index,EI)定义为吸气相CT值<-950 HU的体素占全肺的百分比,EI≥6%即判定为肺气肿[13]。根据有无肺气肿,将受试者分为肺气肿组和无肺气肿组;再依据受试者有无吸烟史(吸烟者定义为有吸烟史的社区居民,包括曾经吸烟者;无吸烟者定义为从未吸烟的社区居民),进一步将受试者分为4组:无肺气肿不吸烟组、无肺气肿吸烟组、肺气肿不吸烟组、肺气肿吸烟组。
1.4 统计学处理应用SPSS 25.0软件进行统计学分析。对所有计量资料进行Shapiro-Wilk正态性检验,均不符合正态分布,以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验。计数资料以例数和百分数表示,两组间比较采用χ2检验。PRM参数与FEV1的相关性分析采用Spearman相关分析,其中|rs|为>0.6~1.0表示强相关,>0.3~0.6表示中度相关,0.0~0.3表示弱相关或无相关。检验水准(α)为0.05。
2 结果 2.1 基本临床资料和肺功能参数的比较共纳入有呼吸双相CT检查结果的受试者2 428例,男1 074例(44.2%)、女1 354例(55.8%),肺气肿组1 992例、无肺气肿组436例。1 992例受试者有PFT结果,其中94.5%(1 882/1 992)肺功能正常(FEV1/FVC≥70%)。1 994例受试者同时具有CT和BMI检查结果;2 083例同时具有CT检查和问卷调查结果,其中吸烟者578例(27.7%)、不吸烟者1 505例(72.3%);1 708例受试者同时具有CT检查结果、PFT结果及吸烟史信息。由表 1可见,性别、年龄、BMI、是否有吸烟史和FEV1在有肺气肿组与无肺气肿组间的差异均有统计学意义(P均<0.05),肺气肿组男性患者占比、年龄、FEV1高于无肺气肿组,BMI低于无肺气肿组。
|
|
表 1 有、无肺气肿组受试者基本资料及肺功能参数的比较 Tab 1 Comparison of basic information and pulmonary function parameters of subjects with or without emphysema |
2.2 PRM参数的比较
无肺气肿组全肺、右肺、左肺的总体积均小于肺气肿组(P均<0.001)。无肺气肿组全肺、右肺、左肺的肺气肿体积和功能小气道病变体积,以及该2项指标分别占全肺、右肺、左肺总体积的百分比均小于肺气肿组(P均<0.001);无肺气肿组全肺、右肺、左肺的正常肺组织体积小于肺气种组(P<0.001),该指标分别占全肺、右肺、左肺总体积的百分比均大于肺气肿组(P均<0.001)。见表 2。
|
|
表 2 有、无肺气肿组受试者PRM参数的比较 Tab 2 Comparison of PRM parameters of subjects with or without emphysema |
2.3 PRM参数与FEV1的相关性分析
1 708例受试者同时具有CT检查、PFT结果及吸烟史信息。受试者的典型PRM、胸部冠状面CT伪彩图见图 1。在无肺气肿不吸烟组(n=1 033)受试者中,全肺、右肺、左肺的总体积及正常肺组织体积均与FEV1呈中度正相关(rs=0.388~0.482,P均<0.001),而全肺、右肺、左肺的肺气肿体积及功能小气道病变体积均与FEV1呈弱正相关(rs=0.060~0.109,P均<0.05)。在无肺气肿吸烟组(n=307)受试者中,全肺、右肺、左肺的总体积及正常肺组织体积均与FEV1呈中度正相关(rs=0.358~0.440,P均<0.001)。在肺气肿不吸烟组(n=203)受试者中,全肺、右肺、左肺的总体积及正常肺组织体积均与FEV1呈中度正相关(rs=0.448~0.627,P均<0.001)。在肺气肿吸烟组(n=165)受试者中,全肺、右肺、左肺的正常肺组织体积及它们分别占全肺、右肺、左肺总体积的百分比与FEV1呈弱至中度正相关(rs=0.258~0.482,P均<0.001),而全肺、右肺、左肺的肺气肿体积和功能小气道病变体积及它们分别占全肺、右肺、左肺总体积的百分比与FEV1呈弱至中度负相关(rs=-0.368~-0.189,P均<0.05)。见表 3。
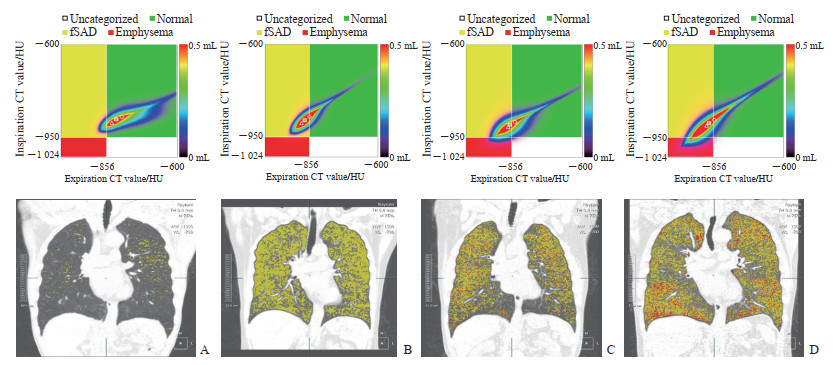
|
图 1 4组受试者的PRM、胸部冠状面CT伪彩图 Fig 1 PRM and chest coronal CT pseudo-color images of subjects in 4 groups A: Non-emphysema+non-smoking group (male, 74 years old, EI=1.9%, FEV1=2.26 L); B: Non-emphysema+smoking group (female, 72 years old, smoking for more than 40 years, EI=1.3%, FEV1=2.19 L); C: Emphysema+non-smoking group (male, 71 years old, EI=8.0%, FEV1=2.38 L); D: Emphysema+smoking group (male, 70 years old, smoking for 50 years, EI=12.7%, FEV1=1.98 L). The figures above are the PRM diagram of the subjects, and the figures below are the chest coronal CT pseudo-color images of the same subjects after respiratory biphasic registration. PRM: Parameter response mapping; CT: Computed tomography; fSAD: Functional small airway disease; HU: Hounsfield unit; EI: Emphysema index; FEV1: Forced expiratory volume in one second. |
|
|
表 3 PRM参数与FEV1的Spearman相关性分析 Tab 3 Spearman correlation analysis between PRM parameters and FEV1 |
3 讨论
本研究探讨了基于低剂量胸部CT的PRM参数在有、无肺气肿人群中的差异及其与FEV1的相关性,并进行了关于吸烟史的亚组分析,肺气肿吸烟组患者中与FEV1存在弱相关性的PRM参数有正常肺组织、肺气肿及功能小气道病变体积占总体积的百分比,提示肺气肿吸烟(曾经或现在吸烟)患者中肺气肿体积及功能小气道病变体积的百分比可能成为气流受限的预警标志物,监测这些数值将有助于社区人群肺部情况的表型分析,从而为临床进行一、二级预防或治疗提供依据。
根据影像学定量PRM参数区分不同表型(包括肺气肿和小气道疾病)时,由于肺气肿的存在,小气道病变的客观评价受到影响,因此本研究将参加胸部疾病筛查的社区人群根据有无肺气肿进行分组,以减少肺气肿对小气道病变的影响;PRM中功能小气道病变体积是基于每个体素的定量分析,有助于区分非肺气肿和肺气肿的气体潴留,并更精确地定量气体捕获[9, 14-15]。在无肺气肿、无吸烟史的正常人群中,也存在气流受限及小气道功能障碍,且以高龄、女性患者多见,本研究也得出了相似的结果,无肺气肿不吸烟组中女性为1 030例、男性为259例。中国成人肺部健康研究结果显示,40岁以上男性COPD患病率为19%,女性患病率为7.5%,并且危险因素存在性别差异,室内被动吸烟是女性COPD患者的重要危险因素[16]。
既往相关研究结果显示,基线时功能小气道疾病可预测肺气肿的发展[17-18],这与小气道疾病先于肺气肿的假设一致。本研究结果显示,肺气肿的进展只能部分用FEV1的变化来解释,在无肺气肿不吸烟组、肺气肿不吸烟组的受试者中,全肺的肺气肿体积与FEV1分别呈弱相关性(rs=0.097,P=0.002)或无相关性(rs=0.094,P>0.05),这与Pompe等[19]的研究结果相仿。Bhatt等[12]研究发现,在吸烟的人群中,通过胸部CT测量的功能小气道疾病与随后的FEV1下降相关,肺气肿也与FEV1下降有关,且肺气肿相较于功能小气道疾病对FEV1下降的影响更弱,特别是在轻至中度疾病阶段,证明了功能小气道疾病与FEV1下降的关联较强。而本研究发现在大部分肺功能正常的筛查人群中(1 882/1 992,94.5%),功能小气道病变与FEV1在肺气肿吸烟组受试者中表现出弱至中度负相关(rs=-0.314~-0.189,P均<0.05),因此本研究中根据有无肺气肿进行分组更合理,更有助于人群的表型分析。肺气肿、吸烟的人群中功能小气道疾病越严重,气流受限可能越明显,有可能发展成COPD。王雯婷等[20]也利用PRM参数对COPD患者进行表型分析,提出了最新的COPD影像学表型:未见显著异常型、小气道型、支气管壁增厚型、肺气肿型和混合型,更加细化了COPD表型。李艳等[21]研究发现不同表型对肺功能的影响有所不同,支气管炎型患者肺功能受到的影响较明显,肺气肿型患者主要是双肺血管和肺密度受到影响。吸烟与FEV1的加速下降有关,相当比例的吸烟者存在气流阻塞[22-23],而当存在吸烟导致的显著气道炎症时FEV1的下降可能更为明显。本研究在肺气肿分组的基础上进行吸烟亚组分析发现,在肺气肿吸烟组患者中,功能小气道病变体积及其百分比与FEV1呈弱至中度负相关(rs=-0.314~-0.189,P均<0.05),而在肺气肿不吸烟组中功能小气道病变体积及其百分比与FEV1无关;通过分析无肺气肿不吸烟组、无肺气肿吸烟组PRM参数与FEV1的相关性,还发现吸烟导致的功能小气道病变与气流受限无关,这可能意味着气道疾病的发生先于肺功能的下降。因此,没有气流阻塞的吸烟者存在的小气道病变可能是可逆的,并可能是支气管痉挛或炎症,而不是纤维化或小气道减少。组织学和显微CT数据也显示,末端细支气管的狭窄和消失先于肺气肿的发生[24],而一旦发展到肺气肿阶段,病情将无法逆转,甚至会进展为COPD[12]。
本研究存在一定局限性:(1)研究设计为单中心研究,结果还需多中心研究验证。(2)利用EI≥6%对社区人群进行有无肺气肿分组,而PRM参数中也有肺气肿体积百分比,由2个分析软件获得的参数可能导致分组与研究结果存在偏差,今后需要进一步验证。(3)仅针对社区低剂量CT筛查人群中PRM参数与肺功能定量对照的初步研究,仍需在更大规模的筛查工作中深入分析。
综上所述,利用低剂量CT定量参数EI区分有无肺气肿对人群进行分组,再加入危险因素吸烟进行亚组分析,能够识别筛查人群中的高风险气流受限患者。无肺气肿不吸烟组人群中如果存在功能小气道病变,应进行随访观察;而对于有肺气肿且有吸烟史的患者,除提醒患者戒烟外,应识别有进展风险的个体,以早期干预和预防病情恶化。
| [1] |
DING M, CHEN Y, GUAN W J, ZHONG C H, JIANG M, LUO W Z, et al. Measuring airway remodeling in patients with different COPD staging using endobronchial optical coherence tomography[J]. Chest, 2016, 150: 1281-1290. |
| [2] |
KOO H K, VASILESCU D M, BOOTH S, HSIEH A, KATSAMENIS O L, FISHBANE N, et al. Small airways disease in mild and moderate chronic obstructive pulmonary disease: a cross-sectional study[J]. Lancet Respir Med, 2018, 6: 591-602. |
| [3] |
GALBÁN C J, HAN M K, BOES J L, CHUGHTAI K A, MEYER C R, JOHNSON T D, et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression[J]. Nat Med, 2012, 18: 1711-1715. |
| [4] |
夏艺, 管宇, 范丽, 张铁峰, 刘士远, 李兵, 等. 慢性阻塞性肺疾病患者不同HRCT表现型的临床及CT容积量化的分析[J]. 实用放射学杂志, 2013, 29: 1067-1070. DOI:10.3969/j.issn.1002-1671.2013.07.010 |
| [5] |
VASILESCU D M, MARTINEZ F J, MARCHETTI N, GALBÁN C J, HATT C, MELDRUM C A, et al. Noninvasive imaging biomarker identifies small airway damage in severe chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2019, 200: 575-581. |
| [6] |
CHO J, LEE C H, KIM D K, HWANG H G, KIM Y I, CHOI H S, et al. Impact of gender on chronic obstructive pulmonary disease outcomes: a propensity score-matched analysis of a prospective cohort study[J]. Korean J Intern Med, 2020, 35: 1154-1163. |
| [7] |
JENKINS C. Differences between men and women with chronic obstructive pulmonary disease[J]. Clin Chest Med, 2021, 42: 443-456. |
| [8] |
WATSON L, VONK J M, LÖFDAHL C G, PRIDE N B, PAUWELS R A, LAITINEN L A, et al. Predictors of lung function and its decline in mild to moderate COPD in association with gender: results from the Euroscop study[J]. Respir Med, 2006, 100: 746-753. |
| [9] |
BOES J L, HOFF B A, BULE M, JOHNSON T D, REHEMTULLA A, CHAMBERLAIN R, et al. Parametric response mapping monitors temporal changes on lung CT scans in the Subpopulations and Intermediate Outcome Measures in COPD Study (SPIROMICS)[J]. Acad Radiol, 2015, 22: 186-194. |
| [10] |
HOFF B A, POMPE E, GALBÁN S, POSTMA D S, LAMMERS J W J, TEN HACKEN N H T, et al. CT-based local distribution metric improves characterization of COPD[J/OL]. Sci Rep, 2017, 7: 2999. DOI: 10.1038/s41598-017-02871-1.
|
| [11] |
FAN L, XIA Y, GUAN Y, YU H, ZHANG T F, LIU S Y, et al. Capability of differentiating smokers with normal pulmonary function from COPD patients: a comparison of CT pulmonary volume analysis and MR perfusion imaging[J]. Eur Radiol, 2013, 23: 1234-1241. |
| [12] |
BHATT S P, SOLER X, WANG X, MURRAY S, ANZUETO A R, BEATY T H, et al. Association between functional small airway disease and FEV1 decline in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2016, 194: 178-184. |
| [13] |
管宇, 范丽, 夏艺, 刘士远, 姜彦. 慢性阻塞性肺疾病患者小气道重塑及肺叶水平肺气肿的CT定量分析及其与肺功能的相关性研究[J]. 中国医学影像技术, 2015, 31: 181-185. |
| [14] |
赵凡惠, 王雷, 朱彦瑾, 李建龙, 郭佑民, 黄晓旗. 基于双气相定量CT评估COPD患者小气道病变和肺气肿程度的研究[J]. 临床放射学杂志, 2019, 38: 2307-2312. |
| [15] |
MARTINEZ C H, DIAZ A A, MELDRUM C, CURTIS J L, COOPER C B, PIROZZI C, et al. Age and small airway imaging abnormalities in subjects with and without airflow obstruction in SPIROMICS[J]. Am J Respir Crit Care Med, 2017, 195: 464-472. |
| [16] |
WANG C, XU J, YANG L, XU Y, ZHANG X, BAI C, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health[CPH] study): a national cross-sectional study[J]. Lancet, 2018, 391: 1706-1717. |
| [17] |
HOGG J C, MCDONOUGH J E, SUZUKI M. Small airway obstruction in COPD: new insights based on micro-CT imaging and MRI imaging[J]. Chest, 2013, 143: 1436-1443. |
| [18] |
POMPE E, MOORE C M, MOHAMED HOESEIN F A A, DE JONG P A, CHARBONNIER J P, HAN M K, et al. Progression of emphysema and small airways disease in cigarette smokers[J]. Chronic Obstr Pulm Dis Miami Fla, 2021, 8: 198-212. |
| [19] |
POMPE E, STRAND M, VAN RIKXOORT E M, HOFFMAN E A, BARR R G, CHARBONNIER J P, et al. Five-year progression of emphysema and air trapping at CT in smokers with and those without chronic obstructive pulmonary disease: results from the COPDGene study[J]. Radiology, 2020, 295: 218-226. |
| [20] |
王雯婷, 王晓华, 贺蓓, 沈宁. 基于吸呼双相CT定量参数的慢性阻塞性肺疾病影像学表型研究[J]. 中华医学杂志, 2021, 101: 2242-2245. |
| [21] |
李艳, 高俊刚, 郭佑民, 代永亮. 支气管炎型和肺气肿型COPD患者CT定量指标及肺功能的纵向变化研究[J]. 临床放射学杂志, 2020, 39: 1104-1107. |
| [22] |
SATO K, SHIBATA Y, INOUE S, IGARASHI A, TOKAIRIN Y, YAMAUCHI K, et al. Impact of cigarette smoking on decline in forced expiratory volume in 1 s relative to severity of airflow obstruction in a Japanese general population: the Yamagata-Takahata study[J]. Respir Investig, 2018, 56: 120-127. |
| [23] |
HOGG J C, CHU F, UTOKAPARCH S, WOODS R, ELLIOTT W M, BUZATU L, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease[J]. N Engl J Med, 2004, 350: 2645-2653. |
| [24] |
MCDONOUGH J E, YUAN R, SUZUKI M, SEYEDNEJAD N, ELLIOTT W M, SANCHEZ P G, et al. Small-airway obstruction and emphysema in chronic obstructive pulmonary disease[J]. N Engl J Med, 2011, 365: 1567-1575. |
 2022, Vol. 43
2022, Vol. 43


