2. 海军军医大学(第二军医大学)第一附属医院病理科,上海 200433;
3. 复旦大学附属华山医院病理科,上海 200040;
4. 上海交通大学医学院附属新华医院病理科,上海 200092;
5. 复旦大学附属中山医院病理科,上海 200032
2. Department of Pathology, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Pathology, Huashan Hospital, Fudan University, Shanghai 200040, China;
4. Department of Pathology, Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China;
5. Department of Pathology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
三色染色是一组用于区分各种结缔组织和肌肉成分包括胶原、横纹肌、平滑肌、红细胞和纤维蛋白等的染色技术。该染色方法对评估心、肝、肾和肺组织切片中纤维化特别是早期纤维化的存在和密度及肿瘤的诊断与鉴别诊断有重要价值[1-3]。经典的Masson三色染色法染出的组织切片颜色艳丽、色彩对比分明,但操作程序多,染色效果不稳定,严重影响了其在病理诊断中的应用。为提高该技术的染色效果及可靠性,上海市临床病理专科委员会联合上海市临床病理质量控制中心对上海市50家医院病理科进行了Masson三色染色室间质量控制测评。现就测评中发现的染色关键缺陷问题进行分析,并探讨主要原因及解决方案。
1 材料和方法 1.1 材料选取海军军医大学(第二军医大学)第三附属医院病理科2020年病理诊断为结节性肝硬化的石蜡标本5例。
1.2 方法对5例石蜡标本进行连续切片,制成4 μm厚的切片,分发至各参评医院进行Masson三色染色。
1.2.1 试剂Masson三色染色液购自珠海贝索生物技术有限公司(产品批号C200909)。主要试剂包括Weigert铁苏木精A液、Weigert铁苏木精B液、丽春红酸性品红液、1%磷钼酸水溶液和2%苯胺蓝液。置于2~8℃冰箱中保存待用。
1.2.2 染色步骤按Masson三色染色液的使用说明书进行染色操作,流程简述如下:(1)将石蜡切片常规脱蜡至水;(2)用Bouin液室温媒染1 h,流水冲洗至组织切片上的黄色消失;(3)用Weigert铁苏木精A、B混合液染5~10 min,流水稍冲洗;(4)用1%盐酸乙醇分化液分化数秒,流水冲洗返蓝10 min;(5)用丽春红酸性品红液染5~10 min,流水稍冲洗;(6)用1%磷钼酸水溶液处理约5 min,倾去玻片上的磷钼酸水溶液(不用水洗);(7)用2%苯胺蓝液复染5 min,倾去玻片上的染液(不用水洗);(8)用1%冰乙酸水溶液冲洗切片,至切片无蓝色脱出;(9)95%乙醇稍洗,无水乙醇脱水,二甲苯透明,中性树胶封片。
1.3 结果判定将切片置于高倍镜下观察,染色成功的切片应为细胞核染成蓝黑色,细胞质、肌纤维、红细胞染成不同深浅的红色,胶原纤维染成蓝色,且各种颜色对比清晰、境界分明。
1.4 质量控制评分本次质量控制着重对染色质量进行评价,不考虑前期组织处理、组织切片及染色后封固质量。由上海市临床病理专科委员会预先制定Masson三色染色评分标准:细胞核结构清晰,为蓝黑色,最高记20分,染色过深或过浅减1~10分,无染色减20分;细胞质结构清晰,为红色,最高记20分,染色过深或过浅减1~10分,无染色减20分;肌纤维染色为红色,最高记20分,未染色或染色为灰色减1~10分,影响判断减20分;胶原纤维染色均匀,为蓝色,最高记20分,染色不均匀或染色不正确减1~10分;影响判断减20分;上述各染色均对比清晰,最高记20分,染色过深或过浅减1~10分。由2名主任医师[分别来自海军军医大学(第二军医大学)第一附属医院病理科和复旦大学华山医院病理科]阅片并按标准评分,取2人平均分为染色切片最终得分,并进行定级。定级标准:甲级片,≥90分(优);乙级片,75~89分(良);丙级片,60~74分(基本合格);丁级片,<60分(不合格)。
2 结果本次Masson三色染色室间质量控制测评共发放切片50张,最终48家医院提交了染色切片。根据2名主任医师的评分结果,其中甲级片17张、乙级片25张、丙级片4张、丁级片2张。
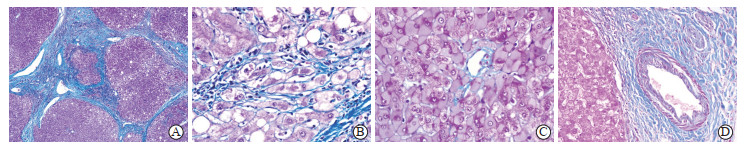
优良染色的42张(87.5%)切片定位准确,染色强度恰当,无非特异性着色,各种染色对比清晰。胶原纤维染成蓝色,肌纤维红色,上皮成分淡红色,细胞核蓝黑色,可清楚显示肝硬化时纤维化程度与范围(图 1A),如累及门管区、中央静脉周和窦周的纤维化(图 1B);也突出显示肝细胞的改变,如慢性肝炎区域肝细胞的毛玻璃样包涵体、Mallory小体和脂肪变肝细胞的巨大线粒体呈暗红色(图 1C)。该染色可将神经束染成红(神经纤维)蓝(或绿,胶原纤维)相间,有别于胶原纤维(图 1D)。
|
图 1 肝硬化组织Masson三色染色优良切片的显微镜下图 Fig 1 Microscopic views of excellent Masson trichrome stained slices of cirrhotic tissues A: Collagen fibers were stained blue and cytoplasm was stained red (40×); B: Fibrosis around hepatic sinuses was stained blue (400×); C: Ground glass inclusions of hepatocytes were stained dark red (400×); D: Smooth muscle of interlobular vessels was stained red and nerve fibers alternated with blue and red (200×). |
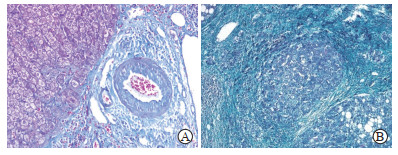
出现的染色缺陷主要包括:(1)细胞核淡染,与细胞质对比差;(2)细胞核染色过深而模糊,细胞质呈灰蓝色;(3)细胞质染色过深或过浅;(4)平滑肌纤维未染色或呈灰色而非红色(图 2A);(5)组织结构呈现错误的染色或染色不均匀,如胶原纤维未着色或整个切片染成蓝色等假象(图 2B)。48张染色切片存在的染色缺陷及占比情况见表 1。
|
图 2 肝硬化组织Masson三色染色质量不佳切片的显微镜下图 Fig 2 Microscopic views of poor Masson trichrome stained slices of cirrhotic tissues A: Smooth muscles of interlobular vascular wall were stained gray rather than red (200×); B: The whole slice was stained blue (100×). |
|
|
表 1 Masson三色染色常见的染色缺陷 Tab 1 Common staining defects of Masson trichrome staining |
3 讨论
Masson三色染色法是临床病理学诊断中最常用的特殊染色方法,其染色过程中影响染色结果的因素包括:(1)胶原蛋白和细胞质的物理性质;(2)不同分子量的染料离子在组织基质上的附着方式;(3)不同组织结构中氨基酸的组成等。Masson三色染色通常使用3种阴离子染料,可包括或不包括细胞核染色。切片先用酸性染料如丽春红酸性品红染色,所有嗜酸性组织成分如细胞质、平滑肌和胶原蛋白都会与酸性染料结合;然后用磷钨酸或磷钼酸处理切片,由于细胞质的渗透性远低于胶原蛋白,磷钨酸/磷钼酸可使丽春红酸性品红先于细胞质扩散出胶原蛋白,并且磷钨酸/磷钼酸含有的许多酸性基团可使脱色的胶原蛋白与苯胺蓝染料之间结合。此外,磷钨酸/磷钼酸溶液的pH值可选择性增加胶原染色,并有助于去除丽春红酸性品红着色[4-5]。
本次Masson三色染色室间质量控制评价中,有87.5%的染色切片定位准确、染色强度恰当,无非特异性着色,各种染色对比清晰,但也存在一些不足。(1)细胞核染色过淡,与细胞质对比差。可能原因包括:①未使用铁苏木精进行细胞核染色,随后的丽春红酸性品红染料去除了细胞核染色;②未使用新鲜配制的铁苏木精,致氧化过度;③细胞核染色时间不足导致染色较弱;④复染分化差,掩盖了细胞核染色。解决方案包括:①避免使用明矾苏木精;②在使用前混合等量的铁苏木精储备溶液,以获得较强的细胞核染色;③确定铁苏木精染色的最佳时间;④确保红色和蓝色复染的正确分化[6]。
(2)细胞核染色过深而模糊。可能原因包括:①铁苏木精过染;②铁苏木精染色后洗涤不足。解决方案包括:①确定铁苏木精染色的最佳时间;②铁苏木精染色后用70%乙醇快速冲洗,然后在自来水中彻底清洗[6]。
(3)细胞质染色过浅,组织结构不明确。可能原因包括:①长时间水洗;②脱水过程中,在乙醇中停留时间过长;③甲醛固定的组织在染色前未经后固定处理;④使用陈旧的或多次使用的染色试剂;⑤组织自溶或固定延迟,导致组织结构保存不良。解决方案包括:①缩短洗涤时间;②封固前避免在脱水溶液中长时间存放;③甲醛固定的组织在染色前应使用Bouin溶液、苦味酸溶液或氯化汞溶液预处理,以达到所需的媒染效果;④细胞质染料溶液使用不应超过2次[6]。
(4)平滑肌纤维未染色或呈灰色而非红色。可能原因包括:①铁苏木精过染,或未结合的铁苏木精去除不充分;②使用陈旧的或多次使用的染色试剂;③甲醛固定的组织在染色前未进行预处理。解决方案包括:①调整铁苏木精染色时间;②铁苏木精染色后使用70%乙醇和水彻底清洗;③及时更换新试剂;④甲醛固定的组织在染色前用Bouin溶液、苦味酸溶液或氯化汞溶液进行预处理,以达到所需的媒染效果[6]。
(5)组织结构呈现错误的染色或染色不均匀。可能原因包括:①甲醛固定的组织在染色前未经后固定;②组织分化不当;③1种或多种染色液的pH值不正确;④在乙酸溶液中清洗不当。解决方案包括:①甲醛固定的组织在染色前应使用Bouin溶液、苦味酸溶液或氯化汞溶液后固定,以达到所需的媒染效果;②正确的分化,要求染色过程中每个步骤时间准确,避免在乙酸溶液中长时间洗涤,以防止去除所需结构上的染料;③验证染料溶液的pH值是否为2.5或更低[6]。
染色的操作质量是保障切片染色对比清晰的关键。影响Masson三色染色效果的因素包括固定剂、pH值、染料浓度(特别是混合染料溶液)和组织在每种溶液中的持续时间[6]。(1)10%中性缓冲甲醛是许多实验室通用的固定剂,可使组织保持良好的形态,但甲醛本身不是三色染色的最佳固定剂,含汞固定剂(如B5或Zenker固定液)和含有苦味酸的Bouin溶液可提供明亮、强烈的三色染色。Masson三色染色通常用Bouin溶液固定1 h,并在染色前用自来水彻底清洗以去除苦味酸的色素。(2)pH值在Masson三色染色中起着至关重要的作用,因此,必须使用乙酸将染料溶液的pH值降低至低于组织蛋白质的等电点水平,以确保三色染色中使用的阴离子染料与组织中适当的阳离子(带正电荷)结合。Masson三色染色通常在pH值为2.5或更低的条件下进行。(3)核染色剂特别是明矾苏木精很容易被酸性的染料溶液去除,因此,必须使用耐酸性的染料进行细胞核染色,Weigert、Lillie和Verhoeff铁苏木精是较好的选择,使用前新鲜配制,染色后彻底清洗,可获得较佳的细胞核染色效果。(4)与大多数染色一样,设置适当的阳性对照切片十分关键。Masson三色染色时,使用血管壁作为阳性对照组织,血管平滑肌有助于验证正确的红色染色。此外,存在于大多数组织中的胶原蛋白可用于验证正确的蓝色染色。用阳性对照的组织芯片与待检测组织在同一张切片上进行染色[7],以及全自动特殊染色在日常工作中的应用[8]对于实验条件的一致性、染色结果的准确性和可靠性提供了有利保证。
综上所述,Masson三色染色时,操作中需严格掌握和控制染色过程中的染色温度、染色时间、pH值、试剂配制与保存等细节,这样才能保证三色染色的质量及染色的稳定性和可靠性,从而更好地服务于临床病理诊断。
| [1] |
MONTGOMERY E A. Diagnostic histochemistry of soft tissue lesions[J]. Semin Diagn Pathol, 2018, 35: 399-406. DOI:10.1053/j.semdp.2018.10.005 |
| [2] |
IEZZONI J C. Diagnostic histochemistry in hepatic pathology[J]. Semin Diagn Pathol, 2018, 35: 381-389. DOI:10.1053/j.semdp.2018.10.003 |
| [3] |
CATHRO H P, SHEN S S, TRUONG L D. Diagnostic histochemistry in medical diseases of the kidney[J]. Semin Diagn Pathol, 2018, 35: 360-369. |
| [4] |
凌启波. 实用病理特殊染色和组化技术[M]. 广州: 广东高等教育出版社, 1989: 4-9.
|
| [5] |
CARSON F L, CAPPELLANO C H. Histotechnology: a self-instructional text[M]. 4th ed. Chicago: ASCP Press, 2015: 162-164.
|
| [6] |
BROWN R. Histologic preparations-common problems and their solutions[M]. Northfield Illinois: College of American Pathologists, 2009: 81-85.
|
| [7] |
章如松, 孟奎, 石群立, 周晓军, 吴慰霖, 周航波. 组织芯片技术在特殊染色阳性对照中的应用[J]. 临床与实验病理学杂志, 2005, 21: 492-493. |
| [8] |
章如松, 马恒辉, 王璇, 何燕, 周晓军. 全自动染色机在部分特殊染色中的应用[J]. 诊断病理学杂志, 2011, 18: 234. |
 2022, Vol. 43
2022, Vol. 43


