肺癌严重威胁着人类的健康,其中非小细胞肺癌占肺癌的80%以上[1]。治疗非小细胞肺癌的方式多种多样,其中化疗仍是最基础、最重要的治疗方式。顺铂作为非小细胞肺癌的一线化疗用药,在临床治疗中起着重要作用。顺铂获得性耐药严重限制了其在非小细胞肺癌治疗中的疗效,相关机制包括DNA修复能力增强、药物解毒增加、药物摄取积聚减少、机体对铂类络合物的耐受性增加等[2-3]。研究表明,miRNA通过靶向调控相关蛋白参与肿瘤的耐药过程[4]。Ling等[5]研究发现,miRNA-4286能够影响非小细胞肺癌细胞的增殖、迁移等过程,但是否参与肿瘤细胞耐药还未有报道。本实验以人非小细胞肺癌A549细胞为研究对象,探讨在顺铂的作用下miRNA-4286对A549细胞的影响,及其在调节非小细胞肺癌对顺铂敏感性中的作用及可能机制,期望为对顺铂耐药的非小细胞肺癌患者提供新的治疗靶点。
1 材料和方法 1.1 材料人非小细胞肺癌A549细胞由重庆医科大学附属第一医院分子与肿瘤实验室提供;顺铂耐药A549细胞(A549/DDP细胞)购自上海轩祎生物科技服务中心;顺铂及SYBR Green PCR试剂盒均购自北京索莱宝科技有限公司;DMEM购自美国HyClone公司;FBS购自德国PAN-Biotech公司;LipofectamineTM 2000购自美国Invitrogen公司;CCK-8试剂盒购自日本同仁化学研究所;膜联蛋白(annexin)Ⅴ-FITC/PI凋亡检测试剂盒、RIPA裂解液、SDS-PAGE凝胶快速配制试剂盒均购自上海碧云天生物技术有限公司;核输出蛋白1(exportin 1,XPO1)鼠抗人单克隆抗体购自美国Proteintech公司;B淋巴细胞瘤2相关X蛋白(B-cell lymphoma-related X protein,Bax)兔抗人单克隆抗体、Bcl-2兔抗人单克隆抗体、caspase 3兔抗人单克隆抗体、β-肌动蛋白鼠抗人单克隆抗体均购自美国CST公司。
1.2 细胞培养A549细胞和A549/DDP细胞均置于37 ℃、5% CO2培养箱中培养,细胞培养基为含10% FBS、100 U/mL青霉素-链霉素的DMEM。细胞培养3~4 d传代1次。
1.3 细胞转染和分组将A549细胞按2×105个/孔种于6孔板中,孵育24 h,加入LipofectamineTM 2000试剂进行转染。采用siRNA构建XPO1低表达细胞模型,分为两组:低表达阴性对照(siRNA-NC)组、低表达XPO1(siRNA-XPO1)组。分别采用miRNA-4286模拟物和抑制剂构建miRNA-4286的过表达细胞模型和低表达细胞模型,共分为4组:过表达阴性对照(mimic-NC)组、过表达miRNA-4286(miRNA-4286 mimic)组、低表达阴性对照(inhibitor-NC)组、低表达miRNA-4286(miRNA-4286 inhibitor)组。XPO1 siRNA及miRNA-4286的模拟物、抑制剂和两者的阴性对照均由北京擎科生物科技有限公司设计并合成,序列如下:siRNA-NC正义链序列5'-UUCUCCGAACGUGUCACGUTT-3',反义链序列5'-ACGUGACACGUUCGGAGAATT-3';siRNA-XPO1正义链序列5'-CCUCACCUACAAGAUGCUCA-A-3',反义链序列5'-UUGAGCAUCUUGUAGG-UGAGG-3';miRNA-4286-mimic正义链序列5'-AC-CCCACUCCUGGUACC-3',反义链序列5'-GGUA-CCAGGAGUGGGGU-3';miRNA-4286-inhibitor序列5'-GGUACCAGGAGUGGGGU-3';mimic-NC正义链序列5'-UCACAACCUCCUAGAAAG-AGUAGA-3',反义链序列5'-UCUACUCUUUCU-AGGAGGUUGUGA-3';inhibitor-NC序列5'-UCU-ACUCUUUCUAGGAGGUUGUGA-3'。
1.4 qPCR检测miRNA-4286的表达用TRIzol试剂提取细胞总RNA,反转录成cDNA后,按SYBR Green PCR试剂盒说明书进行qPCR。反应条件为95 ℃预变性30 s,95 ℃变性5 s、60 ℃退火30 s,循环45次。每组设3个复孔,以U6为内参。引物由北京擎科生物科技有限公司设计合成,序列如下:miRNA-4286反转录引物5'-GAACAACCAACACAACCCAACATTGG-TTGTTCGGTACC-3',miRNA-4286正向引物5'-AGGCACCCCACTCCT-3',miRNA-4286反向引物5'-AACAACCAACACAACCCAAC-3'。U6正向引物5'-AGCACATATACTAAAATTGGAACGAT-3', 反向引物5'-ACTGCAGGGTCCGAGGTATT-3';茎环引物5'-GTCGTATCGACTGCAGGGTCCGAGG-TATTCGCAGTCGATACGACAAAATATG-3'。采用2-∆∆Ct方法进行数据分析
1.5 CCK-8法检测细胞的增殖活性将转染后的各组细胞以2 000个/孔接种于96孔板中,用含2 μg/mL顺铂的细胞培养基孵育,每组设3个复孔,分别于孵育0、24、48、72、96 h时加入10 mL CCK-8试剂,避光孵育1 h后用酶标仪测定波长450 nm处的光密度(D)值。
1.6 平板集落形成实验检测细胞的增殖能力将转染后的各组细胞以200个/孔种于6孔板中,分别加入含0、1、2 μg/mL顺铂的完全培养基,继续孵育14 d后终止培养。加入4%多聚甲醛固定细胞15 min后,采用结晶紫染色10 min,计算集落形成率。
1.7 流式细胞术检测细胞凋亡率各组细胞转染6 h后分别用含0、1、2 μg/mL顺铂的完全培养基继续孵育48 h,收集各组细胞,加入5 mL膜联蛋白Ⅴ和5 mL PI混匀,室温避光孵育15 min后用流式细胞仪检测。
1.8 蛋白质印迹法检测XPO1、Bcl-2、Bax、caspase 3蛋白的表达水平各组细胞转染6 h后用含2 μg/mL顺铂的完全培养基继续孵育48 h后收集细胞,用含苯甲基磺酰氟的RIPA裂解液提取细胞总蛋白质,用BCA法测定蛋白浓度,按照4∶1比例加入蛋白上样缓冲液,混匀后于100 ℃加热10 min变性。经12% SDS-PAGE分离蛋白,转移蛋白至PVDF膜上,用5%的脱脂牛奶封闭1 h,加入一抗4 ℃孵育过夜(β-肌动蛋白为内参)。用TBST洗膜0.5 h,加入一抗对应种属的二抗室温孵育1 h,洗膜0.5 h,加入显影液。于暗室内曝光胶片,凝胶成像系统观察并拍照。
1.9 生物信息学分析通过TargetScan数据库(https:www.targetscan.org)进行miRNA-4286的靶基因预测。
1.10 统计学处理采用GraphPad Prism 8软件分析数据。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(多重比较采用Dunnett-t检验)。检验水准(α)为0.05。
2 结果 2.1 miRNA-4286在A549、A549/DDP细胞中的差异表达和转染效率验证qPCR检测结果显示,miRNA-4286在A549细胞中的表达水平高于在A549/DDP细胞中的表达水平(1.16±0.42 vs 0.39±0.14,P<0.01)。与过表达阴性对照组相比,过表达miRNA-4286组的miRNA-4286表达增加(0.68±0.09 vs 0.24±0.02,P<0.01);与低表达阴性对照组相比,低表达miRNA-4286组的miRNA-4286表达降低(0.01±0.01 vs 0.49±0.10,P<0.01)。
2.2 miRNA-4286在调节非小细胞肺癌A549细胞对顺铂敏感性中的作用CCK-8法检测结果显示,在2 μg/mL顺铂作用下,过表达miRNA-4286组A549细胞的增殖率较过表达阴性对照组降低(P<0.05或P<0.01);与低表达阴性对照组比较,低表达miRNA-4286组A549细胞的增殖率增高(P<0.05)。见图 1。
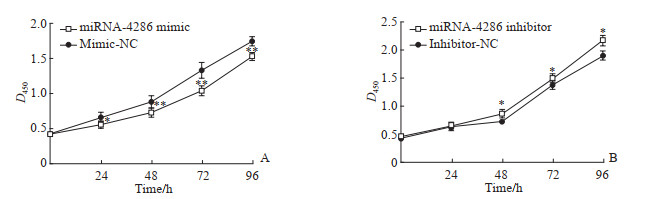
|
图 1 CCK-8法检测2 μg/mL顺铂作用下过表达(A)及低表达(B)miRNA-4286对人非小细胞肺癌A549细胞增殖的影响 Fig 1 Effects of overexpression (A) and low expression (B) of miRNA-4286 on proliferation of human non-small cell lung cancer A549 cells treated with 2 μg/mL cisplatin detected by CCK-8 assay *P < 0.05, **P < 0.01 vs mimic-NC group or inhibitor-NC group at same time point. n=5, x±s. CCK-8: Cell counting kit 8; miRNA: MicroRNA; NC: Negative control. |
平板集落形成实验检测结果显示,在0~2 μg/mL顺铂作用下,与过表达阴性对照组比较,过表达miRNA-4286组A549细胞集落形成率降低(P<0.01),说明A549对顺铂的敏感性增高;与低表达阴性对照组比较,低表达miRNA-4286组A549细胞集落形成率增高(P<0.01),说明A549对顺铂的敏感性降低,见图 2。

|
图 2 平板集落形成实验检测不同浓度顺铂作用下过表达(A)及低表达(B)miRNA-4286对人非小细胞肺癌A549细胞增殖的影响 Fig 2 Effects of overexpression (A) and low expression (B) of miRNA-4286 on proliferation of human non-small cell lung cancer A549 cells treated with different concentrations of cisplatin detected by plate colony-forming test **P < 0.01 vs mimic-NC group or inhibitor-NC group in same cisplatin concentration. n=3, x±s. miRNA: MicroRNA; NC: Negative control. |
流式细胞术检测结果显示,与过表达阴性对照组比较,在0~2 μg/mL顺铂作用下过表达miRNA-4286组A549细胞凋亡率增高(P<0.01);与低表达阴性对照组比较,低表达miRNA-4286组A549细胞凋亡率降低(P<0.01,图 3)。
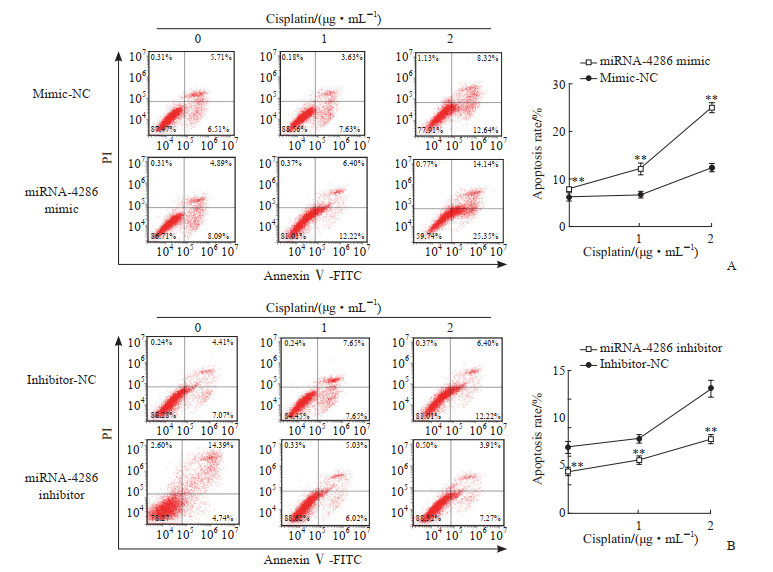
|
图 3 流式细胞术检测不同浓度顺铂作用下过表达(A)及低表达(B)miRNA-4286对人非小细胞肺癌A549细胞凋亡的影响 Fig 3 Effects of overexpression (A) and low expression (B) of miRNA-4286 on apoptosis of human non-small cell lung cancer A549 cells treated with different concentrations of cisplatin detected by flow cytometry **P < 0.01 vs mimic-NC group or inhibitor-NC group in same cisplatin concentration. n=3, x±s. miRNA: MicroRNA; PI: Propidium iodide; FITC: Fluorescein isothiocyanate; NC: Negative control. |
2.3 XPO1 siRNA的干扰效果及miRNA-4286和XPO1的靶向关系
蛋白质印迹法检测结果显示转染siRNA-XPO1后,XPO1蛋白表达较对照组降低(0.44±0.01 vs 0.94±0.03),差异有统计学意义(P<0.01,图 4A)。TargetScan分析结果显示,miRNA-4286中存在XPO1的结合位点,XPO1可能是miRNA-4286的下游靶基因。qPCR法验证结果显示,与过表达阴性对照组相比,过表达miRNA-4286组XPO1 mRNA的表达量降低(0.22±0.03 vs 0.31±0.04,P<0.05);与低表达阴性对照组相比,低表达miRNA-4286组XPO1 mRNA的表达量增加(1.01±0.18 vs 0.28±0.06,P<0.01]。蛋白质印迹法验证结果显示,与过表达阴性对照组相比,过表达miRNA-4286组XPO1蛋白的表达量降低(0.47±0.02 vs 0.74±0.03,P<0.01);与低表达阴性对照组相比,低表达miRNA-4286组XPO1蛋白的表达量增加(1.61±0.02 vs 1.12±0.13,P<0.01)。见图 4B。以上结果说明miRNA-4286和XPO1存在负调控关系。
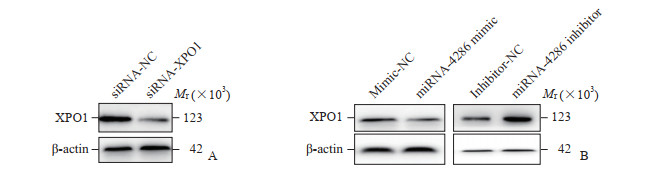
|
图 4 蛋白质印迹法检测siRNA对XPO1蛋白表达的抑制作用(A)及过表达或低表达miRNA-4286对XPO1蛋白表达的影响(B) Fig 4 Inhibiting effects of siRNA on expression of XPO1 protein (A) and expression of XPO1 protein after overexpression or low expression of miRNA-4286 (B) detected by Western blotting siRNA: Small interfering RNA; XPO1: Exportin 1; miRNA: MicroRNA; NC: Negative control. |
2.4 miRNA-4286和siRNA-XPO1对非小细胞肺癌A549细胞凋亡的影响
流式细胞术检测结果(图 5A)显示,在2 μg/mL顺铂的作用下,与低表达阴性对照组相比,低表达miRNA-4286组A549细胞凋亡率降低[(12.02±0.73)% vs(19.97±0.68)%,P<0.01)],而同时下调miRNA-4286和XPO1能负调控此作用[(22.95±0.65)% vs(12.02±0.73)%,P<0.01)]。

|
图 5 MiRNA-4286和XPO1对人非小细胞肺癌A549细胞的凋亡率和凋亡蛋白表达的影响 Fig 5 Effects of miRNA-4286 and XPO1 on apoptosis rate and apoptosis protein expression of human non-small cell lung cancer A549 cells A: Apoptosis rate detected by flow cytometry (n=3, x±s); B: Effects of miRNA-4286 on apoptosis protein expression detected by Western blotting (n=4, x±s); C: Effects of miRNA-4286 combined with XPO1 on apoptosis protein expression detected by Western blotting (n=3, x±s). *P < 0.05, **P < 0.01. miRNA: MicroRNA; XPO1: Exportin 1; NC: Negative control; PI: Propidium iodide; FITC: Fluorescein isothiocyanate; DDP: Cisplatin; siRNA: Small interfering RNA; caspase 3: Cysteine aspartic acid specific protease 3; Bax: B-cell lymphoma-related X protein; Bcl-2: B-cell lymphoma 2. |
蛋白质印迹法检测结果显示,在2 μg/mL顺铂作用下,与低表达阴性对照组相比,低表达miRNA-4286组A549细胞中caspase 3和Bax蛋白表达减少、Bcl-2表达增加(0.97±0.02 vs 1.08±0.01、0.78±0.01 vs 0.93±0.02、0.89±0.01 vs 0.67±0.03,P<0.05或P<0.01,图 5B)。与低表达阴性对照组相比,下调XPO1后A549细胞中caspase 3蛋白表达增加(1.14±0.08 vs 0.54±0.09)、Bax蛋白表达增加(1.00±0.06 vs 0.86±0.04)、Bcl-2蛋白表达减少(0.96±0.01 vs 1.45±0.01),差异均有统计学意义(P<0.05或P<0.01);而同时下调miRNA-4286和XPO1能负调控XPO1表达减少对A549细胞凋亡蛋白的影响,caspase 3和Bax蛋白表达均减少(0.82±0.05 vs 1.14±0.08和0.93±0.06 vs 1.00±0.06)、Bcl-2蛋白表达增加(1.05±0.03 vs 0.96±0.01,P<0.05或P<0.01,图 5C)。
3 讨论肺癌是威胁全世界人类健康的主要癌症之一,大多数患者明确诊断时已是肺癌晚期,其中无手术和靶向药物治疗机会的非小细胞肺癌患者往往需要进行化疗。顺铂被广泛用于临床,但随着化疗的进行很多患者出现了顺铂获得性耐药,后期疗效不佳。因此,探讨非小细胞肺癌顺铂获得性耐药的分子机制和化学抗性对于提高其化疗敏感性具有重要意义。
研究证实,miRNA主要通过负调控下游靶蛋白参与肿瘤细胞的活动,包括癌症的发生、发展、诊断、治疗、耐药、预后等过程[6]。Han等[7]报道,miRNA-132-3p能通过NF-κB途径靶向沉默调节蛋白1(sirtuin 1,SIRT1),促进顺铂诱导的肾小管上皮细胞凋亡和炎症反应。Ye等[8]研究表明,miRNA-219-5p可以靶向调控T-box转录因子T(T-box transcription factor T,TBXT),从而抑制乳腺癌细胞上皮间质转化和细胞迁移及侵袭。Lin等[9]发现,miRNA-133b通过成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)-Wnt-β-联蛋白(β-catenin)信号通路抑制三阴性乳腺癌细胞的生长及顺铂抗性。而Ling等[5]研究表明,miRNA-4286能够影响非小细胞肺癌细胞的增殖、迁移等过程,但是否参与肿瘤细胞顺铂耐药还未见报道。Dong等[10]研究发现,miRNA-31通过调节药物转运蛋白ABCB9抑制顺铂诱导的非小细胞肺癌细胞凋亡。caspase 3、Bax、Bcl-2是线粒体凋亡途径的典型标志物,caspase 3、Bax蛋白水平升高和Bcl-2蛋白水平降低是该途径被激活的标志[11]。本实验以人非小细胞肺癌A549细胞为研究对象,发现miRNA-4286在A549细胞中的表达高于A549/DDP细胞,然后通过CCK-8实验、平板集落形成实验、流式凋亡术观察A549细胞对顺铂敏感性的改变,并且通过检测A549细胞中Bax、caspase 3、Bcl-2蛋白质表达水平评估线粒体凋亡水平。体外实验发现,过表达miRNA-4286后A549细胞增殖率降低、凋亡率增高、对顺铂的敏感性增高;低表达miRNA-4286后结果与之相反。在2 μg/mL顺铂作用下,下调miRNA-4286后A549细胞凋亡,且caspase 3和Bax蛋白表达减少、Bcl-2表达增加;下调XPO1促进A549细胞凋亡,caspase 3和Bax蛋白表达增加、Bcl-2表达减少;同时下调miRNA-4286和XPO1能负调控XPO1表达减少对A549细胞凋亡的影响。
XPO1是细胞中关键的核质转运蛋白,能够调节物质从细胞核输出到细胞质中,在维持细胞内稳态中扮演着重要作用[12]。此外,XPO1与肺癌的几种治疗标准有关,包括化疗和靶向治疗,是一个富有吸引力的癌症治疗靶标[13]。多项研究表明,XPO1在多种药物的耐药中扮演重要角色,Chanukuppa等[14]发现,XPO1是多发性骨髓瘤中硼替佐米耐药的关键因素,可能是多发性骨髓瘤的潜在治疗靶标。Verbeke等[15]研究发现,XPO1抑制剂KPT-8602通过NR3C1-和e2f介导的转录复合物增强地塞米松对急性淋巴瘤细胞的抑制作用,使患者对地塞米松的敏感性增高。通过TargetScan数据库分析得知,XPO1可能是miRNA-4286的潜在靶基因,进一步行qPCR和蛋白质印迹法进行验证,结果提示miRNA-4286与XPO1存在靶向关系,XPO1的表达和蛋白水平受miRNA-4286负调控。下调miRNA-4286抑制A549细胞凋亡,对顺铂的敏感性降低;下调XPO1促进A549细胞凋亡,对顺铂的敏感性增高;同时下调XPO1和miRNA-4286后,A549细胞的Bax、caspase 3、Bcl-2的表达与阴性对照组相比差异无统计学意义,表明同时下调miRNA-4286和XPO1能抵消下调XPO1对A549凋亡蛋白表达的影响,miRNA-4286能靶向XPO1作用于凋亡通路,从而降低非小细胞肺癌细胞对顺铂的敏感性。本实验仍然存在不足,只用A549细胞进行实验,没有用顺铂耐药株进行实验,后续将增加A549/DDP细胞进行对照实验,进一步探索miRNA-4286的上游机制。
| [1] |
陈万青, 郑荣寿, 张思维, 曾红梅, 邹小农, 赫捷. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26: 1-7. |
| [2] |
王悦璇, 刘秀均. 顺铂的作用靶点及耐药机制的研究进展[J]. 中国医药生物技术, 2020, 15: 316-319. |
| [3] |
吴小雪, 姚群峰. 顺铂耐药机制研究进展[J]. 湖北中医药大学学报, 2017, 19: 116-122. |
| [4] |
VERGOULIS T, KANELLOS I, KOSTOULAS N, GEORGAKILAS G, SELLIS T, HATZIGEORGIOU A, et al. mirPub: a database for searching microRNA publications[J]. Bioinformatics, 2015, 31: 1502-1504. DOI:10.1093/bioinformatics/btu819 |
| [5] |
LING C H, WANG X T, ZHU J J, TANG H C, DU W W, ZENG Y Y, et al. MicroRNA-4286 promotes cell proliferation, migration, and invasion via PTEN regulation of the PI3K/Akt pathway in non-small cell lung cancer[J]. Cancer Med, 2019, 8: 3520-3531. DOI:10.1002/cam4.2220 |
| [6] |
KONOSHENKO M, LAKTIONOV P. The miRNAs involved in prostate cancer chemotherapy response as chemoresistance and chemosensitivity predictors[J]. Andrology, 2022, 10: 51-71. DOI:10.1111/andr.13086 |
| [7] |
HAN S T, LIN F Y, RUAN Y, ZHAO S, YUAN R, NING J Z, et al. miR-132-3p promotes the cisplatin-induced apoptosis and inflammatory response of renal tubular epithelial cells by targeting SIRT1 via the NF-κB pathway[J/OL]. Int Immunopharmacol, 2021, 99: 108022. DOI: 10.1016/j.intimp.2021.108022.
|
| [8] |
YE Q, WANG X, YUAN M, CUI S S, CHEN Y Y, HU Z D, et al. miR-219-5p targets TBXT and inhibits breast cancer cell EMT and cell migration and invasion[J/OL]. Biosci Rep, 2021, 41: BSR20210318. DOI: 10.1042/BSR20210318.
|
| [9] |
LIN Y, LIN F K, ANUCHAPREEDA S, CHAIWONGSA R, DUANGMANO S, RAN B, et al. Effect of miR-133b on progression and cisplatin resistance of triple-negative breast cancer through FGFR1-Wnt-β-catenin axis[J]. Am J Transl Res, 2021, 13: 5969-5984. |
| [10] |
DONG Z, ZHONG Z W, YANG L H, WANG S M, GONG Z H. microRNA-31 inhibits cisplatin-induced apoptosis in non-small cell lung cancer cells by regulating the drug transporter ABCB9[J]. Cancer Lett, 2014, 343: 249-257. DOI:10.1016/j.canlet.2013.09.034 |
| [11] |
DADSENA S, KING L E, GARCÍA-SÁEZ A J. Apoptosis regulation at the mitochondria membrane level[J/OL]. Biochim Biophys Acta Biomembr, 2021, 1863: 183716. DOI: 10.1016/j.bbamem.2021.183716.
|
| [12] |
AZMI A S, UDDIN M H, MOHAMMAD R M. The nuclear export protein XPO1-from biology to targeted therapy[J]. Nat Rev Clin Oncol, 2021, 18: 152-169. DOI:10.1038/s41571-020-00442-4 |
| [13] |
MING M, WU W J, XIE B Q, SUKHANOVA M, WANG W G, KADRI S, et al. XPO1 inhibitor selinexor overcomes intrinsic ibrutinib resistance in mantle cell lymphoma via nuclear retention of IκB[J]. Mol Cancer Ther, 2018, 17: 2564-2574. DOI:10.1158/1535-7163.MCT-17-0789-ATR |
| [14] |
CHANUKUPPA V, PAUL D, TAUNK K, CHATTERJEE T, SHARMA S, KUMAR S, et al. XPO1 is a critical player for bortezomib resistance in multiple myeloma: a quantitative proteomic approach[J/OL]. J Proteomics, 2019, 209: 103504. DOI: 10.1016/j.jprot.2019.103504.
|
| [15] |
VERBEKE D, DEMEYER S, PRIETO C, DE BOCK C E, DE BIE J, GIELEN O, et al. The XPO1 inhibitor KPT-8602 synergizes with dexamethasone in acute lymphoblastic leukemia[J]. Clin Cancer Res, 2020, 26: 5747-5758. DOI:10.1158/1078-0432.CCR-20-1315 |
 2022, Vol. 43
2022, Vol. 43


