2. 同济大学附属东方医院泌尿外科,上海 200120;
3. 石狮市人民医院泌尿外科,石狮 362700
2. Department of Urology, East Hospital, Tongji University, Shanghai 200120, China;
3. Department of Urology, People's Hospital of Shishi, Shishi 362700, Fujian, China
经腹会阴直肠切除术(abdominoperineal resection,APR)是目前最常用的直肠癌手术方式之一,该手术方式可完整地切除末端结肠、直肠与肛门括约肌复合体,会遗留永久性结肠造口[1]。当前诊断可疑前列腺癌的主要手段为直肠指检(digital rectal examination,DRE)和经直肠超声检查(transrectal ultrasonography,TRUS)前列腺穿刺术,两者均需经肛门入路。临床实践中,如何对血清前列腺特异性抗原(prostate-specific antigen,PSA)水平异常或影像学检查提示存在可疑病灶的APR后患者进一步明确诊断,对接诊医师来说是一个难题。国内外学者针对这一困境提出了多种思路,包括超声引导下前列腺穿刺活检[2-4]、CT引导下前列腺穿刺活检[5-10]和MRI引导下前列腺穿刺活检[11]等单一手段引导下的穿刺方式,以及MRI与超声或CT融合引导的前列腺靶向穿刺活检[12-14]。本文总结了2例APR后可疑前列腺癌患者应用MRI与CT融合引导下经会阴前列腺靶向穿刺技术的诊断过程。
1 资料和方法 1.1 临床资料纳入2021年4月于同济大学附属东方医院泌尿外科就诊的APR后可疑前列腺癌患者2例,2例患者分别因直肠间质瘤与直肠腺癌于6年前和15年前行APR,保留结肠造口。APR后2例患者均在常规检查时发现血清PSA升高(患者1 PSA 14.6 ng/mL,患者2 PSA 959.0 ng/mL)。追问病史得知患者1(58岁)既往“尿频、尿急伴夜尿增多4年,患者2(70岁)既往尿频、尿急、排尿费力3年。2例患者均有进一步进行前列腺穿刺活检指征,均在发现PSA异常后1周内行前列腺穿刺检查。
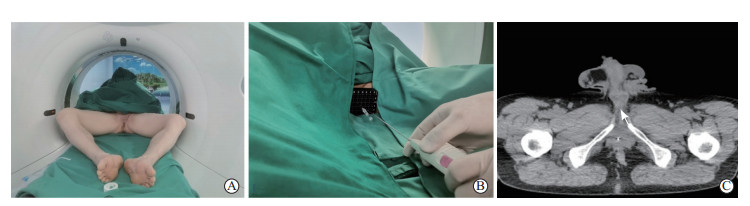
1.2 MRI与CT融合引导下经会阴前列腺穿刺穿刺前,采用Discovery 750 w 3.0 T MRI系统对2例患者进行多参数磁共振成像(multi-parameter magnetic resonance imaging,mpMRI)检查,寻找可疑病灶。为达到最佳的认知融合效果,2例患者的穿刺均由同济大学附属东方医院泌尿外科穿刺经验丰富的同一术者完成。术者在穿刺前仔细审阅患者的MRI图像,同时借助三维定位构建可疑病灶位置的认知图像(具体方法参照文献[15])。穿刺操作在复合手术室进行,步骤如下。(1)患者行全身麻醉,体位以不影响患者在CT机内的穿行且最大程度地暴露患者会阴部为标准(图 1A),局部消毒铺单后紧贴会阴部放置穿刺模板;(2)通过CT获取实时图像,并与患者术前MRI图像进行认知融合;(3)选择合适的模板孔穿刺置入定位针,再行CT检查;(4)将带有定位针和模板的CT图像与术前的MRI图像再进行认知融合,并设定相应的穿刺位点;(5)按设定的穿刺位点,通过模板孔洞置入穿刺针(图 1B),穿刺在CT引导下进行(图 1C)。
|
图 1 MRI与CT融合引导下经会阴前列腺穿刺活检过程 A:患者体位;B:患者接受前列腺穿刺时的场景;C:穿刺时的实时CT引导图像,箭头示穿刺针显影. MRI:磁共振成像;CT:计算机断层扫描. |
1.3 观察指标
将穿刺取得的标本置于10%中性甲醛溶液中固定,随后送病理科进行切片和染色分析,以病理结果作为最终诊断。密切关注穿刺术中及术后患者的反应和并发症(出血、感染、血尿及急性尿潴留等)发生情况。
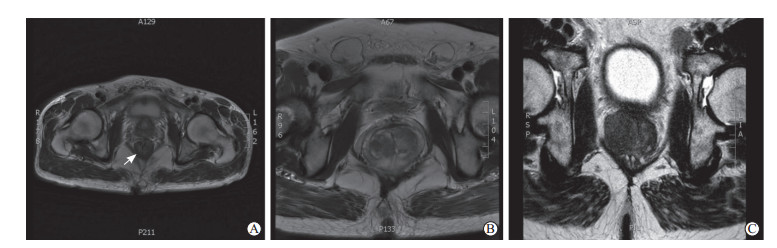
2 结果穿刺前MRI检查结果(图 2)显示,患者1前列腺增生、移行带信号异常;患者2前列腺增生,右侧中央带、外周带、移行带信号异常,考虑恶性肿瘤累及精囊可能。根据前列腺MRI检查结果对患者1在靶区穿刺取得3条前列腺组织,随后又系统性穿刺取得15条前列腺组织;对患者2仅在靶区穿刺取得6条前列腺组织。
|
图 2 患者的mpMRI图像 A:同济大学附属东方医院1例前列腺增生患者的mpMRI图像,可见前列腺与直肠位置关系(箭头所示为直肠);B,C:分别为患者1和患者2的T2加权像. mpMRI:多参数磁共振成像. |
2例患者均在15 min内完成MRI与CT融合引导下前列腺穿刺,术后除轻微血尿外未见其他并发症,术后即刻便可下床自由活动。患者1靶向穿刺与系统性穿刺所取得的18条前列腺组织均未见肿瘤组织;患者2靶向穿刺的6条前列腺组织中,有5条病理提示前列腺腺癌,格利森评分为3+4。
3 讨论当前对血清PSA异常升高的APR后患者行前列腺穿刺活检的方法主要有超声引导、CT引导和MRI引导3种方式。自1989年TRUS被首次报道[16]以来,超声引导下前列腺穿刺在临床上得到了广泛应用,并逐渐成为前列腺癌诊断的常规手段。但超声图像的清晰度较低,对前列腺及其周围组织的显影质量一般[2]。目前超声引导下前列腺穿刺的阳性检出率较低,发生血尿、尿潴留等并发症的风险较大[3]。有文献指出经尿道超声能够提高前列腺超声图像的清晰度,提高穿刺阳性检出率[4]。但经尿道超声的侵入感强、患者接受度低,且前列腺影像相对局限,难以提供前列腺的整体影像。
CT引导下前列腺穿刺是目前APR后患者可疑前列腺癌筛查的另一种可靠方法。与超声相比,CT图像更为清晰,能够为穿刺提供更准确的定位。除此之外,CT可清楚地显示盆腔内组织器官的解剖结构关系,有利于避免穿刺过程中损伤膀胱、血管等重要器官结构。但是CT对于前列腺内部病灶的显影不尽如人意,只有当病变严重到使前列腺发生形变时,CT才能清楚地显示出前列腺内部的病灶[6]。CT检查也不可避免地给患者带来更大的辐射,有文献指出如果能在图像质量上稍作妥协、减少对脏器的反复扫描,可以减少CT的辐射剂量[7],但是CT图像质量与穿刺阳性检出率之间的权衡还有待进一步研究。
MRI引导下穿刺是当前前列腺穿刺的另一种选择,与超声和CT相比,MRI在前列腺癌诊断上有巨大的优势,能够发现超声与CT检查无法显示的微小病变。得益于此,利用MRI引导前列腺穿刺不仅能进行更精准的靶向穿刺,还能对高度可疑的前列腺癌进行初步分期[11]。但是MRI较为高昂的费用及操作的不便极大地限制了其在前列腺穿刺技术中的发展和推广。当前,单独应用MRI引导前列腺穿刺较少见,更多的是MRI与超声[12]或CT[13-14]的融合穿刺,通过2种甚至多种影像学手段的融合互补对病灶区域进行靶向穿刺,可提高穿刺的准确性及成功率。
本研究中2例患者行MRI与CT融合引导下经会阴前列腺穿刺技术均取得成功。患者的mpMRI能够清楚地显示前列腺周围及腺体内部的组织结构,可较为容易地识别出患者前列腺的可疑病灶,有助于操作者在穿刺时有的放矢,从而针对可疑病灶靶向穿刺以提高穿刺阳性检出率,避免了多次穿刺给患者带来的损伤。APR后患者肛门和直肠均已被切除,这种解剖结构的缺失势必会导致盆腔内脏器及重要血管、神经的位置发生改变。与超声相比,CT可提供前列腺周围包括盆腔内的整体图像,最大程度帮助穿刺医师避开穿刺路径上的重要结构,减小穿刺并发症的发生风险。对于APR后患者,目前主要有经会阴与经臀大肌2种入路的前列腺穿刺,其中经会阴入路穿刺距离短,路径中重要的血管、神经少,且可对前列腺的各个层面尤其是前列腺尖部进行穿刺[8]。因此本研究采用的是经会阴入路前列腺穿刺。
本研究探索了MRI融合CT引导下经会阴前列腺靶向穿刺技术在APR后患者中的应用,并初步验证了其可行性。2例APR后患者的穿刺病理结果截然不同:患者2的6针靶向穿刺组织活检中有5针提示前列腺腺癌,阳性率达83.3%;而患者1在3针靶向穿刺后额外进行了15针系统性穿刺,仍未发现肿瘤组织。这种差异或许在2例患者穿刺前血清PSA数值的巨大差距上已有预示。也有文献指出MRI融合技术能够增强对高级别前列腺癌的诊断能力,而对低级别前列腺癌的诊断能力较低[12]。对这种穿刺方式进行更准确地评价需要更大的样本量及更多的数据。同时这种认知融合的穿刺技术难度较大,对术者的空间想象能力及临床经验有着较高的要求。如能构建一种前列腺穿刺模型,利用模型对前列腺整体定位,亦或是通过人工智能手段指导穿刺,将有可能降低穿刺难度。
| [1] |
PERRY W B, CONNAUGHTON J C. Abdominoperineal resection: how is it done and what are the results?[J]. Clin Colon Rectal Surg, 2007, 20: 213-220. DOI:10.1055/s-2007-984865 |
| [2] |
FORNAGE B D, DINNEY C P, TRONCOSO P. Ultrasound-guided transperineal needle biopsy of the prostate after abdominoperineal resection[J]. J Clin Ultrasound, 1995, 23: 263-265. DOI:10.1002/jcu.1870230411 |
| [3] |
徐耀宗, 顾晓, 王飞, 丁雪飞. Miles术后患者前列腺穿刺临床术式初步探讨[J]. 临床泌尿外科杂志, 2019, 34: 977-979. |
| [4] |
SEAMAN E K, SAWCZUK I S, FATAL M, OLSSON C A, SHABSIGH R. Transperineal prostate needle biopsy guided by transurethral ultrasound in patients without a rectum[J]. Urology, 1996, 47: 353-355. DOI:10.1016/S0090-4295(99)80452-X |
| [5] |
GOENKA A H, REMER E M, VENIERO J C, THUPILI C R, KLEIN E A. CT-guided transgluteal biopsy for systematic random sampling of the prostate in patients without rectal access[J]. AJR Am J Roentgenol, 2015, 205: 578-583. DOI:10.2214/AJR.14.14129 |
| [6] |
KRAUSS D J, CLARK K G, NSOULI I S, AMIN R M, KELLY C M, MORTEK M A. Prostate biopsy in patients after proctectomy[J]. J Urol, 1993, 149: 604-606. DOI:10.1016/S0022-5347(17)36162-1 |
| [7] |
OLSON M C, ATWELL T D, MYNDERSE L A, KING B F, WELCH T, GOENKA A H. CT-guided transgluteal biopsy for systematic sampling of the prostate in patients without rectal access: a 13-year single-center experience[J]. Eur Radiol, 2017, 27: 3326-3332. DOI:10.1007/s00330-016-4694-7 |
| [8] |
MERRICK G S, KURKO B, SCHOLL W, BUTLER W M, ADAMOVICH E. CT-planned transperineal prostate biopsy in patients without a rectum[J/OL]. Urol Case Rep, 2020, 33: 101409. DOI: 10.1016/j.eucr.2020.101409.
|
| [9] |
KIRSCH A J, COAKLEY F V, FOSTER B R. A modified approach for transgluteal prostate biopsy in patients without rectal access[J/OL]. AJR Am J Roentgenol, 2016, 207: W20. DOI: 10.2214/AJR.16.16113.
|
| [10] |
CANTWELL C P, HAHN P F, GERVAIS D A, MUELLER P R. Prostate biopsy after ano-rectal resection: value of CT-guided trans-gluteal biopsy[J]. Eur Radiol, 2008, 18: 738-742. DOI:10.1007/s00330-007-0828-2 |
| [11] |
SABIR S, CHOI H, WARD J, AHRAR K, MCRAE S E. Transgluteal MR-guided prostate biopsy: results of a freehand technique in a closed 1.5t MRI[J/OL]. J Vasc Interv Radiol, 2013, 24: S176-S177. DOI: 10.1016/j.jvir.2013.01.447.
|
| [12] |
SIDDIQUI M M, RAIS-BAHRAMI S, TURKBEY B, GEORGE A K, ROTHWAX J, SHAKIR N, et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer[J]. JAMA, 2015, 313: 390-397. DOI:10.1001/jama.2014.17942 |
| [13] |
CAGLIC I, BREZNIK S, MATELA J, BARRETT T. Lesion targeted CT-guided transgluteal prostate biopsy in combination with prebiopsy MRI in patients without rectal access[J]. Urol Case Rep, 2017, 10: 6-8. DOI:10.1016/j.eucr.2016.09.008 |
| [14] |
HANSEN N L, CAGLIC I, BERMAN L H, KASTNER C, DOBLE A, BARRETT T. Multiparametric prostate magnetic resonance imaging and cognitively targeted transperineal biopsy in patients with previous abdominoperineal resection and suspicion of prostate cancer[J]. Urology, 2016, 96: 8-14. DOI:10.1016/j.urology.2016.04.037 |
| [15] |
WANG H F, CHEN R, HE B M, QU M, WANG Y, LIN H Z, et al. Initial experience with a novel method for cognitive transperineal magnetic resonance imaging-targeted prostate biopsy[J]. Asian J Androl, 2020, 22: 432-436. DOI:10.4103/aja.aja_83_19 |
| [16] |
HODGE K K, MCNEAL J E, TERRIS M K, STAMEY T A. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate[J]. J Urol, 1989, 142: 71-75. DOI:10.1016/S0022-5347(17)38664-0 |
 2022, Vol. 43
2022, Vol. 43


