心肌肥厚和心力衰竭模型是动物实验中常用的模型,相较于大动物,用小鼠来制备该模型有繁殖成本低、转基因和基因敲除品系多等优势。目前广泛使用的主动脉弓缩窄(transverse aortic constriction,TAC)引起的心肌肥厚和心力衰竭模型最早是由Rockman等[1]报道。虽然不同小鼠品系对TAC引起的左心室重构反应不同,但这种模型的最大优点是能快速引起左心室肥厚[2-6]。TAC引起的血压升高2周内就会使左心室重量增加约50%,所以该模型在制备后较短时间内就可用于左心室肥厚相关研究[3]。
在小鼠中进行TAC手术制备心室肥厚和心力衰竭比其他的方法需要更多的外科知识和手术技巧[2]。大多数操作者通过给动物气管插管和呼吸机通气来进行TAC手术[2, 7],费力且耗时,还增加了动物的手术负担。已有研究人员初步使用了微创TAC手术,但仅简述了其手术操作过程[8-9]。本文中我们总结了自己的操作经验,详细介绍了无呼吸机支持下微创TAC手术的完整操作过程及注意事项,供科研人员参考。
1 材料和方法 1.1 实验动物40只雄性C57BL/6小鼠(2~4个月龄,体重20~30 g)购自上海市计划生育科学研究所实验动物经营部(动物合格证号20180006032483)。将小鼠随机分为假手术组和TAC手术组,每组20只,饲养于海军军医大学(第二军医大学)基础医学院病理生理学教研室SPF级动物饲养室,小鼠每天予12 h光照,以普通饲料喂养,自由取食、饮水。本研究获得海军军医大学(第二军医大学)动物伦理委员会审批,遵守使用和爱护实验室动物的规范操作。
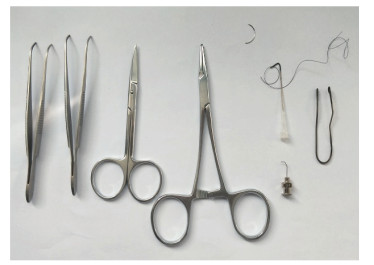
1.2 手术器械直眼科剪、弯眼科镊、持针器、自制穿线弯钩(家用普通缝针末端用火烧红后用持针器弯成70°,针的尖端插入20 μL移液器枪头)、自制开胸器(直径1.5 mm细钢丝弯曲呈U型,两端用火烧红后用持针器弯成直径4 mm的小圆圈)、27号针及缝皮针,见图 1。
|
图 1 TAC手术操作所需的器械 Fig 1 Instruments for TAC TAC: Transverse aortic constriction. |
1.3 TAC手术操作步骤
(1)麻醉和固定:小鼠称重后按10 μL/g腹腔注射0.3%戊巴比妥钠溶液进行麻醉,用医用胶布将小鼠四肢固定于手术台。手术器械在使用前均经高温或75%乙醇浸泡消毒。
(2)备皮和消毒:小鼠颈部和胸部皮肤涂抹脱毛膏,2~3 min后用棉签涂抹脱去毛发,局部皮肤碘伏消毒。
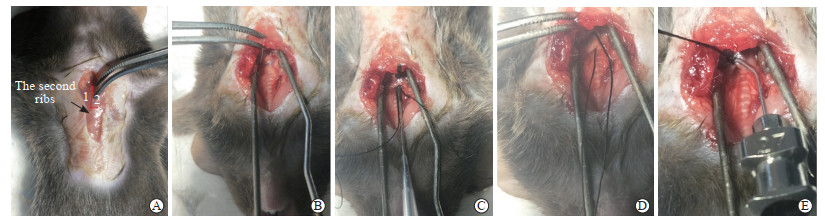
(3)开胸:用直眼科剪在小鼠颈部和胸部中线位置纵向切开皮肤,用弯眼科镊钝性分离结缔组织和气管中线两侧肌肉。用镊子夹一侧胸锁乳突肌,按照图 2A所标注的位置和方向剪开胸骨。第一剪从胸骨上窝开始,至胸骨右侧第二肋上缘结束。第二剪在第二肋上缘横断肋骨。在这个过程中,虽然胸壁从胸骨切开,但胸腔及胸内压负压环境完好,因此不需要使用呼吸机进行正压通气。
|
图 2 小鼠TAC手术操作过程 Fig 2 Procedure of TAC in mice A: Schematic diagram of the position of the first and second scissors during thoracotomy. 1 and 2 indicate the position of the first cut and the second cut during thoracotomy, respectively. B: The arch of the aorta was exposed by restricting the thymus with a homemade chest expander. C: Threading a line under the arch of the aorta with a homemade threading hook. D: Place a thread under the aortic arch and prepare for ligation. E: The silk suture is tied over the 27-gauge needle and the aortic arch. |
(4)暴露主动脉弓:开胸后可见白色胸腺组织和纵隔脂肪,用镊子将胸腺中间轻柔撕开后用自制的开胸器将胸腺组织固定于左右两侧,暴露主动脉弓(图 2B)。此时需注意不要损伤壁胸膜,以免发生气胸。
(5)穿线:在识别主动脉弓后,将穿有缝线的自制穿线弯钩垂直从气管边缘、无名动脉和左颈动脉之间的主动脉弓下方缓慢穿入(图 2C),待进入2 mm左右时将钩子以主动脉弓为圆心向小鼠的头端旋转90°后缓慢穿出,用镊子提住线头后将弯钩从主动脉弓下方缓慢回抽,完成穿线(图 2D)。
(6)结扎:将钝的弯曲成90°的27号针放在主动脉弓旁边,用2个弯镊将缝线在位于右无名动脉和左颈总动脉之间的主动脉弓上打结(图 2E)。结扎后,轻柔地取出27号针,以实现0.4 mm直径的狭窄和65%~70%的主动脉横向缩窄。主动脉弓狭窄成功后可观察到右颈总动脉搏动增强。
(7)检查:如观察到主动脉弓周围、胸骨边缘和气管前肌肉的软组织部位有渗血情况,则用棉花或纱布进行止血。
(8)缝合:用穿有缝线的显微外科针从左第二肋间隙的外侧穿到内侧,然后从右第二肋间隙的内侧穿到外侧后结扎,操作过程中避免损伤肋间和胸内血管或胸膜。此后用缝线缝合皮肤。假手术组除了不结扎主动脉弓之外,其余操作过程同TAC组。
(9)用碘伏消毒创口后将小鼠转移到单独的笼子里俯卧位放置,小鼠恢复清醒后2~3只归于一笼。术后1~3 d,每天每只皮下注射青霉素50 000 U进行抗感染。
1.4 心脏超声检测心功能术后第28天采用异氟烷吸入法麻醉小鼠并将其固定于恒温板上,前胸脱毛后涂抹超声耦合剂,使用30 MHz超声探头在左心室乳头肌水平切面位置选取短轴方向用M型超声诊断仪(意大利百胜集团Esaote MyLabTwice)检测两组小鼠的心脏收缩功能。超声心动图连续记录5个完整心动周期图像并测量5个心动周期的平均数值作为检测值。心脏收缩功能检测指标包括左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fraction shortening,LVFS)。
1.5 qPCR检测心房钠尿肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide, BNP)mRNA表达假手术和TAC手术组小鼠术后4周以0.3%戊巴比妥钠溶液(10 μL/g)进行麻醉后开胸取心脏,提取心脏组织总RNA并反转录成cDNA,进行qPCR扩增,反应体系为SYBR® Green PCR预混液5 μL,上、下游引物共0.25 μL,cDNA模板1.5 μL,ddH2O 3.25 μL,总体积为10 μL。以β-肌动蛋白为内参,采用2-ΔΔCt法进行分析。所用引物序列如下:ANP正义引物为5'-TCACCCTGGGCTTCTTCCTCGTCT-3',反义引物为5'-TGCGGCCCCTGCTTCCTCA-3';BNP正义引物为5'-CCTGGCCCATCGCTTCTGC-3',反义引物为5'-CTGGGCCATTTCCTCCGACTTT-3';β-肌动蛋白正义引物为5'-CCCTAAGGCCAAC-CGTGAAAAGAT-3',反义引物为5'-ACCGCTCG-TTGCCAATAGTGATGA-3'。
1.6 统计学处理采用GraphPad Prism 8软件进行统计学分析。符合正态分布的计量资料以x±s表示,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果围手术期小鼠存活率为95.00%(38/40),假手术组和TAC手术组各死亡1只。术后第28天,TAC手术组小鼠心脏明显变大,心脏重量/体重比高于假手术组[(6.21±0.20)mg/g vs(3.94±0.19)mg/g,P<0.01],且心肌肥大标志基因ANP和BNP表达水平均高于假手术组(3.48±0.37 vs 1.00±0.12、3.92±0.41 vs 1.00±0.15,P均<0.01),反映心脏收缩功能的指标LVEF和LVFS均低于假手术组[(40.18±1.96)% vs(53.26±2.32)%、(23.12±2.08)% vs(32.16±2.64)%,P均<0.01]。说明该技术可有效引起心肌肥厚和心功能降低。
3 讨论TAC手术后,小鼠一般在1~2周内开始出现心脏肥大,这取决于压力超负荷的程度和实验小鼠的遗传背景[10]。本文以图文的方式详细描述了一种简化的、不需要使用呼吸机且重复性好的小鼠微创TAC技术,该实验方法相较于传统使用呼吸机的方法有以下优势:(1)不需要使用小动物呼吸机,只需要用基本的手术器械即可开展;传统使用呼吸机的方法需要进行盲插气管插管,操作不当时容易损伤气道或误将插管插入食道。(2)本方法不存在因呼吸机参数设置不当造成小鼠呼吸功能不全的问题。(3)本方法操作简便,熟练的操作者可以在20 min内完成TAC手术。
在进行小鼠TAC手术过程中需注意以下几个细节: (1)在无呼吸机支持下,麻醉不宜过深,以小鼠反应减弱但是强刺激肢端有反应为宜。(2)皮肤切口不需太长,1~1.5 cm即可。(3)剪胸骨时,第一剪适当偏向右侧,不要沿着胸骨正中线剪,随后第二剪在第二肋上缘横断胸骨柄。横断前需先辨认第二肋,肉眼能清晰看到的头端第一对白色肋骨为第二肋。这样有利于暴露视野且胸壁出血少,也不会造成气胸。第二剪不要越过第二肋,否则很容易导致气胸。(4)开胸后将胸腺左右两叶分开,并用开胸器将胸腺撑开固定在两侧,充分暴露主动脉弓。在分离胸腺时动作应轻柔,避免用力牵拉损伤胸膜。如果意外损坏胸膜,改变内部负压,肺就会塌陷,动物会立即死亡。(5)在主动脉弓下方穿线时不宜过深,否则容易刺穿肺动脉或胸膜,造成大出血或气胸。(6)主动脉弓结扎力度不宜太大,以能顺利抽出27号垫扎针为宜,否则结扎时易将主动脉撕裂或垫扎针抽出时撕破主动脉弓。(7)动物术后恢复意识之前应有实验人员看管,在动物清醒之前不要与其他动物同笼,以免因踩踏造成胸部伤口出血。(8)术后进行抗感染及容易获得的食物和饮水对小鼠术后的恢复也至关重要。
总之,本方法有2个最大的优势,一是无呼吸机模式下减少了与气道相关的严重并发症的发生,如气管插管导致的喉头水肿窒息;二是创伤小,动物术后恢复快,围手术期死亡率低,且手术技术初学者易于掌握,是一种理想的模拟人类压力超负荷诱导心肌肥厚病理生理过程的动物模型。
| [1] |
ROCKMAN H A, ROSS R S, HARRIS A N, KNOWLTON K U, STEINHELPER M E, FIELD L J, et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy[J]. PNAS, 1991, 88: 8277-8281. DOI:10.1073/pnas.88.18.8277 |
| [2] |
TARNAVSKI O. Mouse surgical models in cardiovascular research[J]. Methods Mol Biol, 2009, 573: 115-137. |
| [3] |
PATTEN R D, HALL-PORTER M R. Small animal models of heart failure: development of novel therapies, past and present[J]. Circ Heart Fail, 2009, 2: 138-144. DOI:10.1161/CIRCHEARTFAILURE.108.839761 |
| [4] |
BARRICK C J, ROJAS M, SCHOONHOVEN R, SMYTH S S, THREADGILL D W. Cardiac response to pressure overload in 129S1/SvImJ and C57BL/6J mice: temporal-and background-dependent development of concentric left ventricular hypertrophy[J]. Am J Physiol Heart Circ Physiol, 2007, 292: H2119-H2130. DOI:10.1152/ajpheart.00816.2006 |
| [5] |
DESCHEPPER C F, OLSON J L, OTIS M, GALLO-PAYET N. Characterization of blood pressure and morphological traits in cardiovascular-related organs in 13 different inbred mouse strains[J]. J Appl Physiol (1985), 2004, 97: 369-376. DOI:10.1152/japplphysiol.00073.2004 |
| [6] |
SONG S, LIU L, YU Y, ZHANG R, LI Y G, CAO W, et al. Inhibition of BRD4 attenuates transverse aortic constriction-and TGF-β-induced endothelial-mesenchymal transition and cardiac fibrosis[J]. J Mol Cell Cardiol, 2019, 127: 83-96. DOI:10.1016/j.yjmcc.2018.12.002 |
| [7] |
DE ALMEIDA A C, VAN OORT R J, WEHRENS X H T. Transverse aortic constriction in mice[J/OL]. J Vis Exp, 2010(38): 1729. DOI: 10.3791/1729.
|
| [8] |
HU P, ZHANG D F, SWENSON L, CHAKRABARTI G, ABEL E D, LITWIN S E. Minimally invasive aortic banding in mice: effects of altered cardiomyocyte insulin signaling during pressure overload[J]. Am J Physiol Heart Circ Physiol, 2003, 285: H1261-H1269. DOI:10.1152/ajpheart.00108.2003 |
| [9] |
EICHHORN L, WEISHEIT C K, GESTRICH C, PEUKERT K, DUERR G D, AYUB M A, et al. A closed-chest model to induce transverse aortic constriction in mice[J/OL]. J Vis Exp, 2018(134): 57397. DOI: 10.3791/57397.
|
| [10] |
TANNU S, ALLOCCO J, YARDE M, WONG P, MA X Y. Experimental model of congestive heart failure induced by transverse aortic constriction in BALB/c mice[J/OL]. J Pharmacol Toxicol Methods, 2020, 106: 106935. DOI: 10.1016/j.vascn.2020.106935.
|
 2022, Vol. 43
2022, Vol. 43


