患者男,43岁,因“反复乏力22年,体重下降4年,纳差1年”于2019年9月2日收入我院内分泌科。患者1997年曾因乏力测空腹血糖为10.2 mmol/L,无口干、多饮、多尿,外院给予口服二甲双胍治疗数月,患者自行停药且未监测血糖。2009年患者出现头晕症状至外院查空腹血糖为15~16 mmol/L,予精蛋白锌重组人胰岛素混合注射液早餐前18 IU及晚餐前20 IU注射,自诉血糖控制可,治疗10 d后出院,出院后不规律使用胰岛素,血糖控制差,未规律就诊。患者自2015年起出现体重下降,每年下降5~7 kg。2018年出现纳差症状,无恶心、呕吐、腹泻、黑便等不适,至我科住院,予强化胰岛素治疗1周,总量达68 IU,并联合格列齐特、阿卡波糖、西格列汀治疗,血糖控制可,出院后自行停用睡前胰岛素及中餐前速效胰岛素。2019年8月出现足部溃疡,自行予莫匹罗星软膏治疗。2019年8月26日再次出现纳差、乏力,偶有视物模糊、泡沫尿。家族史:患者母亲、外婆、大姨、舅舅均有糖尿病病史,父亲尿毒症透析中,哥哥体健。出生史:足月顺产,出生时体重5 kg。
入院后体格检查:血压122/78 mmHg(1 mmHg=0.133 kPa),身高166 cm,体重34 kg,BMI 12 kg/m2,神志清楚,拒绝交流,全身皮下脂肪消失,肌肉萎缩,发量正常,眉毛稀疏,颊部凹陷,颧骨凸出,门牙外凸伴有外切牙脱落,面部及腿部可见色素沉着,颈部及足背部可见过度角质化,足趾关节处可见溃疡瘢痕(图 1)。外生殖器呈幼稚型,无阴毛分布。辅助检查:血常规、肝肾功能、甲状腺功能及促肾上腺皮质激素释放激素、皮质醇未见异常,随机血糖19.5 mmol/L,糖化血红蛋白为11%。甘油三酯3.36 mmol/L,胆固醇5.27 mmol/L,高密度脂蛋白1.03 mmol/L,低密度脂蛋白3.36 mmol/L。尿微量白蛋白/肌酐比值为0.549。睾酮<0.1 μg/L,卵泡刺激素39.44 IU/L,黄体生成素11.69 IU/L,泌乳素10.12 IU/L。腹部超声检查示脂肪肝、右肾结石。四肢及颈部血管超声检查示双侧颈动脉内膜毛糙,内中膜增厚伴双侧斑块形成,双侧颈内动脉血流阻力增高。胸部X线片检查未见异常。胰岛素释放实验显示空腹血糖11 mmol/L,空腹C肽3.98 μg/L,空腹胰岛素23.3 mIU/L;1 h血糖23 mmol/L,1 h C肽3.86 μg/L,1 h胰岛素18.3 mIU/L;2 h血糖24.6 mmol/L,2 h C肽4.26 μg/L,2 h胰岛素18 mIU/L。基因测序发现DNA聚合酶δ1催化亚单位(DNA polymerase δ1 catalytic subunit,POLD1)基因突变位点chr19:50920507 G > A(p.E1067K)。诊断为下颌骨发育不良-耳聋-早老及脂肪营养不良(mandibular hypoplasia, deafness, progeroid features and lipodystrophy,MDPL)综合征。
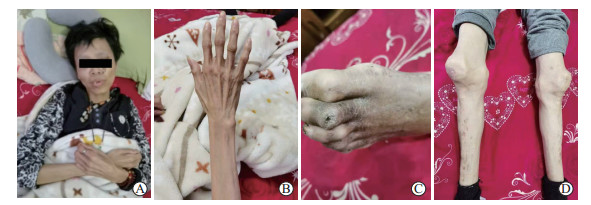
|
图 1 患者体貌特征 A:患者正面照,可见体型消瘦,眉毛稀疏,颊部凹陷,颧骨凸出,门牙外凸伴有外切牙脱落;B: 上肢脂肪萎缩;C:足背部过度角质化,足趾关节处可见溃疡结痂;D:双下肢色素沉着,肌肉、脂肪萎缩. |
以早、中、晚3餐前分别给予18、16、14 IU赖脯胰岛素联合地特胰岛素20 IU强化治疗,血糖逐渐下降后减少胰岛素总量至47 IU/d,加用吡格列酮二甲双胍片(每日2次,每次1片),同时予睾酮补充雄性激素,醋酸钙及骨化三醇补钙、促进钙吸收。考虑患者纳差,与营养科会诊后建议胃管鼻饲营养支持,患者及家属拒绝,建议少量多餐进食。经过胰岛素联合口服药物降糖、补充激素、补钙等处理后病情平稳,于2019年9月14日出院。
2 讨论患者虽以糖尿病就诊,但有特殊临床表现:(1)早老面容、鸟样嘴、全身脂肪萎缩。(2)胰岛素使用日剂量达到68 IU,即每日按体重2 IU/kg的剂量,提示有胰岛素抵抗。(3)存在脂肪肝、高甘油三酯、血管斑块等血脂代谢障碍。(4)性腺功能减退。综上所述,患者所患糖尿病可能是一类综合征中的一个疾病,建议进行基因检测,测序结果发现POLD1及肝细胞核因子1β(hepatocyte nuclear factor 1β,HNF1β)错义突变,通过孟德尔遗传数据库(http://www.ncbi.nlm.nih.gov/omim/)搜索这2个基因突变导致的疾病,对照患者临床表现,最终认为是由POLD1基因突变导致的MDPL综合征。该病是脂肪萎缩症的一种罕见类型,属于常染色体显性遗传[1],但目前所报道的病例均为新生突变,且因性腺功能减退,所有患者皆无后代。它的致病基因为19号染色体q13上的POLD1杂合突变[2-4],该基因编码DNA聚合酶δ的分子量为125 000的催化亚单位[5-6]。DNA聚合酶既具有聚合酶活性,又具有外切酶活性,在DNA复制和修复中起着关键作用[7]。该突变最初是通过外显子组测序发现并通过Sanger测序在2例患者中得到证实[4],但在任何父母或几个大型对照数据库中均未发现[2, 4],这也与上述提到的新生突变相符。在大肠埃希菌中进行的体外功能性表达研究表明[2],该突变型酶丧失了其DNA聚合酶的能力,而其核酸外切酶活性(尽管与野生型相比降低)仍然存在。这项研究表明该突变蛋白可以结合DNA,但不能与dNTP相互作用和掺入。无法催化聚合可能导致细胞衰老和死亡的增加。大部分报道病例为c.1812 _1814delCTC突变[2],本例患者为chr19:50920507 G > A(p.E1067K)突变,查找文献,其中有1例患者也为错义突变(p.R507C)[2]。另外Ajluni等[8]也在部分性脂肪营养不良人群中检测到POLD1(NM002691·3: c.3199 G > A;p.E1067K)突变。
MDPL综合征特征性临床表现为下颌骨发育不良、感应性耳聋、早老样面容、脂肪萎缩、性腺功能减退等,随着脂肪萎缩程度的增加,糖尿病、高脂血症、胰岛素抵抗等内分泌紊乱相关疾病相继出现。Shastry等[4]最先在下颌骨肢端发育不良(mandibuloacral dysplasia,MAD)患者中观察到部分患者具有不同于MAD的临床特征,包括性腺功能减退、感音性听力减退,并且这些患者也未检测出MAD的疾病基因核纤层蛋白(lamin A/C,LMNA)及锌金属蛋白酶STE24(zinc metallopeptidase STE24,ZMPSTE24)。Shastry等[4]将这类患者诊断为MDPL综合征。随后Weedon等[2]报道了4例没有血缘关系的MDPL综合征患者,这些患者虽然出生时体重正常,但后期均出现特征性的皮下脂肪缺失。MRI也证实皮下脂肪明显减少,内脏脂肪组织明显增加。尽管BMI较低,但所有受影响的个体都有胰岛素抵抗的临床和生化证据,这些都与皮下脂肪萎缩、甘油三酯堆积于内脏有关。患者面部特征包括下颌发育不全和牙齿过度拥挤,而且所有人的嗓音都很高。其他常见的临床特征包括皮肤硬皮病和毛细血管扩张、韧带挛缩、骨质疏松、脊柱后凸/侧凸畸形、肢体肌肉减少、男性性腺功能减退和睾丸萎缩、感音神经性耳聋。4例中有1例患者的皮下腹部脂肪组织显示出丰富的纤维化,但未见炎性细胞浸润。本例患者不仅缺少皮下脂肪、存在胰岛素抵抗,还有牙齿脱落、性腺功能低下。但下颌骨并未见明显发育不良。因患者拒绝交流及外出检查,未进行听力测试,家属代诉偶需大声对话。
MDPL综合征需与核纤层蛋白病、Werner综合征鉴别。核纤层蛋白病属于核膜疾病,是一组表型复杂、异质性很强的症候群,共有下颌骨肢端发育不良、早老症、非典型Werner综合征等共8种临床分型[9],临床表现包括早老、肢端发育不良、脂肪萎缩、胰岛素抵抗、骨质疏松、扩张型心肌病、皮肤硬化、早发肿瘤等,致病基因为LMNA,根据特征性临床表现及基因测序可明确诊断。Werner综合征又称成人早衰,是一种罕见的常染色体隐性遗传性疾病,主要致病基因为Werner解旋酶(WRN RecQ like helicase,WRN)[10-11],该病患者具有与MDPL综合征患者相似的外貌,包括老人面容、体型消瘦、过度角质化或硬皮病等。Werner综合征易合并肿瘤,也可以有性腺功能减退[12-13]。因此MDPL综合征很难与Werner综合征鉴别,两者的鉴别诊断主要依靠基因测序。
MDPL综合征的治疗主要针对已经出现的疾病进行治疗,患者可能会因特殊外貌产生自卑、自暴自弃的心理。本例患者住院期间虽然血糖控制理想,但情绪低落,拒绝交流、拒绝外出检查,依从性差。出院后电话随访家属代诉并未按时注射胰岛素,且饮食不规律,随机血糖均在20 mmol/L左右,其他口服药物亦停用。鉴于此种情况,MDPL综合征不仅需要对症治疗,还应该注意采取心理干预。
| [1] |
PELOSINI C, MARTINELLI S, CECCARINI G, MAGNO S, BARONE I, BASOLO A, et al. Identification of a novel mutation in the polymerase delta 1 (POLD1) gene in a lipodystrophic patient affected by mandibular hypoplasia, deafness, progeroid features (MDPL) syndrome[J]. Metabolism, 2014, 63: 1385-1389. DOI:10.1016/j.metabol.2014.07.010 |
| [2] |
WEEDON M N, ELLARD S, PRINDLE M J, CASWELL R, ALLEN H L, ORAM R, et al. An in-frame deletion at the polymerase active site of POLD1 causes a multisystem disorder with lipodystrophy[J]. Nat Genet, 2013, 45: 947-950. DOI:10.1038/ng.2670 |
| [3] |
REINIER F, ZOLEDZIEWSKA M, HANNA D, SMITH J D, VALENTINI M, ZARA I, et al. Mandibular hypoplasia, deafness, progeroid features and lipodystrophy (MDPL) syndrome in the context of inherited lipodystrophies[J]. Metabolism, 2015, 64: 1530-1540. DOI:10.1016/j.metabol.2015.07.022 |
| [4] |
SHASTRY S, SIMHA V, GODBOLE K, SBRACCIA P, MELANCON S, YAJNIK C S, et al. A novel syndrome of mandibular hypoplasia, deafness, and progeroid features associated with lipodystrophy, undescended testes, and male hypogonadism[J/OL]. J Clin Endocrinol Metab, 2010, 95: E192-E197. DOI: 10.1210/jc.2010-0419.
|
| [5] |
NICOLAS E, GOLEMIS E A, ARORA S. POLD1: Central mediator of DNA replication and repair, and implication in cancer and other pathologies[J]. Gene, 2016, 590: 128-141. DOI:10.1016/j.gene.2016.06.031 |
| [6] |
UCHIMURA A, HIDAKA Y, HIRABAYASHI T, HIRABAYASHI M, YAGI T. DNA polymerase delta is required for early mammalian embryogenesis[J/OL]. PLoS One, 2009, 4: e4184. DOI: 10.1371/journal.pone.0004184.
|
| [7] |
CHUNG D W, ZHANG J A, TAN C K, DAVIE E W, SO A G, DOWNEY K M. Primary structure of the catalytic subunit of human DNA polymerase delta and chromosomal location of the gene[J]. Proc Natl Acad Sci USA, 1991, 88: 11197-11201. DOI:10.1073/pnas.88.24.11197 |
| [8] |
AJLUNI N, MERAL R, NEIDERT A H, BRADY G F, BURAS E, MCKENNA B, et al. Spectrum of disease associated with partial lipodystrophy: lessons from a trial cohort[J]. Clin Endocrinol, 2017, 86: 698-707. DOI:10.1111/cen.13311 |
| [9] |
CAPELL B C, COLLINS F S. Human laminopathies: nuclei gone genetically awry[J]. Nat Rev Genet, 2006, 7: 940-952. DOI:10.1038/nrg1906 |
| [10] |
GOTO M, RUBENSTEIN M, WEBER J, WOODS K, DRAYNA D. Genetic linkage of Werner's syndrome to five markers on chromosome 8[J]. Nature, 1992, 355: 735-738. DOI:10.1038/355735a0 |
| [11] |
YU C E, OSHIMA J, FU Y H, WIJSMAN E M, HISAMA F, ALISCH R, et al. Positional cloning of the Werner's syndrome gene[J]. Science, 1996, 272: 258-262. DOI:10.1126/science.272.5259.258 |
| [12] |
MUFTUOGLU M, OSHIMA J, VON KOBBE C, CHENG W H, LEISTRITZ D F, BOHR V A. The clinical characteristics of Werner syndrome: molecular and biochemical diagnosis[J]. Hum Genet, 2008, 124: 369-377. DOI:10.1007/s00439-008-0562-0 |
| [13] |
TAKEMOTO M, MORI S, KUZUYA M, YOSHIMOTO S, SHIMAMOTO A, IGARASHI M, et al. Diagnostic criteria for Werner syndrome based on Japanese nationwide epidemiological survey[J]. Geriatr Gerontol Int, 2013, 13: 475-481. DOI:10.1111/j.1447-0594.2012.00913.x |
 2022, Vol. 43
2022, Vol. 43


