慈丹胶囊由莪术、牛黄、黄芪、山慈菇、蜂房、丹参、马钱子、鸦胆子、僵蚕、当归、冰片等中药组成,具有消肿止痛、补中益气、散结化瘀等功效[1],临床常用于原发性肝癌的辅助治疗,适用于原发性肝癌瘀毒蕴结证,联合介入化疗可提高病灶缓解率。研究证实,慈丹胶囊可使原发性肝癌患者症状改善、免疫力提高、生存期延长[2]。慈丹胶囊所含中药种类繁多,化学成分复杂,目前其抗肝癌的有效成分及相应的作用机制尚不清楚。
网络药理学是研究多靶点干预疾病网络以期达到理想药效的理论,基于网络药理学的分析方法特别适合复杂生物系统的相互作用研究,为中药作用机制提供了一个全新的视角和解决方案[3]。本研究通过检索中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)及相关文献收集慈丹胶囊活性成分,并在此基础上利用药物靶点分析平台(Search Tool for Interactions of Chemicals,STITCH)预测慈丹胶囊可能的作用靶点,采用Cytoscape软件构建慈丹胶囊抗肝癌作用的活性成分-作用靶点网络,对这些靶点进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析,利用注视、可视化和集成发现数据库(Database for Annovation, Visualization, and Integrated Discovery; DAVID)进行基因功能和信号通路分析,探讨慈丹胶囊抗肝癌作用的可能机制。
1 材料和方法 1.1 慈丹胶囊中活性成分的筛选通过检索TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)及相关文献,分别收集慈丹胶囊中莪术、牛黄、黄芪、山慈菇、蜂房、冰片、丹参、马钱子、鸦胆子、僵蚕、当归的主要化学成分,建立慈丹胶囊化学成分数据库。在此基础上筛选慈丹胶囊中有效的活性成分,即口服生物利用度(oral bioavailability,OB)>30%、药物相似性(drug-likeness,DL)>0.18[4]且相关文献中报道化合物含量及相关生物功能的化学成分。
1.2 活性成分潜在作用靶点的预测通过STITCH(http://stitch.embl.de)进行分析,将活性成分输入,选择人类物种进行搜索。将搜索得到的靶点结果以TSV格式进行保存,筛选其中结合得分>0.7的靶点。通过与GeneCards数据库(http://www.genecards.org/)和在线人类孟德尔遗传数据系统(Online Mendelian Inheritance in Man,OMIM; https://omim.org/)中肝细胞癌有关的基因进行比对,获得与肝细胞癌相关的靶点。
1.3 慈丹胶囊活性成分-作用靶点网络的构建根据慈丹胶囊中主要有效成分预测与肝细胞癌相关的靶点,建立活性成分与靶点之间的相互对应关系。将活性成分和作用靶点作为网络中的节点,以两者之间的相互作用作为网络中的连接,导入Cytoscape 3.8.2软件构建慈丹胶囊活性成分-作用靶点网络。
1.4 PPI网络的构建将慈丹胶囊与肝细胞癌相关的靶点导入String数据库(http://string-bd.org),获取蛋白质间的相互作用关系,将结果保存成TSV格式,保留文件中的节点1、节点2和结合得分信息并导入Cytoscape 3.8.2软件,绘制相关作用网络并进行分析,保存结果。设置节点的大小和颜色反映节点度值的大小、边的粗细反映结合得分的大小,获得慈丹胶囊作用靶点PPI网络图。
1.5 基因功能和信号通路分析将慈丹胶囊与肝细胞癌相关的靶点导入DAVID(https://david.ncifcrf.gov),选择标识符为标准的基因名称,列表类型设置为基因列表,限定物种为人,进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。使用Cytoscape3.8.2软件对慈丹胶囊中活性成分作用靶点进行基因本体(Gene Ontology,GO)富集分析。
2 结果 2.1 慈丹胶囊中活性成分的筛选通过TCMSP从丹参、当归、黄芪、莪术、鸦胆子、马钱子、冰片、牛黄、山慈菇中分别收集到202、125、87、81、67、62、31、19、18个主要的化学成分。以OB>30%、DL>0.18及相关文献报道作为筛选标准,得到活性成分24个,其中丹参7个(黄芩苷、谷甾醇、隐丹参酮、异欧前胡素、木犀草素、丹参新酮、丹参酮ⅡA)、黄芪6个(桦木酸、毛蕊异黄酮、芒柄花黄素、异鼠李素、山柰酚、槲皮素)、鸦胆子3个(谷甾醇、鸦胆子苦醇、木犀草素)、当归2个(豆甾醇、谷甾醇)、牛黄2个(胆固醇、脱氧胆酸)、山慈菇2个(豆甾醇、谷甾醇)、马钱子1个(豆甾醇)、冰片1个(积雪草酸),删除重复者后共获得18个活性成分。
2.2 慈丹胶囊潜在靶点的预测通过STITCH筛选共得到100个蛋白靶点,通过与GeneCards数据库和OMIM中肝细胞癌有关的基因进行比对,共筛选出97个可能与肝细胞癌相关的作用靶点。其中与肝细胞癌相关性得分>20分并且经文献证实的靶点有20个,分别为表皮生长因子受体(epidermal growth factor receptor,EGFR)、caspase(CASP)8、AKT1、G1/S特异性细胞周期蛋白D1(G1/S-specific cyclin D1,CCND1)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、Myc原癌基因蛋白(Myc proto-oncogene protein,MYC)、信号转导及转录激活因子(signal transducer and activator of transcription,STAT)3、基质金属蛋白酶(matrix metalloproteinase,MMP)9、含有杆状病毒IAP重复序列的蛋白5(baculoviral IAP repeat-containing protein 5,BIRC5)、MMP2、NFE2样BZIP转录因子2(NFE2 like BZIP transcription factor 2,NFE2L2)、CASP3、TNF、Jun原癌基因AP-1转录因子亚基(Jun proto-oncogene,AP-1 transcription factor subunit; JUN)、CASP9、细胞色素P450(cytochrome P450,CYP)1A1、ATP结合盒亚家族B成员11(ATP binding cassette subfamily Bmember 11,ABCB11)、MAPK8、MAPK3、IL-10。
2.3 慈丹胶囊活性成分-作用靶点网络分析由图 1可知木犀草素、异鼠李素、桦木酸可共同作用于靶点AKT1,脱氧胆酸、谷甾醇可共同作用于靶点ABCB11,芒柄花黄素、异鼠李素、槲皮素可共同作用于靶点CYP1A1,黄芩苷、谷甾醇、木犀草素、桦木酸、芒柄花黄素可共同作用于CASP3,毛蕊异黄酮、芒柄花黄素可共同作用于尿苷二磷酸葡萄糖醛酸基转移酶1A1(uridine diphosphate-glucuronosyltransferase 1A1,UGT1A1),木犀草素、异鼠李素可共同作用于MAPK8,而谷甾醇可同时作用于固醇调节元件结合转录因子(sterol regulatory element binding transcription factor,SREBF)2、三磷酸腺苷结合盒亚家族G(ATP-binding cassette G-subfamily,ABCG)8、ABCG5、载脂蛋白E(apolipoprotein E,APOE)、24-脱氢胆固醇还原酶(24-dehydrocholesterol reductase,DHCR24)、CASP3、SREBF1、ABCB11、细胞间黏附分子1(intercellular cell adhesion molecule 1,ICAM1)、胆固醇7α-羟化酶(cholesterol 7α- hydroxylase,CYP7A)。同一靶点可对应不同的活性成分,不同靶点也可对应相同的活性成分,表明慈丹胶囊具有多成分、多靶点的作用特点。
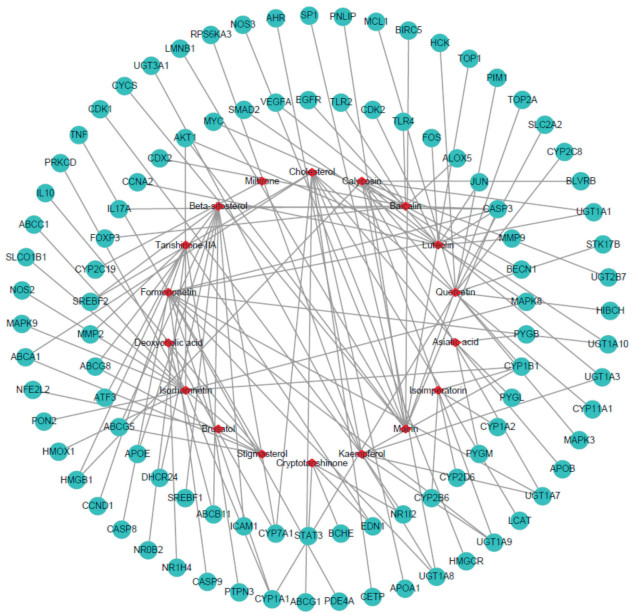
|
图 1 慈丹胶囊的主要活性成分-作用靶点网络图 Fig 1 Component-target network of Cidan capsule The red diamond is the main active components of Cidan capsule, and the cyan rotundity is the potential anti-hepatocellular carcinoma targets of Cidan capsule. |
2.4 慈丹胶囊主要活性成分潜在作用靶点PPI网络分析
将慈丹胶囊主要活性成分的肝细胞癌相关靶点导入String数据库获取蛋白质间的相互作用关系,构建的PPI网络共涉及88个节点和467条边(图 2)。网络分析结果显示,度值排名靠前的有JUN、STAT3、TNF、AKT1、CASP3、MAPK3、EGFR、MYC、CCND1、细胞癌基因FOS、Toll样受体(Toll-like receptor 4,TLR4)、VEGFA、MMP9、MAPK8、转录因子SP1、CYP1A1、CYP1A2、IL-10、CYP2B6、载脂蛋白B-100(apolipoprotein B-100,APOB),度值分别为33、33、30、28、25、25、22、22、18、18、18、17、17、15、15、15、15、14、14、13,提示这些靶点在网络调控中起着关键作用,很可能是慈丹胶囊治疗肝癌的关键靶点。
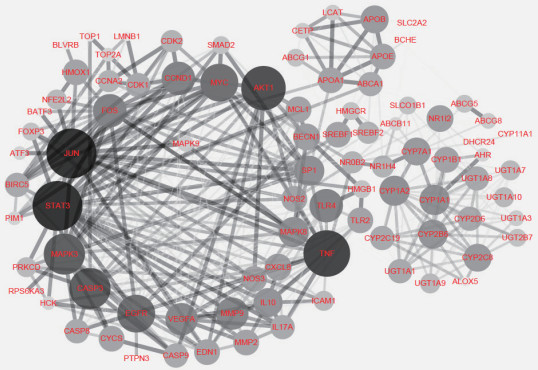
|
图 2 慈丹胶囊主要活性成分潜在作用靶点的蛋白质-蛋白质相互作用网络 Fig 2 Protein-protein interaction network of potential targets of main active components of Cidan capsule The size and the color of the node represent the value of the degree, and the thickness of the side indicates the value of the combined score. |
2.5 慈丹胶囊主要活性成分肝细胞癌相关靶点基因功能和信号通路分析
GO富集分析结果显示,生物学过程中靶点数目排名靠前的依次有细胞过程、生物调控、代谢过程、对化学刺激的反应、大分子代谢过程的调控、对应激的反应、基因表达调控、小分子代谢过程、大分子生物合成过程的调控、信号通路、信号传输、脂质代谢过程、信号转导、转录调控、氮化合物代谢过程的正向调控等,细胞组分中靶点数目排名靠前的依次是细胞内部分、细胞器、细胞内膜界类细胞器、细胞质、细胞内细胞器部分、膜、核、细胞器腔、膜封闭腔、细胞核部分、细胞器膜、内质网、膜部分、不溶性组分、内膜系统等,分子功能中靶点数目排名靠前的依次是蛋白结合、催化活性、蛋白质二聚化活性、酶结合、同源蛋白质结合、转移酶活性、核苷酸结合、过度金属离子结合、DNA结合、腺嘌呤核苷结合、嘌呤核苷结合、核苷结合、嘌呤核苷酸结合、蛋白质异二聚化活性、转录调节活性等。
KEGG通路分析结果显示,靶点数目排名靠前的是TNF、PI3K-AKT、MAPK等信号通路(图 3)。
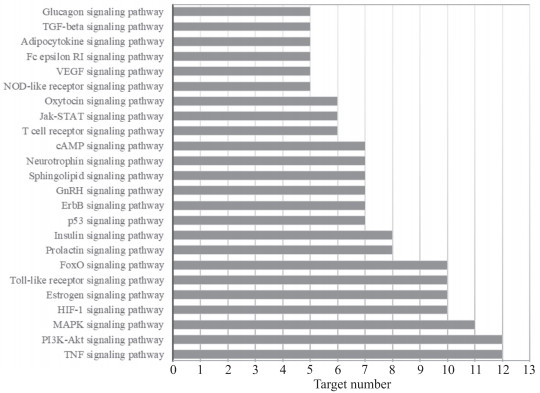
|
图 3 慈丹胶囊主要活性成分潜在作用靶点KEGG通路富集分析结果 Fig 3 KEGG pathway enrichment analysis of potential targets of main active components of Cidan capsule KEGG: Kyoto Encyclopedia of Genes and Genomes; TGF: Transforming growth factor; VEGF: Vascular endothelial growth factor; NOD: Nucleotide-binding oligomerization domain; STAT: Signal transducer and activator of transcription; cAMP: Cyclic adenosine monophosphate; GnRH: Gonadotropin-releasing hormone; FoxO: Forkhead box O; HIF: Hypoxia-inducible factor; MAPK: Mitogen-activated protein kinase; PI3K: Phosphatidylinositol 3-kinase; Akt: Protein kinase B; TNF: Tumor necrosis factor. |
3 讨论
本研究通过检索TCMSP数据库及相关参考文献共筛选出慈丹胶囊中18种主要的活性成分。隐丹参酮是丹参中的二萜类成分,它可激活CASP级联反应诱导卵巢癌细胞凋亡[5]。黄芪可通过调控肝纤维化大鼠肝脏中MAPK信号通路上下游相关蛋白的表达抑制纤维化因子的表达,从而抑制肝纤维化[6]。以毛蕊异黄酮和芒柄花黄素为主的黄芪提取物可通过PI3K-AKT信号通路抑制乳腺癌细胞的增殖[7]。鸦胆子提取物可通过抑制miRNA-95的表达诱导肝癌细胞凋亡[8]。当归补血汤加味能明显改善肝纤维化患者的肝功能、抑制肝胶原纤维合成,从而阻止肝纤维化发展至肝硬化[9]。牛黄中的熊去氧胆酸能促进正常大鼠胆汁中胆红素、总胆汁酸的分泌[10],降低胆汁中胆固醇的含量,并降低血清中胆红素、总胆汁酸、胆固醇水平[11],有利于胆结石患者的胆固醇结石逐渐溶解。山慈菇含药血清能明显抑制肝癌细胞的生长、诱导凋亡,抑制其上皮间质转化[12]。马钱子碱对结肠癌细胞HT-29活性有较强的抑制作用[13]。
本研究结果表明慈丹胶囊活性成分可作用于100个蛋白靶点,其中97个作用靶点可能与肝细胞癌相关,活性成分-作用靶点网络显示慈丹胶囊具有多成分、多靶点的抗肝癌作用特点。PPI网络显示慈丹胶囊靶蛋白间存在着相互作用,是复杂交互的网络,并不是单独起作用。靶点的GO分析结果表明,慈丹胶囊的抗肝癌作用涉及细胞过程、生物调控、代谢过程、对化学刺激的反应等生物学过程,细胞内部分、细胞器、细胞内膜界类细胞器、细胞质等细胞组分,以及蛋白质结合、催化活性、蛋白质二聚化活性、酶结合等分子功能,是一个复杂的过程。KEGG通路分析分析结果显示,慈丹胶囊抗肝癌的靶点主要涉及TNF、PI3K-AKT、MAPK等信号通路。
慈丹胶囊活性成分与肝细胞癌相关的靶点中,PPI网络分析结果度值排名前20、与肝细胞癌的相关性得分>20分并且有文献证实条件的基因共有14个,分别为JUN、STAT3、TNF、AKT1、CASP3、MAPK3、EGFR、MYC、CCND1、VEGFA、MMP9、MAPK8、CYP1A1、IL-10,慈丹胶囊可能主要通过作用于以上靶点实现其抗肝癌作用。CASP3在细胞凋亡的执行阶段起着核心作用。匹伐他汀可依赖于人肝细胞癌细胞中的CASP3通路诱导癌细胞凋亡[14]。EGFR是一种细胞表面蛋白,它可与表皮生长因子结合诱导受体二聚化和酪氨酸自磷酸化,从而促进细胞增殖。EGFR的扩增和突变已被证明是许多类型癌症的驱动因素。在肝癌患者中EGFR与肿瘤的大小和组织分化相关,是肝癌预后的危险因素[15]。CCND1属于高度保守的细胞周期蛋白家族。细胞增殖的调控事件主要发生在细胞周期的G1期,G1期细胞周期蛋白的异常表达与肿瘤发生有关。有研究者分析了CCND1异常表达在肝细胞癌中的作用,发现在肝细胞癌后期CCND1表达下调[16]。MYC是一种多功能的核磷蛋白,在细胞周期进程、细胞凋亡和细胞转化中发挥作用。有研究检测肝细胞癌和正常肝细胞中的p21ras、c-MYC和p53,发现这些蛋白质参与了人类肝癌的发生[17]。VEGFA是血小板源性生长因子/血管内皮生长因子家族的成员。血管生成对于实体瘤的发展和进展至关重要。研究发现,VEGFA是参与肝细胞癌血管生成的重要因素之一,甚至可能参与了肝细胞癌本身的发生和进展[18]。MMP2与MMP9是MMP家族的成员,该家族成员参与正常生理及疾病过程中细胞外基质的分解。研究发现,MMP1和MMP2过表达与肿瘤去分化相关,表明MMP与肝细胞癌的侵袭密切相关[19]。CYP家族成员可催化涉及药物代谢及胆固醇、类固醇和其他脂质合成的许多反应,研究发现肝细胞癌中CYP1A1蛋白表达下调[20]。STAT能与DNA结合,参与细胞增殖、分化、迁移和凋亡,研究发现STAT的过度表达可能是肝细胞癌的一个重要特征[21]。JUN是一种与病毒蛋白高度相似的蛋白质,可直接与特定的靶DNA序列相互作用以调节基因表达。研究发现,肝细胞癌肿瘤组织中c-Jun、JunD和AP-1的表达比邻近非肿瘤组织升高[22]。IL-10是一种细胞因子,主要由单核细胞产生,在免疫调节和炎症反应中具有多效性。研究表明,IL-1、IL-6、IL-10、IL-17、IL-22、IL-35和IL-37通过调节细胞信号通路参与多种肝脏疾病的进展[23]。
慈丹胶囊筛选得到的蛋白靶点富集的通路中,PI3K-AKT信号通路在调节细胞存活、胰岛素信号、血管生成和肿瘤形成中起关键作用。研究发现AKT1的减少可诱导肝细胞癌细胞凋亡[24],还发现PI3K-AKT信号通路在阿帕替尼发挥放射增敏治疗肝细胞癌中发挥关键作用[25]。TNF信号通路参与多种生物学过程的调节,包括细胞增殖、分化、凋亡,以及脂质代谢与凝血过程。研究显示TNF的遗传变异与HBV的清除有关[26]。lncRNA SPRY4-IT1可通过介导TNF信号通路促进肝细胞癌细胞的增殖和迁移[27]。MAPK信号通路参与调节细胞增殖、分化和细胞周期进程等。研究发现,MAPK3活性在P-糖蛋白介导的多重耐药肝癌细胞中下调,同时MAPK3可能是规避多重耐药肝癌细胞的潜在药物靶点[28]。Linc00601通过激活MAPK信号通路促进肝细胞癌发展[29]。慈丹胶囊活性成分可能通过作用于以上靶点及信号通路,实现其抗肝癌作用。
综上所述,网络药理学分析显示慈丹胶囊的18种活性成分作用于97个与肝细胞癌相关的蛋白靶点,其中与肝细胞癌关系密切的蛋白靶点有14个,慈丹胶囊可能通过这些靶点的相互作用及TNF、PI3K-AKT、MAPK等信号通路改善肝癌患者的症状,实现其抗肝癌作用。慈丹胶囊对肝癌的作用机制涉及多个生物学过程、分子和通路,体现了慈丹胶囊多成分、多靶点、多途径的作用特点。
| [1] |
张红英. 10种抗肿瘤中成药的应用[J]. 保健文汇, 2021, 22: 21. |
| [2] |
谭栋, 郑康, 梁刚, 韩朝, 李启亮, 沈乃营, 等. 慈丹胶囊联合mFOLFOX6方案治疗Bismuth-Corlette Ⅱ型肝门部胆管癌的临床研究[J]. 现代药物与临床, 2019, 34: 1084-1089. |
| [3] |
庄延双, 蔡宝昌, 张自力. 网络药理学在中药研究中的应用进展[J]. 南京中医药大学学报, 2021, 37: 156-160. |
| [4] |
汝锦龙. 中药系统药理学数据库和分析平台的构建和应用[D]. 杨凌: 西北农林科技大学, 2015.
|
| [5] |
JIANG G, LIU J, REN B, ZHANG L, OWUSU L, LIU L, et al. Anti-tumor and chemosensitization effects of cryptotanshinone extracted from Salvia miltiorrhiza Bge. on ovarian cancer cells in vitro[J]. J Ethnopharmacol, 2017, 205: 33-40. DOI:10.1016/j.jep.2017.04.026 |
| [6] |
雷玲, 闵珺, 刘锋, 肖秀清, 杜凡. 黄芪对肝纤维化大鼠肝损伤保护作用及机制研究[J]. 陕西中医, 2020, 41: 1192-1196. DOI:10.3969/j.issn.1000-7369.2020.09.004 |
| [7] |
ZHOU R, CHEN H, CHEN J, CHEN X, WEN Y, XU L. Extract from Astragalus membranaceus inhibit breast cancer cells proliferation via PI3K/AKT/mTOR signaling pathway[J/OL]. BMC Complement Altern Med, 2018, 18: 83. DOI: 10.1186/s12906-018-2148-2.
|
| [8] |
XIAO Z, CHING C S, HAN L C, CHUN T S, TSUI S K, LIN Z, et al. Role of microRNA-95 in the anticancer activity of brucein D in hepatocellular carcinoma[J]. Eur J Pharmacol, 2014, 728: 141-150. DOI:10.1016/j.ejphar.2014.02.002 |
| [9] |
王志新, 张志立, 李哲诚, 马义民, 宋胜利, 周超杰, 等. 当归补血汤加味抗肝炎肝纤维化临床研究[J]. 亚太传统医药, 2014, 10: 101-103. |
| [10] |
BEUERS U, BOYER J L, PAUMGARTNER G. Ursodeoxycholic acid in cholestasis: potential mechanisms of action and therapeutic applications[J]. Hepatology, 1998, 28: 1449-1453. DOI:10.1002/hep.510280601 |
| [11] |
薛小平, 李东华, 刘铮, 崔乃强. 活血化瘀中药对清热利胆中药利胆作用的增效研究[J]. 天津中医药, 2006(1): 70-72. DOI:10.3969/j.issn.1672-1519.2006.01.024 |
| [12] |
程清波, 杨艳萍, 王滢, 程文涛, 张晋芬, 张小莉. 山慈菇对肝癌细胞凋亡和上皮间质转化的影响[J]. 中医学报, 2021, 36: 2202-2207. |
| [13] |
孟霜, 冯振宇, 周晓荣, 马小娟, 赵建平. 马钱子生物碱单体化合物的体外抗肿瘤活性[J]. 中华中医药杂志, 2020, 35: 1191-1193. |
| [14] |
王菊勇, 徐振晔. NK-104对人肝癌细胞凋亡及半胱氨酸蛋白酶3活性的影响[J]. 中西医结合学报, 2007, 5: 298-301. |
| [15] |
郭飞宇, 杨军, 熊书名, 朱茂群, 高森, 李建平. 表皮生长因子受体和胸苷酸合成酶在原发性肝癌中的表达和意义[J]. 中华肝脏病杂志, 2018, 26: 666-669. DOI:10.3760/cma.j.issn.1007-3418.2018.09.006 |
| [16] |
PENG S Y, CHOU S P, HSU H C. Association of downregulation of cyclin D1 and of overexpression of cyclin E with p53 mutation, high tumor grade and poor prognosis in hepatocellular carcinoma[J]. J Hepatol, 1998, 29: 281-289. DOI:10.1016/S0168-8278(98)80014-7 |
| [17] |
PANNAIN V L, BOTTINO A C, SANTOS R T, COELHO H S, RIBEIRO-FILHO J, ALVES V A. [Immunohistochemical detection of p21ras, c-myc and p53 oncoproteins in hepatocellular carcinoma and in non-neoplastic liver tissue][J]. Arq Gastroenterol, 2004, 41: 225-228. DOI:10.1590/S0004-28032004000400005 |
| [18] |
MIURA H, MIYAZAKI T, KURODA M, OKA T, MACHINAMI R, KODAMA T, et al. Increased expression of vascular endothelial growth factor in human hepatocellular carcinoma[J]. J Hepatol, 1997, 27: 854-861. DOI:10.1016/S0168-8278(97)80323-6 |
| [19] |
OGATA R, TORIMURA T, KIN M, UENO T, TATEISHI Y, KUROMATSU R, et al. Increased expression of membrane type 1 matrix metalloproteinase and matrix metalloproteinase-2 with tumor dedifferentiation in hepatocellular carcinomas[J]. Hum Pathol, 1999, 30: 443-450. DOI:10.1016/S0046-8177(99)90121-1 |
| [20] |
MCKINNON R A, HALL P D, QUATTROCHI L C, TUKEY R H, MCMANUS M E. Localization of CYP1A1 and CYP1A2 messenger RNA in normal human liver and in hepatocellular carcinoma by in situ hybridization[J]. Hepatology, 1991, 14: 848-856. DOI:10.1002/hep.1840140517 |
| [21] |
张斌, 钟德玝, 王群伟, 苗雄鹰, 戴卫东, 刘春, 等. JAK/STAT信号通路与肝细胞性肝癌的肿瘤进展和预后的相关性研究[J]. 细胞与分子免疫学杂志, 2010, 26: 368-370, 373. |
| [22] |
GUO L, GUO Y, XIAO S, SHI X. Protein kinase p-JNK is correlated with the activation of AP-1 and its associated Jun family proteins in hepatocellular carcinoma[J]. Life Sci, 2005, 77: 1869-1878. DOI:10.1016/j.lfs.2005.03.019 |
| [23] |
ALI A L, NAILWAL N P, DOSHI G M. Emerging role of interleukins for the assessment and treatment of liver diseases[J]. Endocr Metab Immune Disord Drug Targets, 2022, 22: 371-382. DOI:10.2174/1871530321666211124102837 |
| [24] |
SU J M, WANG L Y, LIANG Y L, ZHA X L. Role of cell adhesion signal molecules in hepatocellular carcinoma cell apoptosis[J]. World J Gastroenterol, 2005, 11: 4667-4673. DOI:10.3748/wjg.v11.i30.4667 |
| [25] |
LIAO J, JIN H, LI S, XU L, PENG Z, WEI G, et al. Apatinib potentiates irradiation effect via suppressing PI3K/AKT signaling pathway in hepatocellular carcinoma[J/OL]. J Exp Clin Cancer Res, 2019, 38: 454. DOI: 10.1186/s13046-019-1419-1.
|
| [26] |
DU T, GUO X H, ZHU X L, LI J H, LU L P, GAO J R, et al. Association of TNF-α promoter polymorphisms with the outcomes of hepatitis B virus infection in Chinese Han population[J]. J Viral Hepat, 2006, 13: 618-624. DOI:10.1111/j.1365-2893.2006.00731.x |
| [27] |
MA W, CHEN X, WU X, LI J, MEI C, JING W, et al. Long noncoding RNA SPRY4-IT1 promotes proliferation and metastasis of hepatocellular carcinoma via mediating TNF signaling pathway[J]. J Cell Physiol, 2020, 235: 7849-7862. DOI:10.1002/jcp.29438 |
| [28] |
YAN F, WANG X M, PAN C, MA Q M. Down-regulation of extracellular signal-regulated kinase 1/2 activity in P-glycoprotein-mediated multidrug resistant hepatocellular carcinoma cells[J]. World J Gastroenterol, 2009, 15: 1443-1451. DOI:10.3748/wjg.15.1443 |
| [29] |
WANG Y C, HU B H, ZHANG W W, LI M M, ZHAO X, SUI M H. Linc00601 upregulation promotes hepatocellular carcinoma development by activating MAPK signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2020, 24: 6039-6045. |
 2022, Vol. 43
2022, Vol. 43


