2. 郑州大学第一附属医院转化医学中心类器官实验室,郑州 450052;
3. 海军军医大学(第二军医大学)第三附属医院胆道二科,上海 200438;
4. 海军军医大学(第二军医大学)国家肝癌科学中心,上海 201805
2. Laboratory of Organoids, Translational Medicine Center, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, Henan, China;
3. Department of Biliary Surgery (Ⅱ), The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200438, China;
4. National Center for Liver Cancer, Naval Medical University (Second Military Medical University), Shanghai 201805, China
肝癌是高发病率、高病死率的恶性肿瘤,其最主要的病理类型为肝细胞癌。因早期诊断困难,仅有5%~15%的肝癌患者能进行有效的手术治疗,而相关靶向药物和免疫药物的应用仍存在一系列问题,因此肝癌患者的预后较差,5年生存率不足20%[1-2]。肝癌患者的个体差异、肿瘤内部的异质性和肿瘤细胞的耐药性十分复杂,这给肝癌的临床治疗带来了巨大的挑战。肝癌临床治疗的发展受限于肝癌研究模型的缺乏。目前肝癌研究模型主要为原代细胞或细胞系二维培养模型、人源肿瘤异种移植模型等,然而肝癌细胞系不具备体内肝脏生理环境、相关特异性蛋白表达量较低,而动物模型体内实验周期较长、不便开展大规模的评估和药物筛选,使得这些模型的应用具有较大的局限性[3]。因此,急需可模拟肿瘤组织结构和分子特征的研究模型用于指导肝癌患者的精准治疗。
类器官是指一类具有自我更新能力、能够在体外自发形成三维结构且能够较好地模拟体内器官特征和功能的细胞团[4]。近年来,肿瘤来源类器官的培养取得了不小的进展,前列腺癌[5]、胰腺癌[6]、结直肠癌[7]、乳腺癌[8]、膀胱癌[9]等多种肿瘤来源类器官的构建均有报道。肿瘤类器官能够在体外长时间培养,具有原代肿瘤的结构特征和功能等,为患者的个体化治疗带来了希望。2017年Broutier等[10]成功建立了8例能长期培养的肝癌类器官,以此为基础进行了基因鉴定和药物筛选,提出类器官在肝癌药物筛选中具有广阔的应用前景。2018年Nuciforo等[11]利用肝癌穿刺活检组织成功培养了类器官,扩展了类器官的组织来源。然而,目前肝细胞癌类器官的建立和培养还存在成功率低、数量少、无标准化的培养鉴定流程、不能完整模拟体内微环境等问题,这为肝细胞癌类器官的临床应用带来了挑战[12]。此外,由于人种遗传背景、生活环境和生活方式等不同,中国人和西方人在肝癌致病因素、驱动基因变异谱和发病机制等方面均存在较大差异。目前,我国仍缺乏规模化的肝癌模型资源库,尤其是类器官样本库,这极大地限制了针对中国肝癌患者的研究和精准医学的发展。
肿瘤蛋白p53(tumor protein p53,TP53)基因编码抑癌蛋白p53,约13%~48%的肝细胞癌患者带有TP53突变,TP53突变促进了肿瘤的发生和发展,也与患者的临床分期和预后有着密切关联[13]。erb-b2受体酪氨酸激酶2(erb-b2 receptor tyrosine kinase 2,ERBB2)是一种表皮生长因子受体酪氨酸激酶,参与调控细胞的增殖和分化等,在肝癌的发生和发展中起着重要作用[14]。本研究通过优化类器官培养基,利用我国肝细胞癌患者(伴HBV感染)的肿瘤标本建立了一株同时携带TP53和ERBB2突变的肝细胞癌类器官,使其能够在体外长期培养,为针对伴TP53和ERBB2突变肝细胞癌患者的临床治疗提供良好的体外模型。
1 材料和方法 1.1 组织标本和实验试剂新鲜肝细胞癌组织标本来自海军军医大学(第二军医大学)第三附属医院1例肝细胞癌患者。患者为男性,56岁,经病理确诊为肝细胞癌Ⅲ级、肝癌微血管侵犯程度分级为M2,伴有HBV感染、小结节型肝硬化和慢性胆囊炎。本研究获得海军军医大学(第二军医大学)第三附属医院伦理委员会审批,患者已认真阅读并签署知情同意书。
终止培养基:DMEM高糖培养基(货号L100KJ,上海源培生物科技股份有限公司)中加入1%青霉素-链霉素(货号15140-122,美国Gibco公司)、1×PrimocinTM(货号ant-pm-1,法国InvivoGen公司)、10 μmol/L Y27632(货号S1049,美国Selleck公司)和10% FBS(货号10099-141C,美国Gibco公司)。
肝细胞癌类器官培养基:高级DMEM/F12培养基(货号12634-010,美国Gibco公司)中加入1%青霉素-链霉素、1%谷氨酰胺Ⅰ(货号35050-061,美国Gibco公司)、10 mmol/L羟乙基哌嗪乙硫磺酸(货号15630-080,美国Gibco公司)、1×PrimocinTM、稀释比例为1∶50的B27添加剂(货号17504-044,美国Gibco公司)、1.25 mmol/L N-乙酰-L-半胱氨酸(货号A9165-5G,美国Sigma-Aldrich公司)、50 ng/mL重组鼠表皮生长因子(货号PMG8043,美国Gibco公司)、10 μmol/LY27632、500 nmol/L A8301(货号2939,英国Tocris公司)、100 ng/mL重组人成纤维细胞生长因子10(货号100-26,美国PeproTech公司)、1 ng/mL重组人碱性成纤维细胞生长因子(货号100-18B,美国PeproTech公司)、10 nmol/LForskolin(货号S2449,美国Selleck公司)、25 ng/mL重组人肝细胞生长因子(货号100-39,美国PeproTech公司)、10 mmol/L烟酰胺(货号N0636-100G,美国Sigma-Aldrich公司)、体积分数为5%的Noggin条件培养基(中国科学院上海分院高栋课题组提供)、3 nmol/L地塞米松(货号D4902-25MG,美国Sigma-Aldrich公司)和10 nmol/L重组人(Leu15)-GastrinⅠ(货号05-23-2301,美国Sigma-Aldrich公司)。
细胞角蛋白7(cytokeratin 7,CK7)抗体(货号180234)购自美国ThermoFisher公司,p53抗体(货号bs-2090R)购自美国Bioss antibodies公司,细胞角蛋白8(cytokeratin 8,CK8)抗体(货号ab53280)和磷脂酰肌醇蛋白聚糖3(glypican 3,GPC-3)抗体(货号ab207080)购自英国Abcam公司。羊抗兔IgG(货号ab205718)和羊抗鼠IgG(货号ab6789)购自英国Abcam公司。
1.2 组织处理手术切除肿瘤标本后迅速将其置于冰上,随后分成3份,其中2份分别用于类器官建立、免疫组织化学(immunohistochemistry,IHC)分析,另外1份于-80 ℃冻存备用。
1.3 类器官培养用PBS冲洗肿瘤组织标本2次,剪成大小约1 mm3的组织小块,加入胶原酶消化液(4 mg/mL的胶原酶D消化液;货号11088866001,瑞士Roche公司)于37 ℃消化1~2 h,待无明显小块时用预冷的终止培养基终止消化。将含有细胞的消化液通过孔径为70 μm的滤网,滤液经300×g离心3 min,离心后去除上清,用终止培养基重悬沉淀,重复2次。以预冷的肝细胞癌类器官培养基重悬细胞,将5 000~10 000个细胞与50 μL基质胶(Matrigel;货号356231,美国Corning公司)混合后接种于24孔培养板中。置于37 ℃细胞培养箱中1 h待基质胶凝固后,再加入1 mL肝细胞癌类器官培养基,每隔3~4 d换液1次。培养1~2周后待细胞密度达到80%左右时,用移液枪头反复吹打类器官使细胞分散,然后按照1∶2的比例重新接种进基质胶中进行传代培养。
1.4 H-E和IHC染色分析类器官和肿瘤组织标本用4%多聚甲醛溶液浸泡过夜,随后进行梯度乙醇脱水、石蜡包埋及切片,常规进行H-E染色,在光镜下观察组织和类器官形态。将3 µm厚的切片置于60 ℃烘箱烘烤30 min,脱蜡,用3%过氧化氢甲醇溶液室温孵育20 min,然后置于柠檬酸缓冲液中煮沸进行抗原修复,待冷却后用1%牛血清白蛋白封闭30 min,滴加一抗(CK7、p53、CK8、GPC-3抗体)于4 ℃孵育过夜。加入二抗室温孵育30 min后进行DAB显色。根据IHC染色的强弱和阳性细胞数量将结果分为阴性、弱阳性、中等阳性、强阳性[15]。
1.5 靶向测序与数据分析通过文献检索选取与肝癌相关的565个基因组成基因panel。提取类器官基因组DNA建立文库,使用Illumina NovaSeq 6000 System进行测序。用fastp 0.20.0软件对原始数据进行预处理以便于后续分析。利用SAMtools 1.4软件对数据进行排序和索引,然后用ANNOVAR软件进行注释。
1.6 药物筛选用TrypLE消化液(货号12604-013,美国Gibco公司)将类器官消化成单细胞,计数细胞并稀释成密度为1×105/mL的细胞悬液,在96孔板中每孔加入7 μL细胞悬液,37 ℃孵育1 h后加入varlitinib(表皮生长因子受体/ERBB2特异性抑制剂;货号S2755,美国Selleck公司)、索拉非尼(激酶多靶点抑制剂;货号S7397,美国Selleck公司)、顺铂(货号S1166,美国Selleck公司)或nutlin3(p53激活剂;货号10004372,美国Canman Chemical公司)。5 d后用CellTiter-Glo细胞活性检测试剂盒(货号G9682,美国Promega公司)检测细胞活力。采用GraphPad Prism 7软件计算药物IC50。
1.7 统计学处理采用SPSS 20软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 肝细胞癌类器官的建立原代肝细胞癌细胞接种于基质胶中,用肝细胞癌类器官培养基培养,1周左右基质胶中形成了紧密不光滑的球状结构,与肝癌类器官的形态结构相符(图 1)。当类器官细胞密度长至80%时,按照1∶2的比例进行传代或冻存,该类器官能稳定传代半年以上。类器官在冻存复苏后,其形态没有发生明显改变。
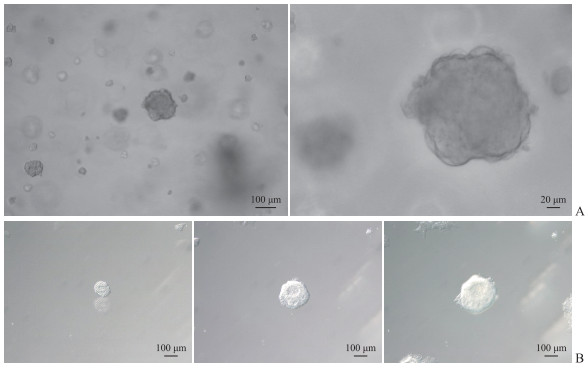
|
图 1 肝细胞癌类器官的培养 Fig 1 Culture of the hepatocellular carcinoma organoid A: The pictures of the organoid under the microscope; B: The pictures of the organoid growth process (from left to right are day 1, day 5, and day 9). |
2.2 肝细胞癌类器官的结构和IHC特征
H-E染色结果(图 2)显示,相较于癌旁正常组织,类器官和原代肿瘤组织中细胞排列结构紊乱,细胞形状不规则,细胞核大、核质比较高,呈现恶性细胞的表型。IHC染色结果(图 2)显示,类器官与肿瘤组织中CK8分别为强阳性和中等阳性,p53均为中等阳性,CK7均为阴性,表明类器官和肿瘤组织具有高度相似的分子标志物表达;肝癌标志物GPC-3在原代肿瘤组织中广泛表达(强阳性),而在类器官中少部分细胞为阳性、大部分细胞为阴性(弱阳性),说明在类器官培养过程中也会丢失少部分特征,这可能与类器官培养还不能完全模拟体内环境、培养过程具有筛选效果等有关。上述结果表明,本研究建立的肝细胞癌类器官保留了原代肿瘤组织的结构特征,与原代肿瘤组织具有高度相似的分子标志物表达。
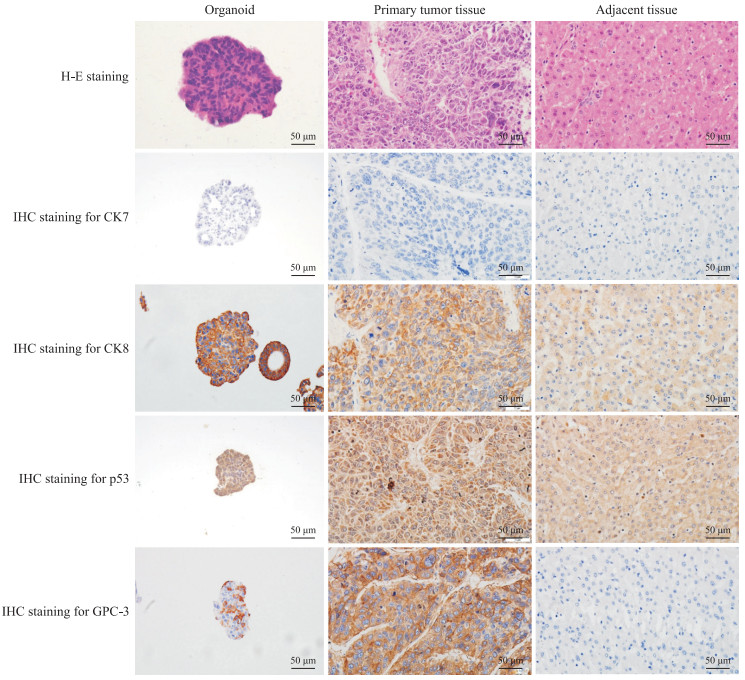
|
图 2 肝细胞癌类器官与原代肿瘤组织的H-E和IHC染色结果 Fig 2 H-E and IHC staining results of the hepatocellular carcinoma organoid and primary tumor tissues H-E: Hematoxylin-eosin; IHC: Immunohistochemistry; CK7: Cytokeratin 7; CK8: Cytokeratin 8; GPC-3: Glypican 3. |
2.3 肝细胞癌类器官的突变基因分析
对565种常见的肿瘤相关基因进行深度靶向测序,结果(表 1)表明肝细胞癌类器官中的突变基因有TP53(E271K,100.00%)、ERBB2(A1232V,62.29%)、RUNX转录因子1(RUNX family transcription factor 1,RUNX1)(E395A,20.21%)和雄激素受体(androgen receptor,AR)(Q91dup,70.00%)。上述结果显示用该肝细胞癌患者的肿瘤标本培养的类器官存在ERBB2突变,这为该患者的个体化治疗用药提供了参考。
|
|
表 1 肝细胞癌类器官靶向测序结果 Tab 1 Targeted sequencing results of the hepatocellular carcinoma organoid |
2.4 肝细胞癌类器官对不同药物的敏感性分析
本研究检测了肝细胞癌类器官对varlitinib(表皮生长因子受体/ERBB2特异性抑制剂)、索拉非尼(多靶点激酶抑制剂)、顺铂和nutlin3(p53激活剂)这4种化合物的敏感性,结果(图 3)显示,varlitinib和索拉非尼对类器官的IC50分别为2.81 μmol/L和1.327 μmol/L,顺铂对类器官的IC50为40.98 μmol/L,而nutlin3干预对细胞的生长无明显抑制作用,这与基因突变的结果是相符的。这些药物筛选结果为该患者的临床治疗提供了重要参考。
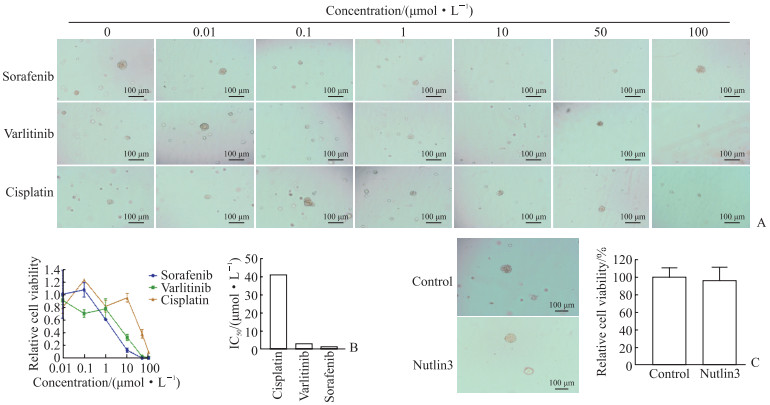
|
图 3
肝细胞癌类器官对4种药物的敏感性
Fig 3
Sensitivity of the hepatocellular carcinoma organoid to 4 drugs
A: Pictures of the hepatocellular carcinoma organoid treated with different concentrations of sorafenib, varlitinib or cisplatin; B: The dose-response curves and half inhibitory concentration (IC50) of sorafenib, varlitinib and cisplatin for the organoid; C: Nutlin3 (10 μmol/L) has no significant effect on the organoid. n=3, x±s. |
3 讨论
类器官技术的发展为肿瘤研究提供了简便、稳定的模型。相较于细胞系,肿瘤组织的结构特性、药物敏感性及基因突变图谱在类器官上均有良好的体现[16]。类器官技术的发展有望为肿瘤精准治疗提供巨大的帮助。我们在类器官培养过程中发现肝细胞癌类器官培养成功率较低,这可能与组织的处理方式、患者的病情阶段、取材部位等有关。建立类器官时通常用胶原酶消化肿瘤组织,本研究也采用此方法,但胶原酶消化时间对细胞活性有着明显影响,消化时间过长不利于类器官的生长,过短则不能让组织充分解离,无法得到足够的细胞。我们发现肝细胞癌肿瘤组织含有较多纤维,消化时间通常需1.5~2 h,这可能是肝细胞癌类器官培养成功率较低的原因之一。近年有研究显示将组织剪碎直接培养能取得良好效果,如Hu等[17]将肺癌组织研磨为40~100 μm的细胞团进行培养,快速建立了肺癌类器官。此方法能否提高肝细胞癌类器官的培养成功率有待进一步研究。
正常细胞的污染是肿瘤类器官培养过程中的一个难题。目前常见的做法是将肿瘤类器官挑出或用nutlin3等抑制正常细胞生长的方式进行筛选,但这可能会对组织细胞的多样性造成破坏。本研究发现nutlin3对携带TP53突变的类器官的细胞活性无明显影响,提示其可用于TP53突变肿瘤类器官的常规培养,但如何提高无TP53突变肿瘤类器官的纯度仍需进一步探索。
本研究成功建立了1例同时携带TP53和ERBB2突变的肝细胞癌类器官,该类器官保留了原代组织的结构和分子特征。TP53是一种抑癌基因,具有激活DNA修复、抑制细胞增殖、诱导细胞凋亡等多种重要功能,超过50%的恶性肿瘤存在TP53基因突变[18]。本例类器官测序结果显示p53蛋白存在错义突变E271K,该突变位点位于核心DNA结合结构域,有可能影响p53蛋白与DNA的结合及其功能,进而促进肝癌的发生、发展。目前有关该突变位点的报道较少,与之相邻的位点R273是TP53最常见的突变位点之一,有报道显示R273C的突变影响了p53蛋白与DNA的结合,具有致瘤性[19]。ERBB2是一种酪氨酸激酶受体,其同源或异源受体二聚化后能够激活下游一系列信号通路,从而促进细胞的生长。在临床上,ERBB2是一个重要的抗肿瘤靶点,其抑制剂显示出了良好的应用前景。在乳腺癌的治疗中,已开发出多种针对ERBB2靶点的药物[20]。本研究中表皮生长因子受体/ERBB2特异性抑制剂varlitinib对类器官有明显的抑制作用,这将为该患者的临床治疗提供重要的参考。然而本研究结果来自1例肝细胞癌类器官,尚缺乏不同患者个体、不同基因背景对相关药物响应的比较。此外,本研究测试的药物种类较少,后续仍需在更多的肝细胞癌类器官中进行大规模的药物敏感性检测,以期探究不同患者类器官对相关药物的敏感性及其机制。
综上所述,本研究成功建立了1例同时携带TP53和ERBB2突变的肝细胞癌类器官,该类器官对多靶点抑制剂索拉非尼和表皮生长因子受体/ERBB2特异性抑制剂varlitinib较敏感,为该患者的临床治疗提供了重要参考,也为TP53和ERBB2突变肿瘤的靶向治疗提供了良好的研究模型。
| [1] |
VILLANUEVA A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380: 1450-1462. DOI:10.1056/NEJMra1713263 |
| [2] |
ZENG H M, CHEN W Q, ZHENG R S, ZHANG S W, JI J S, ZOU X N, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J/OL]. Lancet Glob Health, 2018, 6: e555-e567. DOI: 10.1016/S2214-109X(18)30127-X.
|
| [3] |
PRIOR N, INACIO P, HUCH M. Liver organoids: from basic research to therapeutic applications[J]. Gut, 2019, 68: 2228-2237. DOI:10.1136/gutjnl-2019-319256 |
| [4] |
LANCASTER M A, KNOBLICH J A. Organogenesis in a dish: modeling development and disease using organoid technologies[J/OL]. Science, 2014, 345: 1247125. DOI: 10.1126/science.1247125.
|
| [5] |
GAO D, VELA I, SBONER A, IAQUINTA P J, KARTHAUS W R, GOPALAN A, et al. Organoid cultures derived from patients with advanced prostate cancer[J]. Cell, 2014, 159: 176-187. DOI:10.1016/j.cell.2014.08.016 |
| [6] |
BOJ S F, HWANG C I, BAKER L A, CHIO I I, ENGLE D D, CORBO V, et al. Organoid models of human and mouse ductal pancreatic cancer[J]. Cell, 2015, 160: 324-338. DOI:10.1016/j.cell.2014.12.021 |
| [7] |
VAN DE WETERING M, FRANCIES H E, FRANCIS J M, BOUNOVA G, IORIO F, PRONK A, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients[J]. Cell, 2015, 161: 933-945. DOI:10.1016/j.cell.2015.03.053 |
| [8] |
SACHS N, DE LIGT J, KOPPER O, GOGOLA E, BOUNOVA G, WEEBER F, et al. A living biobank of breast cancer organoids captures disease heterogeneity[J/OL]. Cell, 2018, 172: 373-386. e10. DOI: 10.1016/j.cell.2017.11.010.
|
| [9] |
LEE S H, HU W H, MATULAY J T, SILVA M V, OWCZAREK T B, KIM K, et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer[J/OL]. Cell, 2018, 173: 515-528. e17. DOI: 10.1016/j.cell.2018.03.017.
|
| [10] |
BROUTIER L, MASTROGIOVANNI G, VERSTEGEN M M, FRANCIES H E, GAVARRÓ L M, BRADSHAW C R, et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening[J]. Nat Med, 2017, 23: 1424-1435. DOI:10.1038/nm.4438 |
| [11] |
NUCIFORO S, FOFANA I, MATTER M S, BLUMER T, CALABRESE D, BOLDANOVA T, et al. Organoid models of human liver cancers derived from tumor needle biopsies[J]. Cell Rep, 2018, 24: 1363-1376. DOI:10.1016/j.celrep.2018.07.001 |
| [12] |
YU J H, MA S. Organoids as research models for hepatocellular carcinoma[J/OL]. Exp Cell Res, 2022, 411: 112987. DOI: 10.1016/j.yexcr.2021.112987.
|
| [13] |
KHEMLINA G, IKEDA S, KURZROCK R. The biology of hepatocellular carcinoma: implications for genomic and immune therapies[J/OL]. Mol Cancer, 2017, 16: 149. DOI: 10.1186/s12943-017-0712-x.
|
| [14] |
LIU J, AHIEKPOR A, LI L, LI X X, ARBUTHNOT P, KEW M, et al. Increased expression of ErbB-2 in liver is associated with hepatitis B x antigen and shorter survival in patients with liver cancer[J]. Int J Cancer, 2009, 125: 1894-1901. DOI:10.1002/ijc.24580 |
| [15] |
WEICHERT W, RÖSKE A, GEKELER V, BECKERS T, EBERT M P, PROSS M, et al. Association of patterns of class Ⅰ histone deacetylase expression with patient prognosis in gastric cancer: a retrospective analysis[J]. Lancet Oncol, 2008, 9: 139-148. DOI:10.1016/S1470-2045(08)70004-4 |
| [16] |
VLACHOGIANNIS G, HEDAYAT S, VATSIOU A, JAMIN Y, FERNÁNDEZ-MATEOS J, KHAN K, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers[J]. Science, 2018, 359: 920-926. DOI:10.1126/science.aao2774 |
| [17] |
HU Y W, SUI X Z, SONG F, LI Y Q, LI K Y, CHEN Z Y, et al. Lung cancer organoids analyzed on microwel l arrays predict drug responses of patients within a week[J/OL]. Nat Commun, 2021, 12: 2581. DOI: 10.1038/s41467-021-22676-1.
|
| [18] |
STIEWE T, HARAN T E. How mutations shape p53 interactions with the genome to promote tumorigenesis and drug resistance[J]. Drug Resist Updat, 2018, 38: 27-43. DOI:10.1016/j.drup.2018.05.001 |
| [19] |
MALCIKOVA J, TICHY B, DAMBORSKY J, KABATHOVA J, TRBUSEK M, MAYER J, et al. Analysis of the DNA-binding activity of p53 mutants using functional protein microarrays and its relationship to transcriptional activation[J]. Biol Chem, 2010, 391(2/3): 197-205. |
| [20] |
OH D Y, BANG Y J. HER2-targeted therapies—a role beyond breast cancer[J]. Nat Rev Clin Oncol, 2020, 17: 33-48. DOI:10.1038/s41571-019-0268-3 |
 2022, Vol. 43
2022, Vol. 43


