HBV感染是全球性的公共卫生问题。在我国,约85%的肝细胞癌(hepatocellular carcinoma,HCC)患者有HBV感染史[1]。与未感染人群相比,慢性HBV携带者患HCC的终身风险要高15~25倍[2-3]。HBV-HCC具有起病隐匿、病程进展迅速、缺乏治愈方法等特点,是预后极差的恶性肿瘤之一。乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)是HBV发挥作用的核心功能蛋白,在HBV-HCC的发生、发展中起着重要作用[4]。
miRNA是一类长约19~24 nt的内源非编码单链RNA,广泛存在于动物、植物及各种微生物中。它可以通过完全或不完全匹配的方式识别并结合靶基因的3'-非翻译区(untranslated region,UTR),发挥对靶基因的转录后调控效应,进而参与早期胚胎发育及细胞的生长、分化、凋亡等生命活动[5-6]。miRNA的突变、缺失或表达异常与疾病的发生密切相关,参与了肿瘤的发生、发展、转移、血管生成和耐药[7-8]。研究发现,HBx能够通过调节miRNA影响肝癌细胞的增殖、凋亡、迁移、侵袭、自噬、炎症等多种生物学过程,从而促进HBV-HCC的发展[9-12]。
本课题组前期利用小鼠永生化肝前体细胞构建了能够长期稳定表达HBx且免疫系统正常的小鼠模型,且在360 d的模型小鼠肝脏中发现了癌变组织[13-14]。本研究以miRNA为着眼点,利用肿瘤基因组数据库资料分析肝癌组织中差异表达的miRNA,并选择性检测了miRNA-544-3p在稳定表达HBx的永生化肝前体细胞中和小鼠模型体内的表达情况,进一步通过干扰miRNA-544-3p以探究细胞侵袭、迁移能力的变化和靶向调控机制,为HBV-HCC的治疗提供新的靶点。
1 材料和方法 1.1 细胞株和小鼠小鼠永生化肝前体细胞株14-19由美国芝加哥大学分子肿瘤研究中心惠赠,该细胞株细胞呈集落样生长,体积较小,呈多边形,核质比例高,增殖旺盛,诱导后可分化为成熟的肝细胞,且连续传代50代细胞特性无明显改变[13]。含增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的慢病毒稳转细胞株EGFP-14-19及含HBx和EGFP的慢病毒稳转细胞株HBx-EGFP-14-19由本课题组前期构建并保存[13-14]。
6~8周龄雄性昆明小鼠购于重庆医科大学实验动物中心[动物生产许可证号:SCXK(渝)2018-0003],体重25 g左右,代养于SPF级实验动物饲养室。
1.2 主要试剂DMEM(美国Gibco公司); FBS[赛尔博克斯生物制品(香港)贸易有限公司]; 超纯总RNA提取试剂盒、RNA反转录试剂盒(南京诺唯赞生物科技股份有限公司); SYBR Green qPCR Mix试剂盒(美国Bimake公司); 兔抗小鼠HBx抗体(英国Abcam公司); 兔抗小鼠二磷酸腺苷核糖基化因子6(adenosine diphosphate ribosylation factor 6,Arf6)抗体(上海泊湾生物科技有限公司); 兔抗小鼠Akt抗体、磷酸化Akt(phosphorylated Akt,p-Akt)抗体、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体、磷酸化mTOR(phosphorylated mTOR,p-mTOR)抗体及GAPDH抗体(美国Cell Signaling Technology公司); SDS-PAGE凝胶配制试剂盒、HRP标记的二抗(上海碧云天生物技术有限公司); ECL显影液(成都正能生物技术有限责任公司); EndoFectinTM-Max转染试剂盒(美国GeneCopoeia公司); miRNA-544-3p模拟物(mimic)、抑制剂(inhibitor)、激动剂(agomir)、拮抗剂(antagomir)及各自的阴性对照(negative control,NC)均购自上海吉荧生物技术有限公司。
1.3 细胞培养与转染将冻存于液氮的细胞取出后于37 ℃水浴中快速解冻、离心后弃上清,加入1 mL含10% FBS的DMEM,吹打混匀后均匀滴在无菌培养皿中,在37 ℃、5% CO2条件下培养24 h,待细胞贴壁完全后换液。当细胞融合度达80%时传代,取对数生长期的细胞用于后续实验。
将处于对数生长期的HBx-EGFP-14-19细胞接种于6孔板中,常规培养。待细胞融合度达80%时,更换为无血清培养基同步化12 h,随后分为空白对照组、miRNA-544-3p NC-mimic组、miRNA-544-3p mimic组、miRNA-544-3p NC-inhibitor组、miRNA-544-3p inhibitor组,其中空白对照组不进行转染,其他4组分别进行相应的转染。所有转染均按照EndoFectinTM-Max转染试剂盒说明书进行操作,转染24 h后的细胞即可用于后续实验。
1.4 动物模型构建雄性昆明小鼠45只,随机分为生理盐水组(n=5)、EGFP-14-19组(n=5)和HBx-EGFP-14-19组(n=35)。小鼠术前禁食12 h,腹腔注射2%戊巴比妥钠麻醉后置于超净台中,取仰卧位,腹部经乙醇消毒后在剑突下行2 cm纵向切口,打开腹腔。用湿润棉签掀起肝叶,暴露肝门静脉。按分组情况分别从肝门静脉注入生理盐水(200 μL)、EGFP-14-19或HBx-EGFP-14-19细胞悬液(200 μL,含5×105个细胞,提前消化在PBS中),止血完毕后,关腹缝合。术后小鼠自由饮水进食。
HBx-EGFP-14-19模型组取20只随机分为4个亚组(n=5),分别于造模后30、90、180、360 d腹腔注射2%戊巴比妥钠麻醉,将小鼠置于高浓度一氧化碳环境中处死。取小鼠肝脏储存于-80 ℃冰箱中,用于后续实验。
另取HBx-EGFP-14-19组剩余15只小鼠(于造模后30 d处死)随机分为5个亚组(n=3),于处死前1周经尾静脉分别注射生理盐水、miRNA-544-3p NC-agomir、miRNA-544-3p agomir、miRNA-544-3p NC-antagomir、miRNA-544-3p antagomir。给药1周后腹腔注射2%戊巴比妥钠麻醉小鼠,置于高浓度一氧化碳环境中处死。取小鼠肝脏储存于-80 ℃冰箱中,用于后续实验。
1.5 生物信息学分析利用TargetScan生物信息学网站(https://www.targetscan.org/vert_72/)预测miRNA-544-3p的靶基因。
1.6 qPCR检测miRNA-544-3p和目的基因的表达采用TRIzol法提取细胞和小鼠肝组织中总RNA,按反转录试剂盒说明书的步骤将RNA反转录为cDNA,使用NanoDrop 2000超微量核酸蛋白测定仪(美国ThermoFisher公司)进行RNA浓度和纯度检测。引物设计与合成均由生工生物工程(上海)股份有限公司完成。引物序列:HBx正向引物5'-TGCGGACGACCCTTCTCGGG-3',反向引物5'-GGGCAACATTCGGTGGGCGT-3'; miRNA-544-3p正向引物5'-AGGGGATTCTGCA-TTTTTAGC-3',反向引物5'-GTTGTGGTTGGTT-GTTTGT-3'; Arf6正向引物5'-GTCTGATCTT-CGTGGTAGACTG-3',反向引物5'-CTCATCTCC-CGGTCATTGATAA-3'; U6正向引物5'-AGAGA-AGATTAGCATGGCCCCTG-3',反向引物5'-ATC-CAGTGCAGGGTCCGAGG-3'; GAPDH正向引物5'-CTCGTCCCGTAGACAAAATGGT-3',反向引物5'-GAGGTCAATGAAGGGGTCGTT-3'。按照SYBRGreen qPCR Mix试剂盒说明书进行操作,每个样本设置3个复孔。
1.7 蛋白质印迹法检测目的蛋白的表达分离细胞和小鼠肝组织中总蛋白并煮沸变性,采用BCA蛋白检测试剂盒检测蛋白浓度。每组取30 µg蛋白进行10% SDS-PAGE分离,然后将蛋白转移到PVDF膜上,在脱脂奶粉溶液中封闭2 h后,放入一抗中于4 ℃孵育过夜,再在HRP标记的二抗中室温孵育2 h,加入ECL显影液并在显影仪中观察目的蛋白的表达。采用ImageJ软件进行数据分析,以GAPDH为内参计算目的蛋白的相对表达量。
1.8 免疫组织化学法检测小鼠肝组织中HBx的表达将新鲜肝组织浸泡于4%多聚甲醛中固定,石蜡包埋,切片后按照S-P法进行免疫组织化学染色,光镜下观察并拍照。
1.9 H-E染色观察小鼠肝组织病理学改变取造模后360 d处死的小鼠肝组织,固定、切片,常规进行H-E染色,用中性树脂封片,光镜下观察并拍照。
1.10 划痕愈合实验检测细胞的迁移能力将处于对数生长期的细胞在无血清培养基中培养12 h,用1 000 μL枪头在培养孔中划痕,每孔划3条。用PBS洗涤3次以除去漂浮的细胞。分别于培养0 h和24 h拍照,用ImageJ软件进行数据分析,计算细胞划痕愈合率。细胞划痕愈合率(%)=(A0 h-A24 h)/A0 h×100%,其中A0 h为0 h时的划痕面积,A24 h为培养24 h时的划痕面积。
1.11 Transwell实验检测细胞的迁移和侵袭能力细胞迁移实验:将处于对数生长期的细胞在无血清培养基中培养12 h,分别取2×104个细胞均匀接种于各Transwell小室上室中(含200 μL无血清培养基),下室加入750 μL含20% FBS的培养基。培养24 h后吸去培养基,将小室放入PBS中洗涤2次,用4%多聚甲醛室温固定20 min; 用0.1%结晶紫室温染色30 min,PBS洗涤2次后用棉签轻轻擦去上室内的细胞。在显微镜下观察,随机选取5个视野拍照并计数。
细胞侵袭实验:将基质胶与不含血清的培养基以1∶10的比例稀释,各Transwell小室中均加入70 μL稀释胶,凝固后接种细胞,后续步骤同细胞迁移实验。
1.12 统计学处理采用GraphPad Prism 5.0软件进行统计学分析。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 小鼠永生化肝前体细胞中HBx的表达qPCR检测结果显示,HBx-EGFP-14-19细胞中HBx mRNA相对表达量为11 922.37±2 496.61,高于14-19细胞(相对表达量为0.52±1.17)和EGFP-14-19细胞(相对表达量为0.20±0.95),差异均有统计学意义(P均<0.05)。蛋白质印迹法检测结果显示,只有HBx-EGFP-14-19细胞中有HBx表达(图 1),证明HBx在14-19细胞中表达成功。
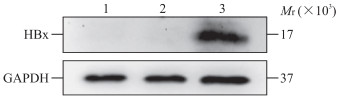
|
图 1 蛋白质印迹法检测永生化肝前体细胞14-19中HBx的表达 Fig 1 Expression of HBx in immortalized liver precursor cells 14-19 detected by Western blotting 1: 14-19 cell; 2: EGFP-14-19 cell; 3: HBx-EGFP-14-19 cell. HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.2 动物模型的鉴定 2.2.1 小鼠肝组织中HBx的表达
qPCR检测结果显示,HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中HBx mRNA相对表达量分别为94.56±43.09、211.66±37.75、176.61±61.44、170.13±97.75,均高于生理盐水组(相对表达量为0.85±0.19)和EGFP-14-19组(相对表达量为0.93±0.25),差异均有统计学意义(P均<0.05)。蛋白质印迹法检测结果显示,HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中均有HBx蛋白表达(图 2)。免疫组织化学染色结果显示,HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中均可见HBx阳性染色(图 3)。上述结果表明本实验建立的小鼠模型能持续、稳定表达HBx。
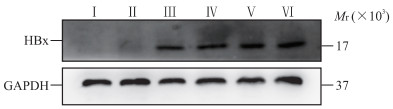
|
图 2 蛋白质印迹法检测小鼠肝组织中HBx的表达 Fig 2 Expression of HBx in mouse liver tissues detected by Western blotting Ⅰ: Normal saline group; Ⅱ: EGFP-14-19 group; Ⅲ-Ⅵ: HBx-EGFP-14-19 groups 30, 90, 180, and 360 d after modeling, respectively. HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
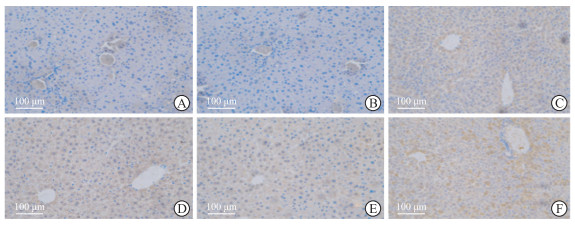
|
图 3 免疫组织化学染色法检测小鼠肝组织中HBx的表达 Fig 3 Expression of HBx in mouse liver tissues detected by immunohistochemical staining A: Normal saline group; B: EGFP-14-19 group; C-F: HBx-EGFP-14-19 groups 30, 90, 180, and 360 d after modeling, respectively. HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein. |
2.2.2 小鼠肝组织肿瘤鉴定
HBx-EGFP-14-19组小鼠造模后360 d处死时,肝组织可见肿瘤生成(图 4A)。H-E染色结果(图 4B)显示肝细胞排列异常,呈多行排列; 有的细胞增大,且核仁偏大,核质分布异常,核仁明显; 有的细胞呈多核,肝组织结构消失。结果表明小鼠肝组织整体呈现坏死状态,病灶处呈纤维化,证明小鼠肝脏发生恶性肿瘤病变。
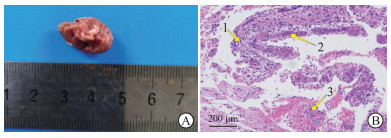
|
图 4 小鼠肝组织肿瘤形成和H-E染色结果 Fig 4 Formation of mouse liver tumor and H-E staining results A: The liver of mice in 360 d HBx-EGFP-14-19 group had tumor formation; B: The results of H-E staining identified the suspected cancerous lesions in the liver of mice in 360 d HBx-EGFP-14-19 group were tumors. Arrow 1: Hepatocytes were arranged abnormally in multiple rows; Arrow 2: The cells were enlarged, and the nucleoli were obvious and too large, and the distribution of nucleoplasm was abnormal; Arrow 3: The cells were multinucleated and the structure of liver tissues disappeared. H-E: Hematoxylin-eosin; HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein. |
2.3 HBx对小鼠永生化肝前体细胞和小鼠肝组织中miRNA-544-3p表达的影响
14-19细胞、EGFP-14-19细胞和HBx-EGFP-14-19细胞miRNA-544-3p相对表达量分别为1.66±0.36、1.29±0.23、0.63±0.11,HBx-EGFP-14-19细胞miRNA-544-3p表达水平较14-19细胞、EGFP-14-19细胞降低(P均<0.05)。生理盐水组、EGFP-14-19组小鼠肝组织中miRNA-544-3p相对表达量分别为1.31±0.31、1.27±0.36,HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中miRNA-544-3p相对表达量分别为0.70±0.12、0.62±0.13、0.72±0.24、0.85±0.24,HBx-EGFP-14-19组小鼠造模后不同时间点肝组织中miRNA-544-3p表达均下调(P均<0.05)。结果表明HBx可在体内外将miRNA-544-3p的表达维持在较低水平。
2.4 HBx对小鼠永生化肝前体细胞和小鼠肝组织中Arf6水平及Akt-mTOR通路的影响TargetScan预测结果显示,Arf6为miRNA-544-3p的靶基因。蛋白质印迹法检测结果显示,14-19细胞、EGFP-14-19细胞、HBx-EGFP-14-19细胞中Arf6蛋白相对表达量分别为1.06±0.05、0.91±0.04、1.88±0.14,HBx-EGFP-14-19细胞中Arf6蛋白表达上调(P均<0.05,图 5A); 生理盐水组、EGFP-14-19组小鼠肝组织中Arf6蛋白相对表达量分别为0.70±0.21、0.70±0.51,HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中Arf6蛋白相对表达量分别为1.09±0.37、1.27±0.69、1.11±0.11、1.10±0.25,HBx-EGFP-14-19组小鼠造模后各时间点肝组织中Arf6表达均上调(P均<0.05,图 5B)。qPCR检测结果显示,HBx-EGFP-14-19细胞中Arf6 mRNA相对表达量(1.02±0.05)高于14-19细胞(0.29±0.26)和EGFP-14-19细胞(0.30±0.30),HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中Arf6 mRNA相对表达量(分别为1.40±0.40、1.55±0.14、1.36±0.29、1.62±0.20)均高于生理盐水组(0.67±0.21)和EGFP-14-19组(0.73±0.11,P均<0.05)。
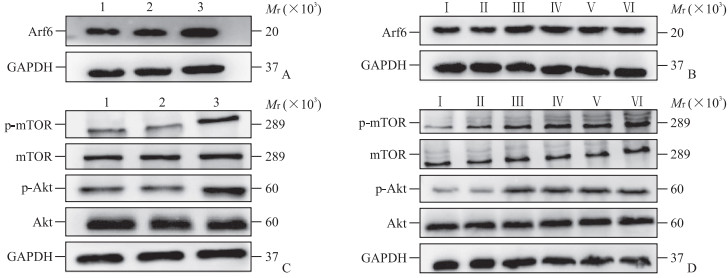
|
图 5 蛋白质印迹法检测各组小鼠永生化肝前体细胞14-19和小鼠肝组织中Arf6、Akt、mTOR的表达 Fig 5 Expression of Arf6, Akt, and mTOR in immortalized liver precursor cells 14-19 and liver tissues of mice in each group detected by Western blotting A: The expression of Arf6 protein in 14-19 cells; B: The expression of Arf6 protein in the liver tissues of mice; C: The expression of Akt and mTOR proteins in 14-19 cells; D: The expression of Akt and mTOR proteins in the liver tissues of mice. 1: 14-19 cell; 2: EGFP-14-19 cell; 3: HBx-EGFP-14-19 cell. Ⅰ: Normal saline group; Ⅱ: EGFP-14-19 group; Ⅲ-Ⅵ: HBx-EGFP-14-19 groups 30, 90, 180, and 360 d after modeling, respectively. Arf6: Adenosine diphosphate ribosylation factor 6; Akt: Protein kinase B; mTOR: Mammalian target of rapamycin; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; p-mTOR: Phosphorylated mammalian target of rapamycin; p-Akt: Phosphorylated protein kinase B; HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein. |
蛋白质印迹法结果显示,HBx-EGFP-14-19细胞中p-Akt蛋白相对表达量(0.86±0.19)高于14-19细胞(0.57±0.31)和EGFP-14-19细胞(0.43±0.37)(P均<0.05),Akt蛋白相对表达量(0.93±0.27)与14-19细胞(0.90±0.28)和EGFP-14-19细胞(0.86±0.26)相比差异均无统计学意义(P均>0.05); HBx-EGFP-14-19细胞中p-mTOR蛋白相对表达量(1.84±0.38)高于14-19细胞(1.00±0.36)和EGFP-14-19细胞(1.10±0.71,P均<0.05),mTOR蛋白相对表达量(1.17±0.26)与14-19细胞(1.19±0.16)和EGFP-14-19细胞(1.10±0.11)相比差异均无统计学意义(P均>0.05,图 5C)。HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中p-Akt蛋白相对表达量(分别为0.60±0.37、0.73±0.50、0.68±0.44、0.82±0.49)均高于生理盐水组(0.24±0.47)和EGFP-14-19组(0.39±0.26,P均<0.05),Akt蛋白相对表达量(分别为0.79±0.43、0.90±0.30、0.69±0.27、0.87±0.38)与生理盐水组(0.79±0.58)和EGFP-14-19组(0.81±0.39)相比差异均无统计学意义(P均>0.05); HBx-EGFP-14-19组小鼠造模后30、90、180、360 d肝组织中p-mTOR蛋白相对表达量(分别为1.93±0.55、2.43±0.75、2.11±0.69、1.90±0.62)均高于生理盐水组(1.25±0.41)和EGFP-14-19组(1.09±0.57,P均<0.05),mTOR蛋白相对表达量(分别为1.81±0.47、1.80±0.56、1.87±0.53、1.91±0.40)与生理盐水组(1.74±0.36)和EGFP-14-19组(1.68±0.54)相比差异均无统计学意义(P均>0.05,图 5D)。
2.5 miRNA-544-3p转染效率空白对照组、miRNA-544-3p NC-mimic组和miRNA-544-3p NC-inhibitor组HBx-EGFP-14-19细胞中miRNA-544-3p相对表达量分别为0.16±0.03、0.16±0.05和0.11±0.06; 与对照组相比,miRNA-544-3p mimic组HBx-EGFP-14-19细胞中miRNA-544-3p相对表达量升高(4.13±2.07),miRNA-544-3p inhibitor组HBx-EGFP-14-19细胞中miRNA-544-3p相对表达量降低(0.02±0.01,P均<0.05)。这表明转染miRNA-544-3p mimic可上调miRNA-544-3p的表达水平,转染miRNA-544-3p inhibitor可下调miRNA-544-3p的表达水平。
2.6 miRNA-544-3p对HBx-EGFP-14-19细胞迁移和侵袭能力的影响划痕愈合实验结果(图 6A)显示,空白对照组、miRNA-544-3p NC-mimic组和miRNA-544-3p NC-inhibitor组HBx-EGFP-14-19细胞划痕愈合率分别为(59.13±8.83)%、(62.71±10.74)%、(56.59±11.25)%; 与对照组相比,miRNA-544-3p mimic组细胞划痕愈合率降低[(38.25±4.71)%],而miRNA-544-3pinhibitor组细胞划痕愈合率增高[(80.45±20.29)%,P均<0.05]。Transwell细胞迁移实验结果(图 6B)显示,空白对照组、miRNA-544-3pNC-mimic组和miRNA-544-3p NC-inhibitor组穿透小室滤膜的HBx-EGFP-14-19细胞数量分别为504.33±64.49、482.33±75.87和486.67±77.53; 与对照组相比,miRNA-544-3p mimic组穿透小室滤膜的细胞数量减少(97.33±7.02),而miRNA-544-3pinhibitor组穿透小室滤膜的细胞数量增加(823.67±23.35,P均<0.05)。Transwell细胞侵袭实验结果(图 6B)显示,空白对照组、miRNA-544-3pNC-mimic组和miRNA-544-3p NC-inhibitor组穿透基质胶与小室滤膜的HBx-EGFP-14-19细胞数量分别为221.67±14.22、226.00±11.53和223.33±11.37; 相较于对照组,miRNA-544-3p mimic组穿透基质胶与小室滤膜的细胞数量减少(40.33±4.04),而miRNA-544-3p inhibitor组穿透基质胶与小室滤膜的细胞数量增加(384.00±29.87,P均<0.05)。
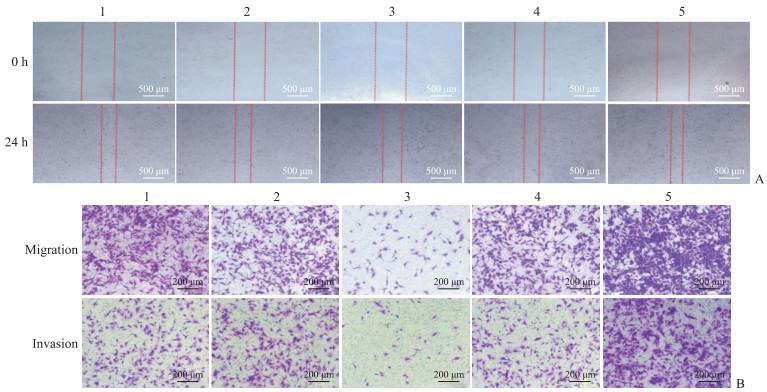
|
图 6 各组HBx-EGFP-14-19细胞的迁移和侵袭能力检测 Fig 6 Detection of migration and invasion abilities of HBx-EGFP-14-19 cells in each group A: Scratch wound healing assay; B: Transwell cell migration and invasion assay. 1: Blank control group; 2: miRNA-544-3p NC-mimic group; 3: miRNA-544-3p mimic group; 4: miRNA-544-3p NC-inhibitor group; 5: miRNA-544-3p inhibitor group. HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein; miRNA: MicroRNA; NC: Negative control. |
2.7 miRNA-544-3p对HBx-EGFP-14-19细胞中Arf6水平及Akt-mTOR通路的影响
qPCR检测结果显示,空白对照组、miRNA-544-3p NC-mimic组、miRNA-544-3p mimic组、miRNA-544-3p NC-inhibitor组、miRNA-544-3p inhibitor组Arf6 mRNA相对表达量分别为1.01±0.24、0.99±0.12、0.53±0.06、0.91±0.16、1.54±0.03,相较于对照组,miRNA-544-3p mimic组Arf6 mRNA相对表达量降低,而miRNA-544-3p inhibitor组Arf6 mRNA相对表达量增加(P均<0.05)。空白对照组、miRNA-544-3p NC-agomir组、miRNA-544-3p agomir组、miRNA-544-3p NC-antagomir和miRNA-544-3p antagomir组Arf6 mRNA相对表达量分别为1.57±0.16、1.46±0.21、0.69±0.06、1.67±0.06、2.67±0.13,相较于对照组,miRNA-544-3p agomir组Arf6 mRNA相对表达量降低,而miRNA-544-3pantagomir组Arf6 mRNA相对表达量增加(P均<0.05)。
蛋白质印迹法检测结果显示,空白对照组、miRNA-544-3p NC-mimic组、miRNA-544-3p mimic组、miRNA-544-3p NC-inhibitor组和miRNA-544-3pinhibitor组Arf6蛋白相对表达量分别为0.98±0.06、1.15±0.10、0.64±0.10、1.37±0.12、2.09±0.17(图 7A),相较于对照组,miRNA-544-3p mimic组Arf6蛋白相对表达量降低,而miRNA-544-3pinhibitor组Arf6蛋白相对表达量增加(P均<0.05); 空白对照组、miRNA-544-3p NC-agomir组、miRNA-544-3p agomir组、miRNA-544-3p NC-antagomir组和miRNA-544-3p antagomir组Arf6蛋白相对表达量分别为2.54±0.24、1.89±0.23、1.18±0.24、1.68±0.18、4.14±0.63(图 7B),相较于对照组,miRNA-544-3p agomir组Arf6蛋白相对表达量降低,而miRNA-544-3p antagomir组Arf6蛋白相对表达量增加(P均<0.05)。

|
图 7 蛋白质印迹法检测各组HBx-EGFP-14-19细胞中Arf6、Akt、mTOR的表达 Fig 7 Expression of Arf6, Akt, and mTOR in HBx-EGFP-14-19 cells of each group detected by Western blotting A, B: Expression of Arf6 protein; C, D: Expression of Akt and mTOR proteins. 1: Blank control group; 2: miRNA-544-3p NC-mimic group; 3: miRNA-544-3p mimic group; 4: miRNA-544-3p NC-inhibitor group; 5: miRNA-544-3p inhibitor group. Ⅰ: Blank control group; Ⅱ: miRNA-544-3p NC-agomir group; Ⅲ: miRNA-544-3p agomir group; Ⅳ: miRNA-544-3p NC-antagomir group; Ⅴ: miRNA-544-3p antagomir group. HBx: Hepatitis B virus X protein; EGFP: Enhanced green fluorescent protein; Arf6: Adenosine diphosphate ribosylation factor 6; Akt: Protein kinase B; mTOR: Mammalian target of rapamycin; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; p-mTOR: Phosphorylated mammalian target of rapamycin; p-Akt: Phosphorylated protein kinase B; miRNA: MicroRNA; NC: Negative control. |
蛋白质印迹法检测结果显示,空白对照组、miRNA-544-3p NC-mimic组、miRNA-544-3pmimic组、miRNA-544-3p NC-inhibitor组和miRNA-544-3p inhibitor组p-Akt蛋白相对表达量分别为0.61±0.11、0.70±0.22、0.29±0.07、0.71±0.51、1.11±0.19,Akt蛋白相对表达量分别为0.74±0.18、0.77±0.15、0.97±0.12、1.07±0.14、0.81±0.19,p-mTOR蛋白相对表达量分别为0.48±0.12、0.60±0.12、0.22±0.09、0.43±0.15、1.16±0.16,mTOR蛋白相对表达量分别为0.64±0.03、0.68±0.12、0.75±0.14、0.63±0.14、0.99±0.11(图 7C)。相较于对照组,miRNA-544-3p mimic组p-Akt和p-mTOR的表达均降低,而miRNA-544-3pinhibitor组p-Akt和p-mTOR表达均增加(P均<0.05); 各组间Akt蛋白和mTOR蛋白的表达差异均无统计学意义(P均>0.05)。空白对照组、miRNA-544-3p NC-agomir组、miRNA-544-3pagomir组、miRNA-544-3p NC-antagomir组和miRNA-544-3p antagomir组p-Akt蛋白相对表达量分别为0.75±0.15、0.71±0.15、0.42±0.13、0.81±0.15、1.56±0.21,Akt蛋白相对表达量分别为0.83±0.15、0.89±0.11、0.96±0.15、1.07±0.17、1.15±0.25,p-mTOR蛋白相对表达量分别为0.74±0.13、0.86±0.15、0.50±0.16、0.89±0.12、1.27±0.23,mTOR蛋白相对表达量分别为0.93±0.15、1.16±0.14、1.02±0.08、1.09±0.17、1.26±0.11(图 7D)。相较于对照组,miRNA-544-3p agomir组p-Akt、p-mTOR的表达均减少,而miRNA-544-3pantagomir组p-Akt、p-mTOR的表达均增加(P均<0.05); 各组间Akt蛋白和mTOR蛋白的表达差异均无统计学意义(P均>0.05)。上述结果表明miRNA-544-3p对Arf6/Akt-mTOR信号轴有调控作用。
3 讨论作为许多基因的转录后调节因子,miRNA调控了癌症的发生、发展、转移等多个过程,如癌细胞分化、增殖、凋亡、迁移、侵袭、血管生成等。现已发现miRNA-544在多种癌症中表达异常,如骨髓瘤[15]、结直肠癌[16]、宫颈癌[17]、乳腺癌[18-19]等,这提示miRNA-544与癌症存在着一定程度的关联。Chen等[15]研究指出,miRNA-544在促进骨髓瘤细胞增殖中发挥了十分重要的作用,它通过直接调控靶基因轴抑制因子2(axis inhibition protein 2,AXIN2)的表达参与骨髓瘤的发生。Yao等[16]研究发现,miRNA-544在结直肠癌细胞系和癌组织中过表达使靶基因叉头框蛋白O1(forkhead box O1,FOXO1)的表达增加,进而促进结直肠癌细胞的增殖和侵袭。Mao等[17]研究表明,靶基因酪氨酸3/色氨酸5单加氧酶激活蛋白ζ(tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein ζ,YWHAZ)表达的降低所引发的效应是miRNA-544发挥细胞周期调控和抑制宫颈癌细胞增殖、迁移和侵袭作用的核心因素。以上研究结果表明,miRNA-544在不同类型的癌症中特异性靶向不同基因,从而参与多种不同类型癌症的生理、病理进程,发挥了癌基因样或抑癌基因样作用。本研究结果显示,miRNA-544-3p在HBx存在时呈下调趋势,将miRNA-544-3p mimic或miRNA-544-3p inhibitor转染到HBx-EGFP-14-19细胞,实验结果提示miRNA-544-3p能够抑制细胞迁移和侵袭。本研究通过TargetScan生物信息学网站预测miRNA-544-3p的靶基因,并通过实验验证了Arf6可能为miRNA-544-3p的功能靶基因。
Arf6是Ras超家族中的1个小GTP酶结合蛋白,广泛存在于人体肝脏、胃、乳腺、前列腺等组织器官中,参与调控囊泡的形成和运输、细胞分裂与黏附、肌动蛋白细胞骨架的重组等,并与肿瘤细胞的生长、迁移和侵袭密切相关[20]。研究发现,Arf6在多种恶性肿瘤中异常高表达,如胰腺癌[21]和乳腺癌[22]。目前关于Arf6与HCC相关的研究报道较少。Wang等[23]研究发现,Arf6在HCC细胞系和人HCC组织中高表达,但其作用机制尚不清楚。有学者指出,Arf6通过作用于一系列细胞迁移和侵袭相关的下游通路,导致细胞迁移和侵袭能力改变并最终引发肿瘤[24]。Hashimoto等[21]指出Arf6是Akt-mTOR通路的上游调控因子,还有研究表明HBx通过激活Akt-mTOR信号通路促进了肝癌的发生、发展[25-26]。本研究结果表明,Arf6在HBx存在时呈上调趋势; 上调或下调miRNA-544-3p后Arf6及Akt-mTOR通路发生变化,提示miRNA-544-3p可能靶向调控Arf6并影响Akt-mTOR通路。
综上所述,本研究结果表明miRNA-544-3p可能通过调控Arf6/Akt-mTOR信号轴在HCC发生和转移中发挥抑制作用。但是,miRNA与靶基因的关系是一个复杂的网络调控系统,同一种miRNA可调控多个靶基因和多个信号通路,同一个靶基因也可受多种miRNA共同调节,miRNA-544-3p对其他基因的调控作用值得进一步深入研究。值得一提的是,本研究首次在动物体内以动态监测的方式考察了从HBx感染到HCC发生过程中miRNA-544-3p表达水平的变化,并进一步探讨了miRNA-544-3p在感染HBx过程中的功能和意义,为HBV-HCC的预测、治疗及预后研究提供了具有应用价值的新方向,也为HBV-HCC的生物治疗提供了新的作用靶点。
| [1] |
WANG M J, WANG Y T, FENG X S, WANG R J, WANG Y M, ZENG H M, et al. Contribution of hepatitis B virus and hepatitis C virus to liver cancer in China north areas: experience of the Chinese National Cancer Center[J]. Int J Infect Dis, 2017, 65: 15-21. DOI:10.1016/j.ijid.2017.09.003 |
| [2] |
TARAO K Z, OHKAWA S, MIYAGI Y, MORINAGA S, OHSHIGE K, YAMAMOTO N, et al. Inflammation in background cirrhosis evokes malignant progression in HCC development from HCV-associated liver cirrhosis[J]. Scand J Gastroenterol, 2013, 48: 729-735. DOI:10.3109/00365521.2013.782064 |
| [3] |
LEVRERO M, ZUCMAN-ROSSI J. Mechanisms of HBV-induced hepatocellular carcinoma[J]. J Hepatol, 2016, 64(1 Suppl): S84-S101. |
| [4] |
GUERRIERI F, BELLONI L, D'ANDREA D, PEDICONI N, LE PERA L, TESTONI B, et al. Genome-wide identification of direct HBx genomic targets[J/OL]. BMC Genomics, 2017, 18: 184. DOI: 10.1186/s12864-017-3561-5.
|
| [5] |
SALIMINEJAD K, KHORRAM KHORSHID H R, SOLEYMANI FARD S, GHAFFARI S H. An overview of microRNAs: biology, functions, therapeutics, and analysis methods[J]. J Cell Physiol, 2019, 234: 5451-5465. DOI:10.1002/jcp.27486 |
| [6] |
KROL J, LOEDIGE I, FILIPOWICZ W. The widespread regulation of microRNA biogenesis, function and decay[J]. Nat Rev Genet, 2010, 11: 597-610. DOI:10.1038/nrg2843 |
| [7] |
LEE Y S, DUTTA A. microRNAs in cancer[J]. Annu Rev Pathol, 2009, 4: 199-227. DOI:10.1146/annurev.pathol.4.110807.092222 |
| [8] |
ACUNZO M, ROMANO G, WERNICKE D, CROCE C M. MicroRNA and cancer: a brief overview[J]. Adv Biol Regul, 2015, 57: 1-9. DOI:10.1016/j.jbior.2014.09.013 |
| [9] |
WANG Z Y, WU Z J, HUANG P. The function of miRNAs in hepatocarcinogenesis induced by hepatitis B virus X protein (review)[J]. Oncol Rep, 2017, 38: 652-664. DOI:10.3892/or.2017.5716 |
| [10] |
WEI Z Y, SHEN X H, NI B, LUO G X, TIAN Y, SUN Y. Contribution of hepatitis B virus X protein-induced aberrant microRNA expression to hepatocellular carcinoma pathogenesis[J]. Turk J Biol, 2019, 43: 113-123. |
| [11] |
SAGNELLI E, POTENZA N, ONORATO L, SAGNELLI C, COPPOLA N, RUSSO A. Micro-RNAs in hepatitis B virus-related chronic liver diseases and hepatocellular carcinoma[J]. World J Hepatol, 2018, 10: 558-570. DOI:10.4254/wjh.v10.i9.558 |
| [12] |
SARTORIUS K, SWADLING L, AN P, MAKAROVA J, WINKLER C, CHUTURGOON A, et al. The multiple roles of hepatitis B virus X protein (HBx) dysregulated microRNA in hepatitis B virus-associated hepatocellular carcinoma (HBV-HCC) and immune pathways[J/OL]. Viruses, 2020, 12: 746. DOI: 10.3390/v12070746.
|
| [13] |
黄佳祎. 永生化肝前体细胞株的构建及维甲酸在肝前体细胞分化中的作用研究[D]. 重庆: 重庆医科大学, 2009.
|
| [14] |
钟沁, 张超, 何雪梅, 胡代曦, 张锡峰, 黄佳祎, 等. 表达HBx的肝前体细胞的小鼠肝内移植模型的构建[J]. 第三军医大学学报, 2014, 36: 2451-2454. |
| [15] |
CHEN M, LIU Y Y, ZHENG M Q, WANG X L, GAO X H, CHEN L, et al. MicroRNA-544 promoted human osteosarcoma cell proliferation by downregulating AXIN2 expression[J]. Oncol Lett, 2018, 15: 7076-7082. |
| [16] |
YAO G D, ZHANG Y F, CHEN P, REN X B. MicroRNA-544 promotes colorectal cancer progression by targeting forkhead box O1[J]. Oncol Lett, 2018, 15: 991-997. |
| [17] |
MAO L Y, ZHANG Y, DENG X L, MO W J, YU Y, LU H. Transcription factor KLF4 regulates microRNA-544 that targets YWHAZ in cervical cancer[J]. Am J Cancer Res, 2015, 5: 1939-1953. |
| [18] |
LU P W, GU Y T, LI L, WANG F, QIU X G. miR-544a promotes breast cancer cell migration and invasion reducing cadherin 1 expression[J]. Oncol Res, 2016, 23: 165-170. DOI:10.3727/096504016X14519157902726 |
| [19] |
ZHU Z Z, WANG S Y, ZHU J H, YANG Q F, DONG H M, HUANG J K. MicroRNA-544 down-regulates both Bcl6 and Stat3 to inhibit tumor growth of human triple negative breast cancer[J]. Biol Chem, 2016, 397: 1087-1095. DOI:10.1515/hsz-2016-0104 |
| [20] |
HONGU T, YAMAUCHI Y, FUNAKOSHI Y, KATAGIRI N, OHBAYASHI N, KANAHO Y. Pathological functions of the small GTPase Arf6 in cancer progression: tumor angiogenesis and metastasis[J]. Small GTPases, 2016, 7: 47-53. DOI:10.1080/21541248.2016.1154640 |
| [21] |
HASHIMOTO S, FURUKAWA S, HASHIMOTO A, TSUTAHO A, FUKAO A, SAKAMURA Y, et al. ARF6 and AMAP1 are major targets of KRAS and TP53 mutations to promote invasion, PD-L1 dynamics, and immune evasion of pancreatic cancer[J]. Proc Natl Acad Sci USA, 2019, 116: 17450-17459. DOI:10.1073/pnas.1901765116 |
| [22] |
SABE H, HASHIMOTO S, MORISHIGE M, OGAWA E, HASHIMOTO A, NAM J M, et al. The EGFR-GEP100-Arf6-AMAP1 signaling pathway specific to breast cancer invasion and metastasis[J]. Traffic, 2009, 10: 982-993. DOI:10.1111/j.1600-0854.2009.00917.x |
| [23] |
WANG S, WANG T J, GU P C. MicroRNA-145-5pinhibits migration, invasion, and metastasis in hepatocellular carcinoma by inhibiting ARF6[J]. Cancer Manag Res, 2021, 13: 3473-3484. DOI:10.2147/CMAR.S300678 |
| [24] |
LI R, PENG C, ZHANG X Z, WU Y W, PAN S D, XIAO Y C. Roles of Arf6 in cancer cell invasion, metastasis and proliferation[J]. Life Sci, 2017, 182: 80-84. DOI:10.1016/j.lfs.2017.06.008 |
| [25] |
WANG X, HUO B N, LIU J, HUANG X, ZHANG S Y, FENG T. Hepatitis B virus X reduces hepatocyte apoptosis and promotes cell cycle progression through the Akt/mTOR pathway in vivo[J]. Gene, 2019, 691: 87-95. DOI:10.1016/j.gene.2018.12.054 |
| [26] |
XIANG K L, WANG B. Role of the PI3K-AKT-mTOR pathway in hepatitis B virus infection and replication[J]. Mol Med Rep, 2018, 17: 4713-4719. |
 2022, Vol. 43
2022, Vol. 43


