肾细胞癌是泌尿外科常见的恶性肿瘤之一,其中肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)最常见且具有发病率高、生存期短等特点。近年来,随着外科技术的进步,越来越多的早期ccRCC患者在手术切除肿瘤后长期存活[1]。晚期ccRCC患者往往失去了手术机会,并且对放射治疗和化学治疗不敏感,因此在晚期ccRCC的治疗中靶向治疗十分重要[2-3]。
lncRNA是一类不包含任何开放阅读框的长度大于200 bp的RNA[4]。尽管lncRNA不编码蛋白质,但它却是生物体内多种生物学过程中不可缺少的调节因子[5]。已有许多研究表明,lncRNA与多种肿瘤的发生和发展有非常密切的联系[6-7]。多项研究表明lncRNA在ccRCC的发生和发展中起重要作用,它可通过多种机制促进ccRCC细胞在体内外的增殖、迁移及侵袭[8-9]。LINC00342是一种长链基因间非编码RNA,最早在2016年被报道[10]。目前有关LINC00342的研究并不少见,例如,有研究发现LINC00342可以促进结直肠癌和非小细胞肺癌的发生和发展[11-12]。然而,LINC00342在ccRCC中的作用及其机制尚未见报道。本研究旨在探索LINC00342在ccRCC中的作用及其分子生物学机制。
1 材料和方法 1.1 基因表达谱动态分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库分析通过GEPIA数据库分析523例ccRCC组织及100例癌旁组织中LINC00342的表达水平,并分析513例ccRCC样本(257例高表达,256例低表达)中LINC00342的表达水平与患者生存率的关系。
1.2 临床标本的获取65例ccRCC组织及配对的癌旁组织来源于2020年1月至2021年1月在南昌大学第一附属医院泌尿外科接受肾癌根治术的患者,所有标本均经病理诊断为ccRCC,患者术前均未接受过放射治疗和化学治疗,组织标本采集后立即放入液氮,后转移至-80 ℃冰箱内保存供后续实验用。本研究通过南昌大学第一附属医院伦理委员会审批,所有患者均知情同意。
1.3 细胞培养及转染人正常肾小管上皮细胞系(HK-2)及5种人ccRCC细胞系(786-O、A498、ACHN、OS-RC-2、769-P)均购自武汉普诺赛生物科技有限公司。细胞用含有10% FBS(美国Gibco公司)和1%青霉素-链霉素混合液的RPMI 1640培养基于37 ℃、5% CO2培养箱中进行培养,每3 d更换1次培养基。待细胞生长至融合度为30%~50%时,用Lipofectamine 3000(美国Invitrogen公司)进行转染。转染分组如下:siRNA组(转染si-LINC00342)、阴性对照(negative control,NC)组(转染LINC00342-NC)和空白对照组。转染所需的si-LINC00342、LINC00342-NC均购自汉恒生物科技(上海)有限公司。
1.4 qPCR检测LINC00342和miRNA-384表达采用TRIzol试剂盒(武汉赛维尔生物科技有限公司)提取组织及细胞中的RNA,用反转录试剂盒(武汉赛维尔生物科技有限公司)合成cDNA,并进行PCR扩增。反应条件:预变性95 ℃ 30 s; 变性95 ℃15 s、退火60 ℃ 30 s、延伸72 ℃ 20 s,循环40次。以β-肌动蛋白及U6作为内参,采用2-ΔΔCt法计算目的基因相对表达量。引物序列见表 1。
|
|
表 1 引物序列 Tab 1 Sequence of primers |
1.5 CCK-8检测细胞增殖能力
将消化、离心并重悬后的细胞按照每孔2×103个细胞的密度接种至96孔板中,培养0、24、48、72 h时在每孔内分别加入10 μL CCK-8试剂(武汉赛维尔生物科技有限公司),在37 ℃条件下孵育2~4 h,用酶标仪测定450 nm波长处的光密度(D450)值。
1.6 划痕愈合实验检测细胞迁移能力将细胞均匀地接种至6孔板中,待细胞融合度达到80%时,用枪头在每孔中做一“十”字划痕,PBS清洗后用无血清培养基培养,于0 h和24 h时在显微镜下拍照,并计算细胞迁移距离百分比。细胞迁移距离百分比=(各转染组0 h划痕宽度-各转染组24 h划痕宽度)/(空白对照组0 h划痕宽度-空白对照组24 h划痕宽度)×100%。
1.7 Transwell实验检测细胞侵袭能力事先在Transwell小室的上室中涂抹基质胶(美国Corning公司),待其凝固后备用。在下室中加入600 μL含20% FBS的培养基,放入Transwell小室。将细胞常规消化、离心后用无血清培养基重悬,在上室中加入200 μL含2×104个细胞的细胞悬液。培养24 h时用棉签将上室擦洗干净,用甲醇固定,0.1%结晶紫染色。风干后在显微镜下拍照、计数。
1.8 蛋白质印迹法检测上皮间质转化(epithelial-mesenchymal transition,EMT)通路相关蛋白的表达用RIPA裂解液(武汉赛维尔生物科技有限公司)裂解细胞后提取蛋白质,用BCA法检测所提取蛋白质的浓度。用SDS-PAGE分离蛋白质,并转移至PVDF膜上。将PVDF膜与波形蛋白(vimentin)、神经钙黏素(N-cadherin)和上皮钙黏素(E-cadherin)抗体(英国Abcam公司)孵育过夜后,再与二抗(英国Abcam公司)孵育1 h,最后用显影液(武汉赛维尔生物科技有限公司)对PVDF膜进行成像,分析各条带的灰度值。
1.9 LINC00342下游靶分子的预测及验证利用Starbase网站和LncBook数据库预测LINC00342的下游靶分子,并通过qPCR验证其表达,然后预测LINC00342与miRNA-384的结合位点,设计并合成LINC00342的野生型(wild type,WT)和突变型(mutation,Mut)结合位点,构建目的质粒及阴性对照质粒。使用转染试剂[汉恒生物科技(上海)有限公司]将LINC00342-WT和LINC00342-Mut的目的质粒分别与miRNA-384 mimic和NC mimic[汉恒生物科技(上海)有限公司]共转染细胞,转染48 h后,使用双萤光素酶报告基因实验检测系统检测萤光素酶的活性。萤光素酶活性计算方法如下:萤光素酶活性=萤火虫萤光素酶活性/海肾萤光素酶活性。
1.10 统计学处理使用GraphPad Prism 7.0软件绘图及进行统计学分析。呈正态分布的计量资料以x±s表示,组间比较采用独立样本t检验或单因素方差分析。呈偏态分布的计量资料以中位数表示,组间比较采用秩和检验。计数资料以例数和百分数表示,组间比较采用χ2检验。生存率的比较采用log-rank检验。检验水准(α)为0.05。
2 结果 2.1 LINC00342在ccRCC组织及细胞中的表达及其临床意义GEPIA数据库分析结果显示,与癌旁组织相比,LINC00342在ccRCC组织中高表达(P<0.05),并且LINC00342高表达的患者总生存率低于低表达的患者(P=0.001 8,图 1)。qPCR检测结果显示,与癌旁组织和HK-2细胞相比,LINC00342在ccRCC组织和5种ccRCC细胞系中均呈高表达,差异均有统计学意义(P均<0.05,图 2)。LINC00342在ccRCC细胞系786-O和OS-RC-2中表达最高,因此选择这2种细胞系用于后续实验。根据LINC00342表达的中位数(8.396),将65例ccRCC患者分为高表达组(n=32)和低表达组(n=33)。结果显示,LINC00342高表达的ccRCC患者肿瘤直径更大、临床分期更晚(P均<0.05,表 2)。

|
图 1 LINC00342在ccRCC组织中的表达及其与患者总生存率的关系 Fig 1 Expression of LINC00342 in ccRCC tissues and its relationship with overall survival rate A: Expression of LINC00342 in ccRCC tissues and paracancerous normal renal tissues (*P < 0.05); B: Overall survival rate was decreased in patients with high LINC00342 expression. The data were from the Gene Expression Profiling Interactive Analysis database. LINC00342: Long non-coding RNA LINC00342; ccRCC: Clear cell renal cell carcinoma. |
|
|
表 2 ccRCC组织中LINC00342的表达与患者临床病理学特征之间的关系 Tab 2 Relationship between LINC00342 expression in ccRCC tissues and clinicopathological features of patients |
2.2 LINC00342对ccRCC细胞增殖、迁移及侵袭的影响

|
图 2 LINC00342在ccRCC组织及细胞系中的表达水平 Fig 2 Expression of LINC00342 in ccRCC tissues and cell lines A: Expression of LINC00342 in ccRCC tissues and paracancerous normal renal tissues (*P < 0.05. n=65); B: LINC00342 was highly expressed in 5 kinds of ccRCC cell lines (A498, 786-O, ACHN, 769-P, and OS-RC-2), with the highest expression in 786-O and OS-RC-2 (*P < 0.05. n=3, x±s). The expression of LINC00342 was detected by quantitative polymerase chain reaction. LINC00342: Long non-coding RNA LINC00342; ccRCC: Clear cell renal cell carcinoma. |
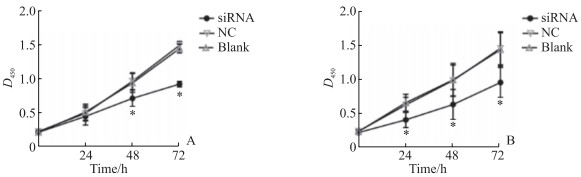
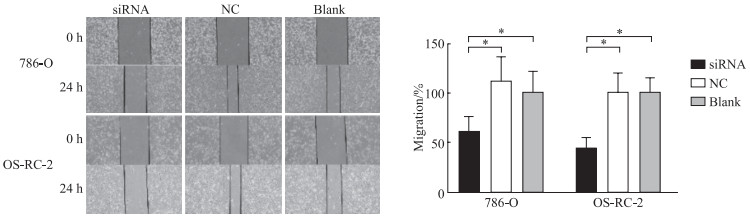
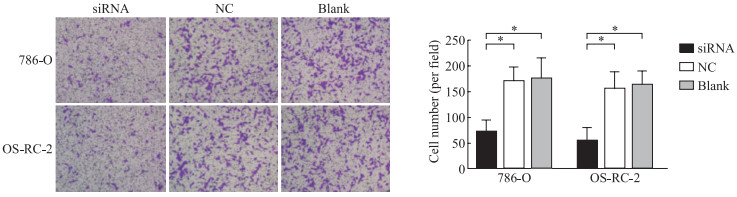
CCK-8实验结果显示,利用siRNA沉默LINC00342能够抑制786-O和OS-RC-2细胞的增殖能力(P均<0.05,图 3)。划痕愈合实验结果显示,沉默LINC00342可使786-O和OS-RC-2细胞的迁移能力减弱(P均<0.05,图 4)。Transwell实验结果显示,siRNA组786-O和OS-RC-2细胞的侵袭能力低于NC组及空白对照组,差异均有统计学意义(P均<0.05,图 5)。
|
图 3 沉默LINC00342抑制ccRCC细胞增殖 Fig 3 Silencing of LINC00342 inhibits proliferation of ccRCC cells A: 786-O cells; B: OS-RC-2 cells. *P < 0.05 vs NC group and blank group at same time point. n=3, x±s. The cell proliferation was detected by cell counting kit 8. LINC00342: Long non-coding RNA LINC00342; ccRCC: Clear cell renal cell carcinoma; siRNA: Small interfering RNA; NC: Negative control. |
|
图 4 沉默LINC00342抑制ccRCC细胞的迁移 Fig 4 Silencing of LINC00342 inhibits migration of ccRCC cells *P < 0.05. n=3, x±s. The cell migration was detected by scratch wound healing assay (40×). LINC00342: Long non-coding RNA LINC00342; ccRCC: Clear cell renal cell carcinoma; siRNA: Small interfering RNA; NC: Negative control. |
|
图 5 沉默LINC00342抑制ccRCC细胞的侵袭 Fig 5 Silencing of LINC00342 inhibits invasion of ccRCC cells *P < 0.05. n=3, x±s. The cell invasion was detected by Transwell assay. Crystal violet staining (200×). LINC00342: Long non-coding RNA LINC00342; ccRCC: Clear cell renal cell carcinoma; siRNA: Small interfering RNA; NC: Negative control. |
2.3 LINC00342对ccRCC细胞EMT的影响
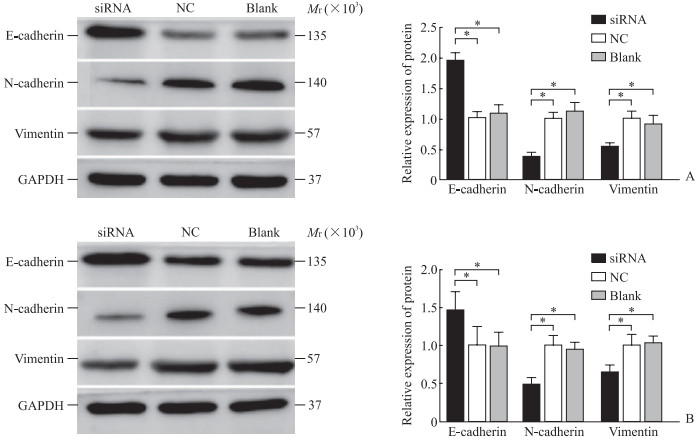
蛋白质印迹法检测结果显示,沉默LINC00342可使786-O和OS-RC-2细胞中波形蛋白和神经钙黏素的表达下调,上皮钙黏素的表达上调(P均<0.05,图 6)。提示LINC00342可能通过调节EMT进程促进ccRCC细胞的迁移及侵袭。
|
图 6 沉默LINC00342抑制ccRCC细胞中EMT相关蛋白的表达 Fig 6 Silencing of LINC00342 inhibits expression of EMT-associated proteins in ccRCC cells A: 786-O cells; B: OS-RC-2 cells. *P < 0.05. n=3, x±s. The expression of proteins was detected by Western blotting. LINC00342: Long non-coding RNA LINC00342; ccRCC: Clear cell renal cell carcinoma; EMT: Epithelial-mesenchymal transition; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; siRNA: Small interfering RNA; NC: Negative control. |
2.4 LINC00342促进ccRCC细胞恶性表型的机制
生物信息学分析结果显示,miRNA-384、miRNA-545-5p和miRNA-19a-3p可能是LINC00342的下游靶分子(图 7A)。qPCR结果显示,沉默LINC00342可使786-O和OS-RC-2细胞中miRNA-384的表达升高(P均<0.05,图 7B)。双萤光素酶报告基因实验显示,在786-O和OS-RC-2细胞中,miRNA-384 mimic与LINC00342-WT共转染后萤光素酶活性均下降(P均<0.05),而miRNA-384 mimic与LINC00342-Mut共转染后萤光素酶活性没有出现明显下降(P均>0.05,图 7C~7E),说明miRNA-384是LINC00342的下游靶分子。

|
图 7 miRNA-384是LINC00342的靶分子 Fig 7 miRNA-384 was a target gene for LINC00342 A: Bioinformatics predicted the downstream target genes of LINC00342; B: Quantitative polymerase chain reaction results showed that silencing of LINC00342 increased the expression of miRNA-384; C: LINC00342 had a binding site to miRNA-384; D, E: Luciferase activity decreased in 786-O (D) and OS-RC-2 (E) cells transfected with LINC00342 WT in combination with miRNA-384 mimic. *P < 0.05. n=3, x±s. miRNA: MicroRNA; LINC00342: Long non-coding RNA LINC00342; siRNA: Small interfering RNA; NC: Negative control; hsa: Homo sapiens; WT: Wild type; Mut: Mutant. |
3 讨论
人类基因组测序结果显示,编码蛋白质的RNA只占一小部分,大部分RNA都是非编码RNA,其中lncRNA由于涉及多种生物学机制并且与多种肿瘤密切相关[13],各国学者一直热衷于对其进行深入研究。随着靶向治疗的问世,针对肾癌的靶向治疗药物逐渐增多,然而其临床效果目前尚不能令人满意,探索lncRNA在ccRCC中的作用具有至关重要的意义[14]。本研究在初始阶段对GEPIA数据库中的数据进行了分析,发现LINC00342在ccRCC组织中高表达,并且其高表达与患者生存率降低有关,因此将LINC00342作为研究对象。
本研究采用qPCR检测了65对ccRCC组织及癌旁组织、5种ccRCC细胞系中LINC00342的表达量,发现LINC00342在ccRCC组织及细胞系的表达升高,并且其高表达与肿瘤直径大、临床分期晚有关。为了验证LINC00342在ccRCC中的作用,本研究进行了一系列体外实验,CCK-8实验、划痕愈合实验和Transwell实验结果显示,LINC00342可以促进ccRCC细胞的增殖、迁移及侵袭。既往研究发现LINC00342在非小细胞肺癌中高表达,并且可以促进肺癌细胞的增殖、迁移及侵袭[11]。LINC00342在大肠癌中不仅具有促进细胞增殖的作用,还可阻断细胞周期、抑制细胞的凋亡[12, 15]。因此,LINC00342可能与肿瘤恶性行为密切相关。
EMT通常是指上皮细胞在经历多种变化后呈现出间质细胞表型,包括迁移能力、侵袭性和抗凋亡能力的增加,以及大量细胞外基质成分的形成[16]。EMT的特征是上皮标志物下调、间质标志物上调、基底膜降解、细胞向间质迁移[17]。大多数肿瘤的进展往往伴随着EMT的发生,EMT在恶性肿瘤细胞的侵袭和迁移过程中起着至关重要的作用。多项研究表明,lncRNA可以通过作用于EMT对肿瘤的进展产生影响[18-19]。本研究中蛋白质印迹法检测结果显示,沉默LINC00342可使ccRCC细胞中波形蛋白和神经钙黏素表达下调、上皮钙黏素表达上调。由此可以推断,LINC00342对ccRCC进展的影响可能与EMT有关。
miRNA-384是一种非编码小RNA,研究表明其参与调控多种恶性肿瘤的发生与发展。miRNA-384在胶质瘤中表达下调,上调其表达能抑制胶质瘤细胞的增殖并促进凋亡[20]。miRNA-384还可以抑制非小细胞肺癌细胞增殖[21]。在ccRCC中,miRNA-384可靶向RAS癌基因家族成员RAB23来抑制细胞的增殖和迁移[22]。本研究采用双萤光素酶报告基因实验验证了miRNA-384和LINC00342之间的靶向关系,发现miRNA-384是LINC00342的下游靶分子之一,LINC00342对ccRCC细胞恶性表型的调节作用可能是通过靶向miRNA-384而实现的。
本研究的不足之处有以下几点。首先,本研究采集的组织样本量较小,这可能使研究结论的可靠性下降; 其次,由于条件有限,本研究没有进行在体实验; 最后,本研究没有就miRNA-384发挥作用的下游机制进行深入研究。
综上所述,LINC00342在ccRCC组织中表达上调,且与不良的临床病理学结果相关。LINC00342可以促进ccRCC细胞的恶性表型,miRNA-384是LINC00342的下游靶分子之一。
| [1] |
LJUNGBERG B, ALBIGES L, ABU-GHANEM Y, BENSALAH K, DABESTANI S, FERNÁNDEZ-PELLO S, et al. European association of urology guidelines on renal cell carcinoma: the 2019 update[J]. Eur Urol, 2019, 75: 799-810. DOI:10.1016/j.eururo.2019.02.011 |
| [2] |
MOTZER R J, JONASCH E, MICHAELSON M D, NANDAGOPAL L, GORE J L, GEORGE S, et al. NCCN guidelines insights: kidney cancer, version 2.2020[J]. J Natl Compr Canc Netw, 2019, 17: 1278-1285. DOI:10.6004/jnccn.2019.0054 |
| [3] |
RINI B I, MCDERMOTT D F, HAMMERS H, BRO W, BUKOWSKI R M, FABA B, et al. Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of renal cell carcinoma[J/OL]. J Immunother Cancer, 2016, 4: 81. DOI: 10.1186/s40425-016-0180-7.
|
| [4] |
CAO H F, WAHLESTEDT C, KAPRANOV P. Strategies to annotate and characterize long noncoding RNAs: advantages and pitfalls[J]. Trends Genet, 2018, 34: 704-721. DOI:10.1016/j.tig.2018.06.002 |
| [5] |
KAIKKONEN M U, ADELMAN K. Emerging roles of non-coding RNA transcription[J]. Trends Biochem Sci, 2018, 43: 654-667. DOI:10.1016/j.tibs.2018.06.002 |
| [6] |
CHEN L L, QIAN X L, WANG Z Q, ZHOU X Q. The HOTAIR lncRNA: a remarkable oncogenic promoter in human cancer metastasis[J/OL]. Oncol Lett, 2021, 21: 302. DOI: 10.3892/ol.2021.12563.
|
| [7] |
GHAFOURI-FARD S, DASHTI S, HUSSEN B M, FARSI M, TAHERI M. BCYRN1: an oncogenic lncRNA in diverse cancers[J/OL]. Pathol Res Pract, 2021, 220: 153385. DOI: 10.1016/j.prp.2021.153385.
|
| [8] |
TAO M M, ZHOU Y, JIN Y C, PU J X. Blocking lncRNA MIR155HG/miR-155-5p/-3p inhibits proliferation, invasion and migration of clear cell renal cell carcinoma[J/OL]. Pathol Res Pract, 2020, 216: 152803. DOI: 10.1016/j.prp.2019.152803.
|
| [9] |
HAMILTON M J, YOUNG M, JANG K, SAUER S, NEANG V E, KING A T, et al. HOTAIRM1 lncRNA is downregulated in clear cell renal cell carcinoma and inhibits the hypoxia pathway[J]. Cancer Lett, 2020, 472: 50-58. DOI:10.1016/j.canlet.2019.12.022 |
| [10] |
WANG L, CHEN Z H, AN L, WANG Y J, ZHANG Z J, GUO Y H, et al. Analysis of long non-coding RNA expression profiles in non-small cell lung cancer[J]. Cell Physiol Biochem, 2016, 38: 2389-2400. DOI:10.1159/000445591 |
| [11] |
CHEN Q F, KONG J L, ZOU S C, GAO H, WANG F, QIN S M, et al. LncRNA LINC00342 regulated cell growth and metastasis in non-small cell lung cancer via targeting miR-203a-3p[J]. Eur Rev Med Pharmacol Sci, 2019, 23: 7408-7418. |
| [12] |
MIAO Z H, LIU S Y, XIAO X W, LI D. LINC00342 regulates cell proliferation, apoptosis, migration and invasion in colon adenocarcinoma via miR-545-5p/MDM2 axis[J/OL]. Gene, 2020, 743: 144604. DOI: 10.1016/j.gene.2020.144604.
|
| [13] |
GROTE P, BOON R A. LncRNAs coming of age[J]. Circ Res, 2018, 123: 535-537. DOI:10.1161/CIRCRESAHA.118.313447 |
| [14] |
BROWN L C, DESAI K, ZHANG T, ORNSTEIN M C. The immunotherapy landscape in renal cell carcinoma[J]. BioDrugs, 2020, 34: 733-748. |
| [15] |
SHEN P, QU L L, WANG J J, DING Q C, ZHOU C W, XIE R, et al. LncRNA LINC00342 contributes to the growth and metastasis of colorectal cancer via targeting miR-19a-3p/NPEPL1 axis[J/OL]. Cancer Cell Int, 2021, 21: 105. DOI: 10.1186/s12935-020-01705-x.
|
| [16] |
DAS V, BHATTACHARYA S, CHIKKAPUTTAIAH C, HAZRA S, PAL M. The basics of epithelial-mesenchymal transition (EMT): a study from a structure, dynamics, and functional perspective[J]. J Cell Physiol, 2019, 234: 14535-14555. DOI:10.1002/jcp.28160 |
| [17] |
KALLURI R, WEINBERG R A. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009, 119: 1420-1428. DOI:10.1172/JCI39104 |
| [18] |
WANG J C, WANG W, TANG Q L, LU L B, LUO Z J, LI W C, et al. Long non-coding RNA lnc-GNAT1-1 suppresses liver cancer progression via modulation of epithelial-mesenchymal transition[J/OL]. Front Genet, 2020, 11: 1029. DOI: 10.3389/fgene.2020.01029.
|
| [19] |
SHEN S, WANG J W, ZHENG B H, NI X J, GAO Z H, ZHANG D X, et al. The lnc-CITED2-2: 1 inhibits metastasis via inhibiting CITED2 and epithelial-mesenchymal transition in gallbladder cancer[J/OL]. Clin Transl Med, 2020, 10: e116. DOI: 10.1002/ctm2.116.
|
| [20] |
TIAN Y H, JIA L W, LIU Z F, CHEN Y H. LINC01087 inhibits glioma cell proliferation and migration, and increases cell apoptosis via miR-384/Bcl-2 axis[J]. Aging, 2021, 13: 20808-20819. DOI:10.18632/aging.203478 |
| [21] |
GUO Q, ZHENG M, XU Y, WANG N, ZHAO W. MiR-384 induces apoptosis and autophagy of non-small cell lung cancer cells through the negative regulation of collagen α-1(X) chain gene[J/OL]. Biosci Rep, 2019, 39: BSR20181523. DOI: 10.1042/BSR20181523.
|
| [22] |
YAN L, WU K, DU F, YIN X, GUAN H. miR-384 suppressed renal cell carcinoma cell proliferation and migration through targeting RAB23[J]. J Cell Biochem, 2019, 120: 1420-1426. |
 2022, Vol. 43
2022, Vol. 43


