2. 武警特色医学中心病理科,天津 300162;
3. 武警北京总队医院军事医学与特种学科,北京 100027
2. Department of Pathology, Featured Medical Center of Chinese People's Armed Police Forces, Tianjin 300162, China;
3. Military Medicine and Special Discipline, Beijing General Hospital of Chinese People's Armed Police Forces, Beijing 100027, China
患者女,67岁,因“无明显诱因间断喘息3个月”于2021年1月23日收治于武警特色医学中心。患者入院前2周喘息症状加重,活动后明显,伴头痛、头晕、纳差、胸部闷胀感及少量咳嗽,不能平卧(左侧卧位时症状可减轻、右侧卧位时症状加重),无明显咳痰,无咯血,无发热,无恶心、呕吐,无腹痛、腹泻,无尿急、尿频、尿痛等其他伴随症状。既往有先天性心脏病史,房间隔缺损修补术后。入院后暂给予抗感染、化痰、解痉、平喘等治疗,动态观察病情变化。胸部CT检查示右侧胸膜多发占位,考虑恶性病变,伴右肺肺不张、炎症;双肺结节,转移瘤待除外;右侧胸腔积液;双侧乳腺钙化灶;结合临床,开胸术后改变;动脉硬化;胸椎骨质增生。实验室检查示血清神经元特异性烯醇化酶(17.7 ng/mL,正常参考值<16.3 ng/mL)和细胞角蛋白19片段(2.75 ng/mL,正常参考值<2.08 ng/mL)升高,癌胚抗原、铁蛋白、糖类抗原15-3、鳞状细胞癌相关抗原、甲胎蛋白和CA19-9均未见异常。为进一步明确诊断,患者行全身18F-氟代脱氧葡萄糖(18F fluorodeoxyglucose,18F-FDG)PET-CT检查。
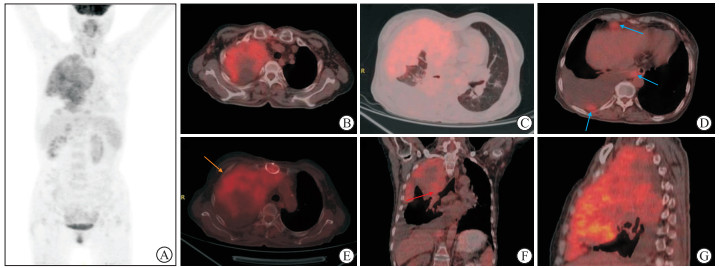
患者空腹6 h后(指尖血血糖为4.7 mmol/L),经左上肢静脉注射18F-FDG(放射性活度为210.9 MBq),安静环境休息60 min后行PET-CT全身扫描,扫描范围为颅顶至大腿中段,层厚3.75 mm。18F-FDG PET-CT图像(图 1)示右肺上叶大片实变影(大小约为12.9 cm×12.7 cm×11.4 cm),密度不均,右肺上叶支气管堵塞,侵及邻近胸膜及右肺中叶,右侧第1~3肋骨皮质变薄,18F-FDG摄取弥漫性不均匀性增高,最大标准摄取值(maximum standard uptake value,SUVmax)为5.1;右侧胸膜可见多发软组织密度结节或肿块影,18F-FDG摄取增高,SUVmax为3.0;左肺上叶舌段叶间胸膜下结节(大小约为1.7 cm×1.4 cm×1.8 cm),18F-FDG摄取未见明显异常。综合诊断为右肺上叶恶性肿瘤侵及邻近胸膜、右侧第1~3肋骨,伴右侧胸膜多发转移。
|
图 1 18F-FDG PET-CT检查结果 A:全身最大密度投影;B,C:PET-CT横断面示右肺内肿块伴葡萄糖代谢增高;D:PET-CT横断面示胸膜多发结节伴葡萄糖代谢增高(箭头所示);E:PET-CT横断面示右侧第2肋骨骨质破坏(箭头所示);F:PET-CT冠状面示右肺肿块伴葡萄糖代谢增高,伴右肺上叶支气管堵塞(箭头所示);G:PET-CT矢状面示右肺肿块伴葡萄糖代谢增高. 18F-FDG:18F-氟代脱氧葡萄糖;PET-CT:正电子发射计算机断层显像. |
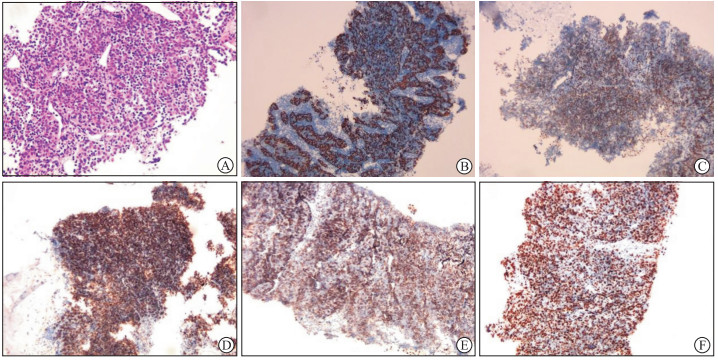
患者18F-FDG PET-CT检查后2 d在超声引导下行肺穿刺活检术,送检右上肺灰白色线样组织数条,长0.1~0.4 cm,直径均为0.1 cm。镜下观察到纤维组织间见大量淋巴细胞及少许不规则上皮细胞,考虑胸腺瘤,送检组织可见少许肺组织(图 2A)。免疫组织化学染色结果显示CD34、CD3、CD20、p40、细胞角蛋白19(图 2B)、CD5、末端脱氧核糖核酸转移酶(terminal deoxynucleotidyl transferase,TdT;图 2C)、CD99(图 2D)、CD1α(图 2E)阳性,Ki-67密集区阳性率达60%(图 2F),甲状腺转录因子1(thyroid transcription factor 1,TTF-1)和CD21阴性。出院诊断为右肺内异位胸腺瘤,伴胸膜多发转移。
|
图 2 肺内异位胸腺瘤的病理组织学和免疫组织化学染色结果(200×) A:苏木精-伊红染色;B:免疫组织化学染色示细胞角蛋白19阳性;C:免疫组织化学染色示末端脱氧核糖核酸转移酶阳性;D:免疫组织化学染色示CD99阳性;E:免疫组织化学染色示CD1α阳性;F:免疫组织化学染色示Ki-67阳性率约为60%. |
2 讨论
胸腺瘤是一种起源于胸腺上皮细胞的肿瘤,发病率为0.15/100 000[1],其中约96%的胸腺瘤发生于前纵隔,而发生于前纵隔以外的胸腺瘤称为异位胸腺瘤(约占4%)。异位胸腺瘤最常发生于颈部,其次是胸膜、肺、甲状腺、心包和后纵隔等部位[2]。肺内异位胸腺瘤是指发生在肺内的胸腺瘤,表现为胸腺瘤的组织学病理特征,临床上罕见[3]。肺内异位胸腺瘤的起源还不十分清楚,可能来源于胸腺发育过程中移位的胸腺组织,也可能起源于干细胞,包含不同比例的瘤样上皮细胞与淋巴细胞[4]。肺内异位胸腺瘤通常发生于老年人,平均发病年龄为57岁,男女比例约为13∶17;肺内异位胸腺瘤可在肺胸膜下、肺内或肺门区形成肿块,病灶的大小平均为4.5 cm(1.5~12.8 cm);大多数病变位于右肺(约占56%),位于左肺者约占40%,部位不明确者约占4%;其中病变发生于肺上叶者约占65%,发生于肺下叶者约占35%[5]。本例为女性患者,病灶主要位于右肺上叶,此处为肺内异位胸腺瘤的高发部位。
胸腺瘤是典型的惰性生长肿瘤,预后相对较好。大多数肺内异位胸腺瘤生长缓慢,且无明显临床症状,增大到一定程度时患者才会出现局部的临床症状,主要表现为胸痛、咳嗽、发热和反复咯血等,大部分患者发现时肿瘤通常已较大[3]。临床出现重症肌无力的表现有利于胸腺瘤的诊断,但胸腺瘤患者中只有约1/3会出现重症肌无力[6]。本例患者早期症状不明显,出现间断性喘息仅3个月,近2周喘息症状加重,伴头痛、头晕、少量咳嗽,其临床症状不典型,且未出现重症肌无力的临床表现,诊断较为困难。本例患者肺穿刺病理活检结果显示为胸腺瘤组织及少许肺组织,另外PET-CT结果显示肿块几乎累及右肺整个上叶及部分中叶,右肺上叶支气管也完全堵塞,因此从影像学表现上进一步支持肺内原发性病变。
18F-FDG PET-CT可通过反映组织葡萄糖代谢水平而用于恶性肿瘤的诊断、分期与疗效评价。胸腺瘤通常表现为葡萄糖代谢增高,且肿瘤葡萄糖代谢水平与其恶性程度呈正相关[7]。虽然已有关于肺门或肺内异位胸腺瘤18F-FDG PET-CT的病例报告[8-9],但本例患者主要表现为右肺上叶巨大肿块,同时伴有多发胸膜结节,葡萄糖代谢增高,不同于先前报道的病例。免疫组织化学染色结合肿瘤的形态分析及患者的临床病史有助于鉴别肺内异位胸腺瘤与其他胸腔内肿瘤。本病例的免疫组织化学染色结果显示TdT、CD99、Ki-67表达阳性,这主要见于T淋巴母细胞淋巴瘤和胸腺瘤,但细胞角蛋白19和CD1α的阳性表达进一步支持胸腺瘤的诊断[10],故诊断为异位胸腺瘤。
肺内异位胸腺瘤需与范围广泛的肺黏膜相关淋巴瘤、原发性肺癌或肺转移癌、肺结核等进行鉴别。肺黏膜相关淋巴瘤也可表现为肺内实变影,18F-FDG摄取呈轻度不均匀性增高,其影像特征可表现为含气支气管影,可达病灶边缘,同时病灶内很少出现钙化灶,而胸腺瘤内钙化相对常见[9];肺癌常有分叶和毛刺,而非侵袭性肺内异位胸腺瘤组织与正常肺组织边界相对光滑[10];肺结核好发于肺上叶尖后段及下叶背段,也常有钙化灶及卫星灶,而肺内异位胸腺瘤没有特定的好发部位,且无卫星灶等特征,此外还可通过实验室检查进行鉴别诊断[11]。
总之,肺内异位胸腺瘤的鉴别诊断较为困难,影像学表现缺乏特异性,诊断主要依据病理学及免疫组织化学染色结果,18F-FDG PET-CT全身显像可为患者的临床分期及病理活检部位提供重要参考。
| [1] |
ISHIBASHI F, MORIYA Y, TAMURA H, MATSUI Y, ⅡZASA T. Differential diagnosis of primary intrapulmonary thymoma: a report of two cases[J/OL]. Surg Case Rep, 2015, 1: 56. DOI: 10.1186/s40792-015-0061-1.
|
| [2] |
KHURANA R, SHARMA S, KUMAR S, DESHPANDE A A, WADHWA D, AGASTY S. Paraneoplastic pemphigus associated with a pericardial ectopic thymoma[J]. J Card Surg, 2020, 35: 3141-3144. DOI:10.1111/jocs.14955 |
| [3] |
JUNG W, KANG C H, KIM Y T, PARK I K. Primary intrapulmonary thymoma presenting as a solitary pulmonary nodule[J]. Korean J Thorac Cardiovasc Surg, 2017, 50: 54-58. DOI:10.5090/kjtcs.2017.50.1.54 |
| [4] |
ZHOU Q, HAN L, KE X, ZHOU J. Ectopic thymoma: retrospective analysis of eight cases with clinical features and computed tomography findings[J]. Clin Imaging, 2020, 60: 153-159. DOI:10.1016/j.clinimag.2019.10.017 |
| [5] |
KATSURA M, KOUSO H, SHIKADA Y, USHIJIMA C, MOMOSAKI S, TAKEO S. Primary intrapulmonary thymoma[J]. Gen Thorac Cardiovasc Surg, 2015, 63: 56-59. DOI:10.1007/s11748-013-0283-8 |
| [6] |
袁东风, 谷志涛, 梁光辉, 方文涛, 李印. 胸腺瘤合并重症肌无力患者预后的临床研究[J]. 中国肺癌杂志, 2018, 21: 1-7. |
| [7] |
卢绍路. 18F-FDG PET/CT定量分析在前纵隔肿瘤鉴别诊断中的初步应用分析[J]. 影像研究与医学应用, 2021, 5: 108-109. |
| [8] |
康磊, 朱祥, 刘佳, 范岩, 王荣福. 肺门异位胸腺瘤PET-CT显像1例[J]. 中国肿瘤临床, 2018, 45: 1127-1128. DOI:10.3969/j.issn.1000-8179.2018.21.805 |
| [9] |
杨文平, 丁重阳. 胸腺瘤误诊肺黏膜相关淋巴瘤18F-FDG PET/CT显像1例[J]. 中国临床研究, 2016, 29: 1405-1408. |
| [10] |
WU X, GUO J, ZHOU X, LI Y, HUANG Y, WU L. Ectopic thymoma: report of 2 cases and review of the literature[J]. Int J Clin Exp Pathol, 2019, 12: 4297-4302. |
| [11] |
王士猛. 右胸腔肺内胸腺瘤误诊为肺结核1例[J/CD]. 中华胸部外科电子杂志, 2016, 3: 250-251.
|
 2022, Vol. 43
2022, Vol. 43


