2. 海军905医院麻醉科,上海 200050
2. Department of Anesthesiology, No. 905 Hospital of PLA Navy, Shanghai 200050, China
现代海战中伤员的救治与陆上作战伤员不同。在海战伤条件下,由于海水的特殊理化性质与细菌的特殊性[1],伤口经海水浸泡后难以愈合且易继发感染,给伤员带来极大痛苦。传统的创面敷料难以对海水浸泡创面起到抗炎、促愈合作用,因此敷料的更新换代受到各国研究者的高度重视。
1962年Winter[2]提出“湿性愈合理论”,即伤口处在湿润环境时表皮细胞向伤口的迁移速度加快,相较于处在干燥环境的伤口具有更快的愈合速度。基于这一理论,壳聚糖基复合材料、海藻酸盐(alginate)敷料等在烧伤、糖尿病足溃疡等的创面护理领域受到广泛关注[3-5]。海藻酸盐作为一种优秀的“湿疗法”水凝胶材料,能够有效促进创面愈合、缓解疼痛、减少瘢痕形成[6],且其对金黄色葡萄球菌、铜绿假单胞菌具有抗菌、抑菌能力[7]。郭兴锋等[8]将海藻酸盐制备的敷料用于海水浸泡伤的治疗,结果显示其可对创面起到促进愈合的效果。
海水具有高盐、高渗、高碱、低温等特点,能够加重组织损伤,抑制免疫功能,加重感染,因此理想的敷料应该能够阻隔海水对创面的进一步侵蚀。负压封闭引流装置(vacuum sealing drainage,VSD)可对创面进行有效引流,降低继发感染的发生率[9]。在一定负压条件下创面内氧分压可有一定程度的升高,有利于组织生长和愈合[10]。通过封闭引流能够起到有效隔离、保护创面的作用。理论上将VSD与海藻酸盐敷料联合使用既能够有效止血、抗菌,又能隔离海水侵蚀,尤其适用于海水浸泡创面的修复治疗,但目前尚未见此类研究报道。本研究观察了VSD与海藻酸盐敷料联合使用对大鼠海水浸泡创面的抗炎效果,以及其促血管新生和创面愈合的作用。
1 材料和方法 1.1 实验动物及主要试剂、仪器健康雌性SD大鼠10只(8周龄,体重为250~300 g)由海军军医大学(第二军医大学)实验动物中心提供[实验动物生产许可证号SCXK(沪)2017-0004]。本研究中动物实验经海军军医大学(第二军医大学)动物伦理委员会审查批准。VSD(货号MD-53331,日本Sumitomo Bakelite公司),海藻酸盐敷料(自制),人工海水(国家海洋局第三研究所配方:NaCl 26.52 g/L,MgCl2 22.45 g/L,MgSO4 3.31 g/L,CaCl2 1.14 g/L,KCl 0.73 g/L,NaHCO3 0.20 g/L,NaBr 0.083 g/L),TRIzol试剂(货号1596-026,美国Invitrogen公司),SYBR Green PCR试剂盒、反转录试剂盒(货号分别为K0223、K1622,美国ThermoFisher Scientific公司),DEPC水(货号R1600,上海基尔顿生物科技有限公司),兔抗血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(货号19003-1-AP,美国Proteintech公司),广谱二抗、DAB浓缩型试剂盒(货号分别为D-3004、FL-6001,上海长岛生物技术有限公司),显微镜(型号ECLIPSENi,日本Nikon公司)。
1.2 动物模型制备及分组参考文献[11]建立大鼠海水浸泡创面模型。将大鼠以10%水合氯醛(0.25 g/kg)腹腔注射麻醉后,俯卧位固定。使用尖刀于大鼠背部顶端切取全层皮肤,做直径2 cm的圆形创面,创面深度达深筋膜。然后将大鼠浸泡于配制好的人工海水中,头部保留在水面上,便于呼吸,浸泡6 h(人工海水温度21 ℃,实验室温度25 ℃)。造模后将大鼠随机分为两组,每组5只,实验组大鼠创面用海藻酸盐敷料覆盖联合VSD,对照组使用常规急救敷料覆盖。于造模后7 d观察创面组织,其间不行创面消毒及换药,不使用抗生素。
1.3 血常规检查于造模后第5天分别对两组大鼠取血,检测血常规指标,探究实验组及对照组大鼠的全身炎症反应程度。
1.4 qPCR实验于造模后第7天分别取两组大鼠创面部分组织,采用TRIzol法提取总RNA,经消除DNA、反转录(37 ℃ 60 min、85 ℃ 5 min、4 ℃ 5 min)获得cDNA。以cDNA为模板、GAPDH为内参照进行qPCR扩增(95 ℃ 10 min;95 ℃ 15 s,60 ℃ 45 s,共40个循环),采用2-ΔΔCt法计算IL-6和TNF-α mRNA相对表达量。GAPDH上游引物序列为5'-GGAGTCTACTGGCGTCTTCA-C-3',下游引物序列为5'-ATGAGCCCTTCCACG-ATGC-3',产物长度为237 bp;IL-6上游引物序列为5'-GTTGCCTTCTTGGGACTG-3',下游引物序列为5'-ACTGGTCTGTTGTGGGTG-3',产物长度为101 bp;TNF-α上游引物序列为5'-CCACGCTC-TTCTGTCTACTG-3',下游引物序列为5'-GCTAC-GGGCTTGTCACTC-3',产物长度为145 bp。
1.5 H-E染色观察于造模后第7天处死大鼠,切取创面及其周围2 cm×2 cm皮肤标本,用10%中性甲醛溶液固定。经脱水、透明、浸蜡、包埋后,制成5 μm厚切片,常规进行H-E染色、透明、封片,然后于显微镜下观察创面的组织学改变。
1.6 免疫组织化学染色观察取上述创面组织标本经固定、洗涤脱水、透明、浸蜡、包埋、切片处理后,进行免疫组织化学染色,然后于显微镜下拍照,观察创面组织中新生血管形成及VEGF的表达情况,用Image Pro Plus 6.0图像分析软件计算VEGF的平均光密度值。
1.7 统计学处理使用SPSS 21.0软件与GraphPad Prism 9.0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 两组大鼠血常规指标比较两组大鼠造模后第5天时血常规指标中,实验组大鼠的白细胞计数低于对照组(P<0.05),其余指标在两组间比较差异均无统计学意义(P均>0.05,表 1)。
|
|
表 1 两组大鼠血常规指标比较 Tab 1 Comparison of blood routine indexes of rats in 2 groups |
2.2 大鼠创面组织炎症因子表达
实验组大鼠创面组织中IL-6和TNF-α的mRNA相对表达水平均低于对照组(0.38±0.10 vs 1.00±0.19、0.36±0.14 vs 1.00±0.20,P均<0.01),表明实验组创面组织局部炎症浸润轻于对照组。
2.3 大鼠创面的组织学变化H-E染色结果显示,对照组大鼠创面组织未形成完整表皮层,缺乏表皮角质细胞,真皮层肉芽组织排列稀疏,散在分布多角形成纤维细胞,胶原纤维较粗大且呈不规则分布,其中可见新生血管及大量炎症细胞浸润;实验组大鼠创面组织可见明显的新生表皮层及外周网状角质层,较多新生血管垂直于皮肤分布,肉芽组织内炎症细胞数量较少,胶原纤维致密,与表皮层平行,可见成熟的长梭形成纤维细胞(图 1)。
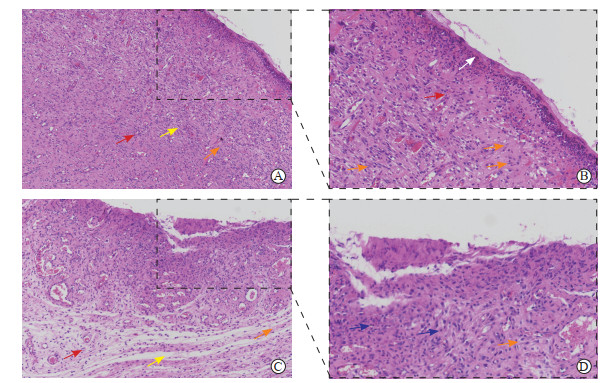
|
图 1 大鼠创面组织苏木精-伊红染色 Fig 1 Hematoxylin-eosin staining of wound tissues of rats A: Control group (the wounds were treated with first aid dressing) (100×); B: Magnified local region of Fig 1A (400×); C: Experimental group (the wounds were treated with alginate dressing+vacuum sealing drainage) (100×); D: Magnified local region of Fig 1C (400×). Red arrows indicate the newly developed blood vessels, orange arrows indicate fibroblasts, yellow arrows indicate collagen fibers, white arrow indicates new epidermal tissues, and blue arrows indicate inflammatory cells. |
2.4 大鼠创面组织中VEGF表达的变化
免疫组织化学染色结果(图 2)显示,对照组与实验组大鼠创面组织均可见VEGF表达,新生血管及其周围区域、血管内皮细胞和成纤维细胞内出现VEGF阳性染色,其中实验组细胞质内见大量棕黄色着色,对照组细胞质呈浅黄色着色。实验组大鼠创面组织中VEGF的平均光密度值高于对照组(0.258±0.013 vs 0.236±0.013,P<0.05)。两组创面组织均有新生血管形成,实验组微血管密度高于对照组。
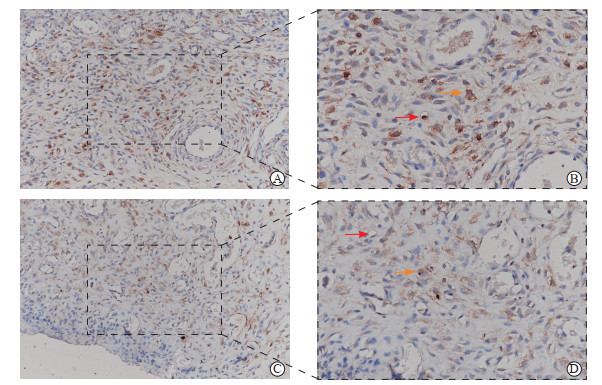
|
图 2 大鼠创面组织VEGF免疫组织化学染色 Fig 2 Immunohistochemical staining of VEGF in wound tissues of rats A: Control group (the wounds were treated with first aid dressing) (200×); B: Magnified local region of Fig 2A (400×); C: Experimental group (the wounds were treated with alginate dressing+vacuum sealing drainage) (200×); D: Magnified local region of Fig 2C (400×). Red arrows indicate the newly developed blood vessels, and orange arrows indicate VEGF dyeing granules. VEGF: Vascular endothelial growth factor. |
3 讨论
对于人体体液而言,海水是一种高渗、高钠和高碱的环境[11],这些特点使得浸泡在海水中的伤口创面发生一系列特殊变化[12]。动物实验研究发现,与普通伤口相比,海水浸泡伤口早期炎症反应严重、创面水肿明显、渗血渗液较多、肉芽组织生长缓慢,导致伤口愈合延迟。当伤口浸泡于海水时,局部组织的渗透压改变,导致细胞脱水,组织间蓄积大量渗出液致使局部肿胀并压迫血管,引起局部组织缺血缺氧、代谢障碍,反过来又加重了局部组织损伤,不利于局部修复与伤口愈合。除了这些不利的理化因素,张玲等[13]的动物实验研究表明,天然海水中还存在大量细菌,使伤口更容易感染,加重了救治难度。
从20世纪60年代Winter首次提出“湿性愈合理论”概念开始,创面敷料开始向功能化活性敷料发展,其基本功能要求是为伤口创面创造并维持一个湿润的愈合环境,在此基础上保护创面免受感染[14]。海藻酸盐具有优秀的水凝胶生物特性,是一种具有优秀锁水性的胶凝材料[15]。现有研究表明,海藻酸盐材料具有抑菌、止血、促进创面愈合、减轻瘢痕形成等作用,在医学创面修复领域被广泛用于各种缝合线、止血敷料、愈合敷料等的开发[16]。在此基础上制成的海藻酸盐敷料对于伤口愈合有着极佳的作用,能够促进伤口再生组织的生长、提高伤口愈合速度。
本研究所使用的自制海藻酸盐敷料具有良好的吸水性能,能够吸收20倍于自身体积的水(是传统纱布的5~7倍)[17]。敷料中的海藻酸钙在与伤口渗出物接触时和钠离子发生离子交换,形成水溶性的海藻酸钠,从而吸收大量伤口渗出物;形成的含大量水分的水凝胶可将水分输送给干燥的创面,为伤口提供湿润的微环境,加速伤口愈合,还能减少更换敷料时对新生组织的破坏,防止对伤口造成二次伤害。同时,离子交换时大量释放的钙离子可以加速止血,海藻酸分子链上的羧基可打破血液的电离平衡并激活凝血因子[18],这使得海藻酸盐敷料拥有优良的止血能力。相较于传统敷料,应用海藻酸盐材料制成的敷料有着更强的抗感染能力,研究表明其对金黄色葡萄球菌、铜绿假单胞菌均有抗菌、抑菌能力[7, 19]。然而,海水浸泡的恶劣环境对急救敷料有着更高的要求,除了更强的吸水性能、更好的止血能力及优异的抗菌效果外,还要能最大限度地隔绝携带大量外部污染、残留的“高渗”“高盐”海水对创面的持续不良影响,从而减少海水对创面的进一步侵扰。
20世纪90年代初,Fleischmann等[20]首次提出负压封闭引流技术,将封闭伤口和可控负压持续引流相结合使用能有效清除伤口部位渗血渗液、缓解组织肿胀、改善局部血液循环[21],该方法最早被应用于开放性骨折创面并取得良好疗效。1998年,裘华德和王彦峰[9]率先将该技术引入国内,以替代普通的引流管引流,经过改良与发展,在外科临床应用中取得了良好疗效。本实验以海藻酸盐敷料覆盖海水浸泡创面,联合使用VSD使创面与外界环境隔离,同时通过可调节的负压吸引使创面表面及腔隙内的脓液、液化坏死组织及残留的海水等及时排出,减少了海水对创面的持续影响,促进了创面愈合。
本实验观察到,实验组大鼠血常规指标中白细胞计数低于对照组,意味着使用新型海藻酸盐敷料联合VSD处理创面的实验组大鼠全身炎症反应情况好于对照组大鼠。实验组大鼠创面组织中炎症因子IL-6、TNF-α的mRNA相对表达量均低于对照组,提示实验组大鼠创面炎症反应轻于对照组大鼠。这说明本实验将VSD与海藻酸盐敷料联合使用有效实现了针对海水浸泡创面的抗炎作用。组织学观察结果证实,实验组肉芽组织内较少有炎症细胞浸润,胶原纤维排列紧密,创面愈合情况优于对照组。免疫组织化学染色结果表明,实验组大鼠创面组织中VEGF的平均光密度值高于对照组,VEGF作为一种具有高度特异性的血管生成因子,能够促进血管内皮细胞有丝分裂[22]和新血管生成,良好的局部血液循环能保证创面修复所需要的营养和氧,有利于坏死物质吸收、运输,控制局部感染,加速海水浸泡创面的愈合。
综上所述,本实验结果证明实验组抗炎效果、血管生成及创面愈合作用均优于对照组,VSD与海藻酸盐敷料联合使用具有较好的抗炎、促血管形成作用,有效提高了创面愈合的时间和效果。VSD与海藻酸盐敷料联合使用对海水浸泡创面主要有以下影响:(1)海藻酸盐敷料可以有效且迅速地吸收伤口渗血、脓液、海水并形成水凝胶,为创面创造湿润环境,加快伤口愈合。(2)海藻酸盐可以通过离子交换等机制激活凝血因子,并且通过优秀的吸水能力增大血液浓度、减缓血液流速,对创面进行有效止血。(3)VSD可使创面残存的海水及创面表面的污染脓液被及时吸出,从而有效抗感染并杜绝海水对创面的持续伤害。(4)VSD与海藻酸盐敷料联合使用有效促进创面组织中成纤维细胞的增殖和VEGF的合成,刺激微血管新生,加速伤口愈合。
基于以上特点,VSD与海藻酸盐敷料联合使用对海水浸泡的战伤创面的抗炎效果及后期愈合具有重要意义,但还需要进一步研究以确认实际效果,并通过优化大鼠模型使其更好地模拟现代海战伤员的复杂伤情;进一步改进VSD,减少引流对于出血量统计的影响,以期对VSD的止血性能进行分析;还可对海藻酸盐敷料加以改进,如添加抗菌药物、纳米颗粒、细胞黏附肽[23]、外泌体等药物与材料以进一步提高抗菌[24-25]、止血和促进伤口愈合的能力[26]。后期还可以通过商品化的海藻酸盐敷料结合VSD工具包进行临床研究。
| [1] |
宁浩勇, 孟宇宏, 刘肖, 王大鹏, 虞积耀. 火器伤合并海水浸泡后的愈合过程观察[J]. 中国医药导刊, 2015, 17: 86-88. |
| [2] |
WINTER G D. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young domestic pig[J]. Nature, 1962, 193: 293-294. DOI:10.1038/193293a0 |
| [3] |
宋文山, 王园园, 杜芬, 于德君, 代元坤, 李八方. 鱼皮胶原蛋白-壳聚糖复合海藻酸盐水凝胶敷料对烧烫伤创面的促愈合作用[J]. 中国海洋药物, 2019, 38: 1-6. |
| [4] |
周娟, 赖佳惠, 方诗莹, 杨陈, 王攀琛, 曾以妍, 等. 生物大分子敷料在慢性创面修复中的应用进展[J]. 食品与生物技术学报, 2021, 40: 1-8. |
| [5] |
张冬英, 卢思彤, 胡章, 李思东, 李普旺. 壳聚糖基复合水凝胶在创伤修复中的应用[J]. 应用化工, 2019, 48: 1734-1739. DOI:10.3969/j.issn.1671-3206.2019.07.051 |
| [6] |
张振坤, 李喆, 李亚, 王莹莹, 王亚苹, 周馨魁, 等. 海藻酸盐基水凝胶/敷料在创面愈合中的应用: 持续、动态与顺序释放[J]. 中国组织工程研究, 2021, 25: 638-643. DOI:10.3969/j.issn.2095-4344.2379 |
| [7] |
初晓夏. 海藻酸盐纤维医用止血敷料的评价研究[D]. 青岛: 青岛大学, 2016.
|
| [8] |
郭兴锋, 张伟, 侯春林, 魏长征, 刘双利. 几丁糖/海藻酸敷料对海水浸泡创面作用的实验研究[J]. 中国修复重建外科杂志, 2009, 23: 708-712. |
| [9] |
裘华德, 王彦峰. 负压封闭引流技术介绍[J]. 中国实用外科杂志, 1998, 18: 233-234. DOI:10.3321/j.issn:1005-2208.1998.04.026 |
| [10] |
WACKENFORS A, GUSTAFSSON R, SJÖGREN J, ALGOTSSON L, INGEMANSSON R, MALMSJÖ M. Blood flow responses in the peristernal thoracic wall during vacuum-assisted closure therapy[J]. Ann Thorac Surg, 2005, 79: 1724-1730. DOI:10.1016/j.athoracsur.2004.10.053 |
| [11] |
李玉涵, 窦桂芳, 甘慧, 顾若兰, 吴卓娜, 朱晓霞, 等. 防海水壳聚糖复合敷料对大鼠创伤愈合的促进作用[J]. 国际药学研究杂志, 2018, 45: 934-939, 948. |
| [12] |
李成刚, 姜楠. 腹部开放性海水浸泡伤的病理生理变化与救治策略[J]. 解放军医学院学报, 2021, 42: 350-352, 357. DOI:10.3969/j.issn.2095-5227.2021.03.022 |
| [13] |
张玲, 尚碧莲, 王厚照, 周友泉. 海水浸泡动物外伤创面的细菌培养与分析[J]. 人民军医, 2004, 47: 311-312. DOI:10.3969/j.issn.1000-9736.2004.06.001 |
| [14] |
PURNA S K, BABU M. Collagen based dressings: a review[J]. Burns, 2000, 26: 54-62. DOI:10.1016/S0305-4179(99)00103-5 |
| [15] |
BATISTA M P, GONÇALVES V S S, GASPAR F B, NOGUEIRA I D, MATIAS A A, GURIKOV P. Novel alginate-chitosan aerogel fibres for potential wound healing applications[J]. Int J Biol Macromol, 2020, 156: 773-782. DOI:10.1016/j.ijbiomac.2020.04.089 |
| [16] |
HU T Y, LO A C Y. Collagen-alginate composite hydrogel: application in tissue engineering and biomedical sciences[J/OL]. Polymers, 2021, 13: 1852. DOI: 10.3390/polym13111852.
|
| [17] |
DUMVILLE J C, O'MEARA S, DESHPANDE S, SPEAK K. Alginate dressings for healing diabetic foot ulcers[J/OL]. Cochrane Database Syst Rev, 2013, 2013: CD009110. DOI: 10.1002/14651858.CD009110.pub3.
|
| [18] |
BOATENG J S, MATTHEWS K H, STEVENS H N, ECCLESTON G M. Wound healing dressings and drug delivery systems: a review[J]. J Pharm Sci, 2008, 97: 2892-2923. DOI:10.1002/jps.21210 |
| [19] |
BOWLER P G, JONES S A, DAVIES B J, COYLE E. Infection control properties of some wound dressings[J]. J Wound Care, 1999, 8: 499-502. DOI:10.12968/jowc.1999.8.10.26356 |
| [20] |
FLEISCHMANN W, STRECKER W, BOMBELLI M, KINZL L. Vacuum sealing as treatment of soft tissue damage in open fractures[J]. Unfallchirurg, 1993, 96: 488-492. |
| [21] |
周琴, 李双双, 王青, 卢迎, 司艳宁, 王立娜, 等. 集束化护理干预对烧伤科住院患者负压封闭引流治疗中引流不畅的影响[J]. 中华烧伤杂志, 2019, 35: 148-152. |
| [22] |
NAITO H, IBA T, TAKAKURA N. Mechanisms of new blood-vessel formation and proliferative heterogeneity of endothelial cells[J]. Int Immunol, 2020, 32: 295-305. DOI:10.1093/intimm/dxaa008 |
| [23] |
ZHAI Z, XU K, MEI L, WU C, LIU J, LIU Z, et al. Co-assembled supramolecular hydrogels of cell adhesive peptide and alginate for rapid hemostasis and efficacious wound healing[J]. Soft Matter, 2019, 15: 8603-8610. DOI:10.1039/C9SM01296F |
| [24] |
LIAO C H, CHEN C S, CHEN Y C, JIANG N E, FARN C J, SHEN Y S, et al. Vancomycin-loaded oxidized hyaluronic acid and adipic acid dihydrazide hydrogel: Bio-compatibility, drug release, antimicrobial activity, and biofilm model[J]. J Microbiol Immunol Infect, 2020, 53: 525-531. DOI:10.1016/j.jmii.2019.08.008 |
| [25] |
SHAHRIARI-KHALAJI M, HONG S Y, HU G Q, JI Y, HONG F F. Bacterial nanocellulose-enhanced alginate double-network hydrogels cross-linked with six metal cations for antibacterial wound dressing[J/OL]. Polymers, 2020, 12: 2683. DOI: 10.3390/polym12112683.
|
| [26] |
SHAFEI S L, KHANMOHAMMADI M, HEIDARI R, GHANBARI H, TAGHDIRI NOOSHABADI V, FARZAMFAR S, et al. Exosome loaded alginate hydrogel promotes tissue regeneration in full-thickness skin wounds: an in vivo study[J]. J Biomed Mater Res A, 2020, 108: 545-556. DOI:10.1002/jbm.a.36835 |
 2022, Vol. 43
2022, Vol. 43


