颅内动脉粥样硬化性缺血性脑卒中是全世界范围内缺血性脑卒中的主要亚型之一,东亚人发病较西方人更普遍[1]。对于缺血性脑卒中复发的研究,目前主要侧重于动脉狭窄较严重的患者,事实上,在非狭窄性动脉粥样硬化斑块患者中严重缺血性脑卒中也是高发不良事件且有一定的复发率[2-3]。因此,对于非狭窄性动脉粥样硬化斑块药物治疗后患者的预后尚需要进一步研究。三维高分辨率磁共振管壁成像(three dimensional high resolution vessel wall magnetic resonance imaging,3D hr-VW-MRI)能够一站式对颅内外动脉进行成像,可更全面地评估斑块的总体负荷量。钆造影剂增强MRI检查观察到颅内动脉粥样硬化斑块强化与新生血管有关,也是炎症反应的表现之一[4],并且与缺血性脑卒中风险相关[5]。目前已有一些研究运用高分辨率磁共振管壁成像分析了动脉粥样硬化斑块特征与复发性缺血性脑卒中风险之间的关联,发现斑块强化和斑块负荷是复发性缺血性脑卒中的潜在影响因素[6-9]。然而,这些研究都是针对狭窄≥50%的患者,并没有对狭窄<50%患者的缺血性脑卒中复发高危因素进行分析。本研究应用3D hr-VW-MRI观察非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者的斑块影像学特征,并分析斑块特征与缺血性脑卒中复发的相关性。
1 资料和方法 1.1 病例资料前瞻性招募2019年1月至2021年8月于海军军医大学(第二军医大学)第一附属医院就诊的首次发生缺血性事件的颅内动脉粥样硬化患者。纳入标准:(1)首次发生脑梗死或短暂性脑缺血发作(transient ischemic attack,TIA);(2)发病4周内行首次3D hr-VW-MRI检查,3个月后随访时再次行3D hr-VW-MRI检查;(3)经计算机断层扫描血管造影(computed tomography angiography,CTA)或磁共振血管成像(magnetic resonance angiography,MRA)检查确定颅内动脉狭窄<50%;(4)年龄>18岁。排除标准:(1)非动脉粥样硬化性颅内动脉疾病(如动脉瘤、血管炎、烟雾病或颅内动脉夹层);(2)可疑心源性卒中;(3)CTA、MRA或超声检查确定颈内动脉颅外段狭窄≥50%;(4)CTA或经食管超声心动图检查确定主动脉弓粥样硬化斑块伴溃疡或主动脉弓管壁厚度≥4 mm;(5)凝血功能障碍、心力衰竭或呼吸衰竭;(6)颅内出血;(7)严重意识障碍;(8)图像质量差(基于总体信噪比、血管壁与周围组织之间的对比将图像质量分为4个等级,其中1分为差,2分为可接受,3分为质量好,4分为优秀);(9)存在MRI检查禁忌证。从临床病历系统中提取患者的临床资料,包括性别、年龄、高血压病史、糖尿病史、吸烟史、高脂血症病史和冠心病史。在入院时基于美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分(总分为0~42分,0分为正常,42分为重度神经功能受损)对患者进行神经功能评估。本研究通过海军军医大学(第二军医大学)第一附属医院伦理委员会审批(CHEC2018-092),且所有患者检查前均已签署知情同意书。
1.2 MRI检查所有患者均使用20通道头颈部线圈在3.0 T MRI检查平台(Skyra,德国Siemens Healthcare公司)完成MRI检查。头颅定位后行三维时间飞跃法磁共振血管成像(three dimensional time of flight magnetic resonance angiography,3D TOF-MRA)序列、弥散加权成像(diffusion weighted imaging,DWI)序列、T2加权成像(T2 weighted imaging,T2WI)、T1加权成像(T1 weighted imaging,TWI)和T1WI增强扫描,T2WI、T1WI及T1WI增强扫描均采用矢状面3D头颈联合容积扫描,T1WI采用各向同性可变翻转角快速自旋回波序列[10-11]。各序列扫描参数如下:(1)3D TOF-MRA序列,重复时间(repetition time,TR)为21 ms,回波时间(echo time,TE)为3.43 ms,层厚为0.7 mm,层数为144,视野为182 mm×200 mm,矩阵为331×384,扫描时间为4 min 58 s。(2)DWI序列,TR为5 300 ms,TE为74.3 ms,视野为240 mm×240 mm,矩阵为320×256,层数为50,层厚为1.5 mm,体素为1.5 mm×1.5 mm×1.5 mm,扫描时间为5 min 17 s。(3)T2WI序列,各向同性分辨率为0.5 mm,TR为1 500 ms,TE为150 ms,视野为256 mm×160 mm,矩阵为416×268,层数为240,回波链长度为100,体素为0.5 mm×0.5 mm×0.5 mm,扫描时间为6 min 27 s。(4)T1WI和T1WI增强扫描,各向同性分辨率为0.5 mm,TR为800 ms,TE为17 ms,视野为256 mm×160 mm,矩阵为416×268,层数为240,回波链长度为60,体素为0.5 mm×0.5 mm×0.5 mm,扫描时间为6 min 45 s。静脉注射造影剂钆喷酸葡胺(德国Bayer公司;高压注射器流速为2 mL/s,注射剂量为0.2 mmol/kg)后进行T1WI增强扫描。
1.3 图像后处理及分析所有图像均由1名有11年血管壁成像阅片经验的影像医学科医师在不了解患者信息的情况下,在3D hr-VW-MRI图像上对管壁定量特征进行评估测量。本研究的图像质量评分均≥3分。复发组是指随访期间出现复发性缺血性脑卒中事件的患者,稳定组是指随访期间未出现复发性缺血性脑卒中事件的患者。复发性缺血性脑卒中事件定义为患者首次发生缺血性脑卒中经规范药物治疗后,同侧责任血管区出现TIA或再次发生脑梗死(头颅MRI DWI显示高信号并出现相应缺血性脑卒中症状)。随访方式为电话随访或面对面访谈,再次出现的缺血性脑卒中临床症状包括TIA、头晕、头痛、言语不清、步态不稳、责任血管对应的肢体无力或麻木等。由另1名不知晓患者MRI检查结果的医师记录随访信息。责任斑块定义为患者出现缺血性脑卒中或TIA临床症状时,头颅MRI DWI图像中高信号即新鲜梗死灶同侧供血动脉上唯一或最狭窄处的斑块。
运用VesselMass软件(荷兰莱顿大学医学中心研发)进行图像后处理。如果层面未垂直于血管长轴方向,先对图像进行多平面重建获得横断面图像,然后进行测量分析。首先在T2WI图像上手动勾画出血管最狭窄层面、近端正常层面、远端正常层面的管腔内壁和外壁边界,然后勾画出整个斑块所在血管的所有层面的管腔内壁和外壁边界,最后将勾画好的轮廓复制到对应相同层面的T1WI平扫和增强扫描图像上,由软件自动得到以下定量参数:最狭窄层面管腔直径、正常层面管腔直径[(近端正常层面管腔直径+远端正常层面管腔直径)/2]、最狭窄层面管腔面积、最狭窄层面血管外壁面积、正常层面血管外壁面积、最狭窄层面最大管壁厚度、最狭窄层面最小管壁厚度、最狭窄层面增强前管壁信号强度、最狭窄层面增强后管壁信号强度、斑块体积、增强前整体管壁信号强度、增强后整体管壁信号强度;在相邻大脑皮质选择面积为15 mm2的圆形感兴趣区,测量增强前相邻大脑皮质信号强度、增强后相邻大脑皮质信号强度。根据以上参数计算狭窄率[(正常层面管腔直径-最狭窄层面管腔直径)/正常层面管腔直径×100%]、斑块负荷[(1-最狭窄层面管腔面积/最狭窄层面血管外壁面积)×100%]、血管重构指数(最狭窄层面血管外壁面积/正常层面血管外壁面积×100%)、偏心指数[(最狭窄层面最大管壁厚度-最狭窄层面最小管壁厚度)/最狭窄层面最大管壁厚度×100%]、最狭窄层面斑块强化率{[(最狭窄层面增强后管壁信号强度/增强后相邻大脑皮质信号强度)/(最狭窄层面增强前管壁信号强度/增强前相邻大脑皮质信号强度)-1]×100%}、斑块整体强化率{[(增强后整体管壁信号强度/增强后相邻大脑皮质信号强度)/(增强前整体管壁信号强度/增强前相邻大脑皮质信号强度)-1]×100%}。斑块内出血定义为T1WI平扫图像上斑块内信号强度/邻近肌肉组织信号强度>1.5。斑块在血管最狭窄层面T1WI平扫图像上的直方图特征包括均数、中位数、标准差、最大值、最小值、熵值、变异系数。
为了评估斑块影像学特征测量结果的可重复性,采用随机抽样法从以上42例患者中随机选择30例患者,由另1名有12年血管壁成像阅片经验的高年资影像医学科医师运用VesselMass软件在3D hr-VW-MRI图像上对以上定量参数进行测量。
1.4 统计学处理应用SPSS 20.0软件进行统计学分析。采用Shapiro-Wilk检验对计量资料进行正态性检验。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验;计数资料以例数和百分数表示,两组间比较采用Pearson χ2检验。运用组内相关系数(intraclass correlation coefficient,ICC)评估2名医师测量结果的一致性,ICC>0.75提示一致性好。检验水准(α)为0.05。
2 结果 2.1 患者基线资料2019年1月至2021年8月我院共有80例患者符合纳入标准,根据排除标准排除38例,其中合并动脉瘤15例,血管炎3例,颅内动脉夹层5例,经CTA、MRA或超声检查确定颅外动脉狭窄≥50% 8例,CTA或经食管超声心动图检查确定主动脉弓粥样硬化斑块伴溃疡或主动脉弓管壁厚度≥4 mm 5例,图像质量差或不佳2例(图像质量评分为1分者1例、2分者1例)。最终42例非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者入组,其中男31例、女11例,年龄为39~78岁,平均年龄为(60.38±10.97)岁,随访时间为90~375 d。复发组患者11例,稳定组患者31例。复发组患者平均年龄为(63.82±10.12)岁,男8例、女3例;稳定组患者平均年龄为(59.16±10.92)岁,男23例、女8例。复发组与稳定组患者的年龄、性别、吸烟史、饮酒史、糖尿病史、高血压病史、冠心病史、高脂血症病史、NIHSS评分差异均无统计学意义(P均>0.05)。两组患者的斑块位置分布差异有统计学意义(P=0.003),其中复发组位于大脑中动脉7例(63.6%)、颈内动脉颅内段3例(27.3%)、基底动脉1例(9.1%),稳定组中位于大脑中动脉17例(54.8%)、基底动脉14例(45.2%)。见表 1。
|
|
表 1 复发组与稳定组非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者的临床特征比较 Tab 1 Comparison of clinical characteristics of patients with ischemic stroke caused by non-stenotic intracranial atherosclerosis between recurrent and stable groups |
2.2 斑块的3D hr-VW-MRI影像学特征及T1WI平扫直方图特征
影像学特征分析结果(表 2)显示,复发组患者的偏心指数、最狭窄层面斑块强化率、斑块整体强化率、斑块体积及斑块内出血发生率均高于稳定组(P均<0.05);而两组患者的最狭窄层面管腔面积、最狭窄层面最大管壁厚度、最狭窄层面最小管壁厚度、狭窄率、斑块负荷、血管重构指数差异均无统计学意义(P均>0.05)。血管最狭窄层面T1WI平扫图像上斑块的直方图特征分析结果(表 2)显示,复发组的标准差和最大值均大于稳定组(P=0.017、0.005),而两组的均数、中位数、最小值、变异系数及熵值差异均无统计学意义(P均>0.05)。复发组患者的典型影像学表现见图 1。
|
|
表 2 复发组与稳定组非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者的3D hr-VW-MRI影像学特征及T1WI直方图特征比较 Tab 2 3D hr-VW-MRI imaging and T1WI histogram features of patients with ischemic stroke caused by non-stenotic intracranial atherosclerosis between recurrent and stable groups |
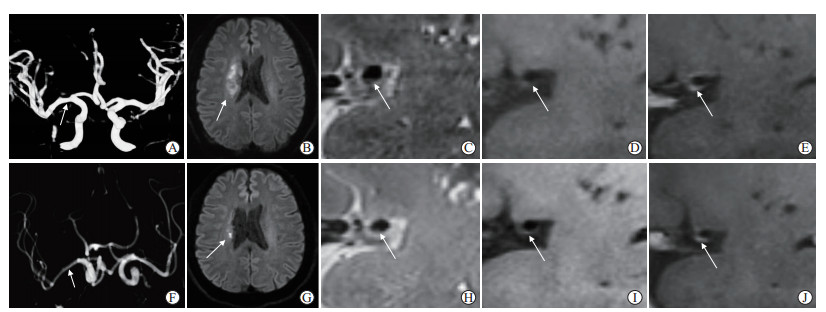
|
图 1 复发组1例非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者的影像学表现 Fig 1 Image findings of a patient with ischemic stroke caused by non-stenotic intracranial atherosclerosis in recurrent group Male, 53 years old, acute ischemic stroke. A-E: Baseline high resolution MRI. 3D TOF-MRA showed mild stenosis (arrow) at the proximal lesion of the M1 segment of right middle cerebral artery (A). DWI showed patchy new infarcts (arrow) in the right centrum semiovale (B). The thin arc plaques on the lower wall of the proximal lesion of the M1 segment of right middle cerebral artery showed hypointense to isointense (arrow) on T2WI (C), isointense (arrow) on T1WI (D) and obvious enhancement (arrow) on CE-T1WI (E). F-J: Follow-up high resolution MRI after 3 months of drug treatment. 3D TOF-MRA showed that the M1 segment of right middle cerebral artery (arrow) was thinner than the opposite side (F). DWI showed a spotted new infarct (arrow) in the right centrum semiovale (G). The thin arc plaques on the lower wall of the proximal lesion of the M1 segment of right middle cerebral artery showed hypointense to isointense (arrow) on T2WI (H), isointense (arrow) on T1WI (I) and obvious enhancement (arrow) on CE-T1WI (J), which was similar to the baseline results. MRI: Magnetic resonance imaging; 3D TOF-MRA: Three dimensional time of flight magnetic resonance angiography; DWI: Diffusion weighted imaging; T2WI: T2 weighted imaging; T1WI: T1 weighted imaging; CE-T1WI: Contrast enhanced-T1 weighted imaging. |
2.3 斑块影像学特征的重复性测量分析
2名影像医学科医师在斑块各影像学特征测量方面的一致性均较好(ICC均>0.75),见表 3。
|
|
表 3 2名测量者间斑块3D hr-VW-MRI影像学特征测量结果的一致性分析 Tab 3 Interreader agreement between 2 readers for plaque imaging characteristics of 3D hr-VW-MRI |
3 讨论
本研究采用3D hr-VW-MRI对首次发现的非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者进行随访,探讨与缺血性脑卒中复发相关的高危斑块特征。3D hr-VW-MRI能够一站式地对颅内外动脉进行成像,扫描时间短,降低了部分容积效应,能明确颅内斑块的总体负荷量,并可以通过多平面重建更清晰地显示动脉粥样硬化管壁的特征。
多项研究表明,斑块负荷是复发性缺血性脑卒中的独立危险因素[7, 9],且其中一项研究还通过3D hr-VW-MRI发现颅内斑块数量与复发性急性缺血性脑卒中独立相关[9]。多项多中心前瞻性MRA试验发现,颅内多发动脉粥样硬化与既往脑梗死或TIA患者的复发性缺血性脑卒中显著相关[10, 12-13]。此外,韩国一项大宗试验结果显示,相较于不伴动脉粥样硬化和仅累及单支血管的动脉粥样硬化患者,多发颅内动脉粥样硬化患者将更可能发生脑卒中复发,并且Cox风险回归分析结果表明硬化狭窄的血管每增加1支缺血性脑卒中的复发风险增加16%[11]。但既往研究多侧重分析重度狭窄或不同严重程度患者缺血性脑卒中复发的高危因素,尚未见仅针对狭窄<50%患者的随访研究。本研究对狭窄<50%的颅内动脉粥样硬化所致缺血性脑卒中患者进行随访,结果显示复发组患者的斑块体积较稳定组大。斑块负荷是最狭窄层面(单层)斑块面积的百分比,而斑块体积是斑块所有受累层面的面积累积,亦是斑块负荷的评价参数之一,且相较于单层面的斑块负荷,斑块体积更为客观。以上研究结果提示较高的动脉粥样硬化斑块负荷可能是血管危险因素控制不佳的结果,当然遗传因素亦可能是一个需要考虑的因素,但还需进一步研究以更好地阐明这些机制。
meta分析提示斑块强化是缺血性脑卒中复发的另一个独立危险因素[14-15]。斑块强化的主要原因在于新生血管增加、内皮渗透率升高,造影剂通过疏松的内皮进入斑块并滞留,导致斑块易损且呈现不同程度强化,因此斑块的强化程度与缺血性脑卒中事件的发生密切相关。Zhang等[16]在颅内动脉粥样硬化斑块的随访研究中进一步验证了这一观点,斑块中重度强化的患者缺血性脑卒中复发率高于轻度强化的患者,表明斑块强化程度可能是预测脑血管事件复发的重要指标,可用于风险分层和治疗方案的确定。本研究对非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者的斑块特征进行分析,结果显示复发组的斑块强化程度高于稳定组,也进一步证明狭窄程度较低的血管的斑块可能易损,从而导致缺血性脑卒中复发。
本研究中两组患者斑块的偏心指数均较高,大部分为偏心性斑块,但是两组斑块的偏心指数不同,复发组的偏心指数高于稳定组。Zhu等[17]及吴静静等[18]研究均表明偏心指数高的斑块更高危,患者更有可能发生缺血性脑卒中事件。原因主要是斑块的成分及所累及的血管壁大小不同。病理学研究表明,斑块中胶原纤维对斑块的易损性起调节作用,相较于同心性斑块,偏心性斑块中胶原纤维的数量显著减少[19],相应地,斑块的稳定性降低。因此,偏心性斑块更高危,患者更容易发生缺血性脑卒中复发。
动脉粥样硬化斑块内出血归因于脆弱的新生血管,内皮破裂会增加斑块壁应力,使斑块壁更加脆弱[20]。最初在颈内动脉粥样硬化斑块中观察到T1WI高信号为斑块内出血[21],随后研究发现颈内动脉斑块内出血是脑卒中复发的独立危险因素,与狭窄程度无关[22-23]。对颅内动脉粥样硬化斑块的高分辨率磁共振管壁成像资料进行的初步研究结果显示,在症状性颅内动脉粥样硬化患者中,斑块内出血的发生率与颈内动脉斑块内出血的发生率均较无症状颅内动脉粥样硬化患者高[24]。Xu等[25]在症状性大脑中动脉粥样硬化斑块中观察到T1WI高信号比无症状斑块中更为常见。在基底动脉狭窄患者的斑块中亦观察到,斑块内出血在有症状的动脉粥样硬化患者中的发生率高于无症状患者(42.3% vs 21.4%),并且斑块内出血的相对危险度为1.64[26]。本课题组前期对基底动脉斑块特征进行分析也得出了相似的结论,即无论在任何狭窄程度的动脉粥样硬化斑块中,基底动脉斑块内出血更有可能提示症状性动脉粥样硬化病变[27]。此外,近期一项关于颈内动脉斑块内出血与血管狭窄程度的研究发现,在管腔轻度狭窄血管的斑块中,斑块内出血是脑卒中事件的独立预测因素,但是在中重度狭窄血管的斑块中并不是独立预测因素[28]。本研究结果显示,复发组的斑块内出血发生率高于稳定组,与既往颈内动脉斑块内出血的研究结果相符。
本研究中斑块在血管最狭窄层面T1WI平扫图像上的直方图特征分析显示,复发组的标准差及最大值均大于稳定组,说明斑块信号的离散程度较大。离散度越大,斑块越松散,结构也越复杂,可能包含脂质核心、钙化、斑块内出血、纤维帽等多种成分,因此斑块的稳定性相对较差,更容易发生破裂而引起血栓形成,从而更易导致缺血性脑卒中复发。
本研究存在以下不足:(1)样本量较小,进一步分析独立危险因素存在局限,后期需要扩大样本量进行分析。(2)本研究虽然是一项前瞻性随访研究,但是患者的随访时间不同,有的患者随访时间长,有的较短,未能按照前期研究方案预定的随访时间施行。(3)目前临床上对于动脉粥样硬化斑块的用药原则各异,不同的患者有不同的用药原则,甚至不同药物治疗的起效时间不同,随访斑块对药物的反应也存在差异,在后续研究中需要与临床医师进一步沟通以将这些偏倚降到最小。
综上所述,本研究基于3D hr-VW-MRI评估了非狭窄性颅内动脉粥样硬化所致缺血性脑卒中患者斑块的影像学特征及T1WI平扫图像的直方图特征,复发组患者的偏心指数、最狭窄层面斑块强化率、斑块整体强化率、斑块体积、斑块内出血发生率,以及直方图标准差和最大值均高于稳定组。综合这些斑块特征,可以早期预测斑块的易损性,更好地为临床评估缺血性脑卒中复发事件提供依据。
| [1] |
KIM H J, CHOI E H, CHUNG J W, KIM J H, KIM Y S, SEO W K, et al. Luminal and wall changes in intracranial arterial lesions for predicting stroke occurrence[J]. Stroke, 2020, 51: 2495-2504. DOI:10.1161/STROKEAHA.120.030012 |
| [2] |
MAZIGHI M, LABREUCHE J, GONGORA-RIVERA F, DUYCKAERTS C, HAUW J J, AMARENCO P. Autopsy prevalence of intracranial atherosclerosis in patients with fatal stroke[J]. Stroke, 2008, 39: 1142-1147. DOI:10.1161/STROKEAHA.107.496513 |
| [3] |
BODLE J D, FELDMANN E, SWARTZ R H, RUMBOLDT Z, BROWN T, TURAN T N. High-resolution magnetic resonance imaging: an emerging tool for evaluating intracranial arterial disease[J]. Stroke, 2013, 44: 287-292. DOI:10.1161/STROKEAHA.112.664680 |
| [4] |
RUDD J H, FAYAD Z A. Imaging atherosclerotic plaque inflammation[J]. Nat Clin Pract Cardiovasc Med, 2008, 5(Suppl 2): S11-S17. |
| [5] |
QIAO Y, ZEILER S R, MIRBAGHERI S, LEIGH R, URRUTIA V, WITYK R, et al. Intracranial plaque enhancement in patients with cerebrovascular events on high-spatial-resolution MR images[J]. Radiology, 2014, 271: 534-542. DOI:10.1148/radiol.13122812 |
| [6] |
KIM J M, JUNG K H, SOHN C H, MOON J, SHIN J H, PARK J, et al. Intracranial plaque enhancement from high resolution vessel wall magnetic resonance imaging predicts stroke recurrence[J]. Int J Stroke, 2016, 11: 171-179. DOI:10.1177/1747493015609775 |
| [7] |
RAN Y C, WANG Y T, ZHU M, WU X, MALHOTRA A, LEI X W, et al. Higher plaque burden of middle cerebral artery is associated with recurrent ischemic stroke: a quantitative magnetic resonance imaging study[J]. Stroke, 2020, 51: 659-662. DOI:10.1161/STROKEAHA.119.028405 |
| [8] |
SHI Z, LI J, ZHAO M, ZHANG X F, DEGNAN A J, MOSSA-BASHA M, et al. Progression of plaque burden of intracranial atherosclerotic plaque predicts recurrent stroke/transient ischemic attack: a pilot follow-up study using higher-resolution MRI[J]. J Magn Reson Imaging, 2021, 54: 560-570. DOI:10.1002/jmri.27561 |
| [9] |
SUN B B, WANG L L, LI X, ZHANG J, ZHANG J J, LIU X S, et al. Intracranial atherosclerotic plaque characteristics and burden associated with recurrent acute stroke: a 3D quantitative vessel wall MRI study[J/OL]. Front Aging Neurosci, 2021, 13: 706544. DOI: 10.3389/fnagi.2021.706544.
|
| [10] |
ZHU B H, LIU H H, PAN Y S, JING J, LI H, ZHAO X Q, et al. Elevated neutrophil and presence of intracranial artery stenosis increase the risk of recurrent stroke[J]. Stroke, 2018, 49: 2294-2300. DOI:10.1161/STROKEAHA.118.022126 |
| [11] |
KIM B S, CHUNG P W, PARK K Y, WON H H, BANG O Y, CHUNG C S, et al. Burden of intracranial atherosclerosis is associated with long-term vascular outcome in patients with ischemic stroke[J]. Stroke, 2017, 48: 2819-2826. DOI:10.1161/STROKEAHA.117.017806 |
| [12] |
WANG Y J, ZHAO X Q, LIU L P, SOO Y O, PU Y H, PAN Y S, et al. Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China: the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke, 2014, 45: 663-669. DOI:10.1161/STROKEAHA.113.003508 |
| [13] |
SUN P, LIU L P, PAN Y S, WANG X W, MI D H, PU Y H, et al. Intracranial atherosclerosis burden and stroke recurrence for symptomatic intracranial artery stenosis (sICAS)[J]. Aging Dis, 2018, 9: 1096-1102. DOI:10.14336/AD.2018.0301 |
| [14] |
GUPTA A, BARADARAN H, AL-DASUQI K, KNIGHT-GREENFIELD A, GIAMBRONE A E, DELGADO D, et al. Gadolinium enhancement in intracranial atherosclerotic plaque and ischemic stroke: a systematic review and meta-analysis[J/OL]. J Am Heart Assoc, 2016, 5: e003816. DOI: 10.1161/JAHA.116.003816.
|
| [15] |
LEE H N, RYU C W, YUN S J. Vessel-wall magnetic resonance imaging of intracranial atherosclerotic plaque and ischemic stroke: a systematic review and meta-analysis[J/OL]. Front Neurol, 2018, 9: 1032. DOI: 10.3389/fneur.2018.01032.
|
| [16] |
ZHANG X F, CHEN L G, LI S, SHI Z, TIAN X, PENG W J, et al. Enhancement characteristics of middle cerebral arterial atherosclerotic plaques over time and their correlation with stroke recurrence[J]. J Magn Reson Imaging, 2021, 53: 953-962. DOI:10.1002/jmri.27351 |
| [17] |
ZHU X J, LIU L, HE X X, ZHANG X B, HU L B, DU B, et al. Wall thickening pattern in atherosclerotic basilar artery stenosis[J]. Neurol Sci, 2016, 37: 269-276. DOI:10.1007/s10072-015-2404-x |
| [18] |
吴静静, 贾琳, 王云玲, 韩秉艳, 贾文霄. 三维高分辨率磁共振成像评估大脑中动脉粥样硬化高危斑块特征与缺血性事件复发的相关性[J]. 临床放射学杂志, 2020, 39: 1444-1447. |
| [19] |
QIAO Y, ETESAMI M, ASTOR B C, ZEILER S R, TROUT H H 3rd, WASSERMAN B A. Carotid plaque neovascularization and hemorrhage detected by MR imaging are associated with recent cerebrovascular ischemic events[J]. AJNR Am J Neuroradiol, 2012, 33: 755-760. DOI:10.3174/ajnr.A2863 |
| [20] |
HUANG X Y, TENG Z Z, CANTON G, FERGUSON M, YUAN C, TANG D L. Intraplaque hemorrhage is associated with higher structural stresses in human atherosclerotic plaques: an in vivo MRI-based 3D fluid-structure interaction study[J/OL]. Biomed Eng Online, 2010, 9: 86. DOI: 10.1186/1475-925X-9-86.
|
| [21] |
MOODY A R, MURPHY R E, MORGAN P S, MARTEL A L, DELAY G S, ALLDER S, et al. Characterization of complicated carotid plaque with magnetic resonance direct thrombus imaging in patients with cerebral ischemia[J]. Circulation, 2003, 107: 3047-3052. DOI:10.1161/01.CIR.0000074222.61572.44 |
| [22] |
MCNALLY J S, MCLAUGHLIN M S, HINCKLEY P J, TREIMAN S M, STODDARD G J, PARKER D L, et al. Intraluminal thrombus, intraplaque hemorrhage, plaque thickness, and current smoking optimally predict carotid stroke[J]. Stroke, 2015, 46: 84-90. DOI:10.1161/STROKEAHA.114.006286 |
| [23] |
ALTAF N, MACSWEENEY S T, GLADMAN J, AUER D P. Carotid intraplaque hemorrhage predicts recurrent symptoms in patients with high-grade carotid stenosis[J]. Stroke, 2007, 38: 1633-1635. DOI:10.1161/STROKEAHA.106.473066 |
| [24] |
TURAN T N, BONILHA L, MORGAN P S, ADAMS R J, CHIMOWITZ M I. Intraplaque hemorrhage in symptomatic intracranial atherosclerotic disease[J/OL]. J Neuroimaging, 2011, 21: e159-e161. DOI: 10.1111/j.1552-6569.2009.00442.x.
|
| [25] |
XU W H, LI M L, GAO S, NI J, YAO M, ZHOU L X, et al. Middle cerebral artery intraplaque hemorrhage: prevalence and clinical relevance[J]. Ann Neurol, 2012, 71: 195-198. DOI:10.1002/ana.22626 |
| [26] |
YU J H, KWAK H S, CHUNG G H, HWANG S B, PARK M S, PARK S H. Association of intraplaque hemorrhage and acute infarction in patients with basilar artery plaque[J]. Stroke, 2015, 46: 2768-2772. |
| [27] |
ZHU C, TIAN X, DEGNAN A J, SHI Z, ZHANG X, CHEN L, et al. Clinical significance of intraplaque hemorrhage in low- and high-grade basilar artery stenosis on high-resolution MRI[J]. AJNR Am J Neuroradiol, 2018, 39: 1286-1292. |
| [28] |
LARSON A S, BRINJIKJI W, SAVASTANO L, RABINSTEIN A A, SABA L, HUSTON J, et al. Carotid intraplaque hemorrhage and stenosis: at what stage of plaque progression does intraplaque hemorrhage occur, and when is it most likely to be associated with symptoms?[J]. AJNR Am J Neuroradiol, 2021, 42: 1285-1290. |
 2022, Vol. 43
2022, Vol. 43


