肥厚型梗阻性心肌病(hypertrophic obstructive cardiomyopathy,HOCM)是一种遗传性心血管疾病[1],以左心室壁异常肥厚(≥15 mm)导致左心室流出道梗阻为特征,患者的症状明显,容易出现心源性猝死、心力衰竭或血栓形成等致命性并发症,小儿年病死率高达4%~6%,成人年病死率为2%~4%[2]。欧洲心脏病协会建议,对有明显症状、药物治疗无效或心源性猝死风险高的HOCM患者首选室间隔心肌切除术[3],但因术中心内结构暴露困难,若室间隔切除过少则左心室流出道疏通不佳,而切除过多可能导致房室传导阻滞、医源性室间隔缺损等[3]。为精准切除肥厚室间隔组织,本研究设计了一种新型HOCM手术系统(专利号202110515953.1),并通过动物实验验证其有效性。
1 材料和方法 1.1 实验动物模型制备与HOCM诊断标准4个月龄雄性广西巴马小型猪[普通级,泰州泰和生物科技有限公司,实验动物生产许可证号SCXK(苏)2017-0010]8只,体重为(18.61±1.21)kg,禁食过夜。以盐酸氯胺酮12 mg/kg、阿托品0.04 mg/kg、甲苯噻嗪1.0 mg/kg诱导麻醉,再行双腔气管插管,术中以2.5%异氟醚、1.8% O2和0.5% N2O维持麻醉。于左侧第3肋间取切口行降主动脉缩窄术[4],术中将8枚直径9 mm、长度20 mm的Cordis裸金属支架(美国强生公司)分别植入8只猪的降主动脉外。为防止急性或亚急性支架血栓形成,支架植入后予氯吡格雷75 mg/d(法国Sanofi公司)、阿司匹林100 mg/d(德国Bayer公司)口服1个月,然后继续予阿司匹林100 mg/d长期治疗。支架植入后4个月,采用Vivid 7型心脏超声仪(美国GE Healthcare公司)测量室间隔厚度、舒张末期左心室后壁厚度、左心室流出道平均压差[正常值<30 mmHg(1 mmHg=0.133 kPa),>30 mmHg提示存在左心室流出道梗阻],在心尖四腔心切面获取二尖瓣血流频谱,测量二尖瓣舒张早期血流速度峰值(E)、舒张晚期血流速度峰值(A),获得E/A值(正常值>1,≤1提示心脏舒张功能异常),同时测量舒张早期二尖瓣环运动速度(E'),获得E/E′值(正常值<8,>15提示心脏舒张功能不全,若为8~15则根据E/A值等其他指标进行综合判断)。当模型猪左心室壁厚度≥15 mm、左心室流出道梗阻且心脏超声提示心脏舒张功能异常,则诊断为HOCM。
1.2 分组与实验方法HOCM模型猪制备完毕后,采用完全随机设计将8只HOCM猪随机分为对照组和实验组,每组4只。对制备成功的HOCM模型猪再次进行全身麻醉,采用单腔气管插管、正中开胸,予肝素3 mg/kg静脉推注后常规建立体外循环,经主动脉根部灌注心脏停搏液,右上肺静脉放置左心引流,行经主动脉切口的改良扩大Morrow手术[5]。自主动脉右冠瓣中点下方4 mm纵行切向左心室心尖,切除长度为50~60 mm; 向左侧切至二尖瓣前交界附近,切除宽度为20~30 mm,切除厚度为肥厚室间隔厚度的40%~50%;累及二尖瓣前叶的异常腱索和肌束一并予以切除; 切除室间隔至心尖的异常肌束、前乳头肌体部和左心室侧壁、室间隔之间的肌束或纤维异常连接,彻底松解前乳头肌体部。切除肥厚室间隔组织时,对照组应用镰状刀片等传统手术器械,实验组应用新型精准手术系统,两组均由同一团队开展手术。于术前24 h、术后72 h由同一医师进行心脏超声检查,测定左心房前后径、室间隔厚度、左心室舒张末期内径、左心室流出道平均压差、左心室射血分数、二尖瓣收缩期前向活动(systolic anterior motion,SAM)征、二尖瓣反流量,并采用化学发光法(美国强生公司5600免疫生化仪)检测血清心力衰竭评估指标N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)的水平。
1.3 新型精准手术系统由主体及操作手杆组成。如图 1A所示,主体由外套、传动轴、可活动关节、倒“T”型推送固件、微型超声探头、可伸缩一次性刀片、切除心肌留存盒组成。传动轴远端与微型超声探头、可伸缩一次性刀片连接,可在切除肥厚室间隔组织的同时,利用心脏超声实时监测剩余室间隔的厚度; 传动轴中部与倒“T”型推送固件连接,可将切除的心肌组织推送至切除心肌留存盒中,避免主体部分内部堵塞; 传动轴近端为可活动关节,使主体部分更贴合室间隔组织。操作手杆如图 1B所示,前部连接卡槽可与主体的可活动关节对接; 中部有刻度窗,可选择单次切割室间隔组织的厚度(1、2、3、4、5 mm); 中后部为关节调节按钮,按下按钮后可随意调节主体的可活动关节的角度,松开按钮即锁定其角度; 后方为电源和超声连接线; 下方扳手为旋切开关,扳下即实现主体的可伸缩一次性刀片旋切1次(初始状态下,微型超声探头贴合心肌,扳下开关后传动轴旋转360°,可伸缩一次性刀片完成1次旋切,微型超声探头再次贴合心肌)。
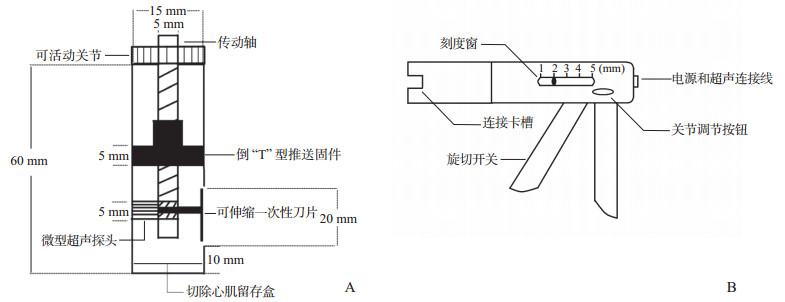
|
图 1 新型精准手术系统主体(A)和操作手杆(B)部分模式图 |
1.4 统计学处理
应用SPSS 21.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,同组术前、术后比较采用配对t检验。计数资料以只数表示,两组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 HOCM模型猪心脏超声检查支架植入后4个月,室间隔厚度和舒张末期左心室后壁厚度分别为(20.8±3.8)mm和(15.0±1.9)mm,左心室流出道平均压差为(53.3±3.7)mmHg,E/A值为0.9±0.5,E/E′值为9.4±1.6,提示HOCM模型猪制备成功。
2.2 手术时间对照组和实验组术中的体外循环时间分别为(145.2±25.8)min和(135.2±22.6)min,主动脉阻断时间分别为(102.0±20.1)min和(91.2±16.1)min。实验组术中的体外循环时间、主动脉阻断时间均短于对照组(P均<0.05)。
2.3 手术效果评价术后对照组和实验组的室间隔厚度、左心室流出道平均压差、左心房前后径、左心室射血分数、二尖瓣反流量和血清NT-proBNP水平均低于术前(P均<0.05)。术后对照组与实验组左心室舒张末期内径与术前相比差异均无统计学意义(P均>0.05)。术后实验组的室间隔厚度、左心室流出道平均压差和血清NT-proBNP水平均低于术后对照组(P均<0.05)。术后对照组、实验组的二尖瓣SAM征均消失,与术前相比差异均有统计学意义(P均<0.05)。见表 1。
|
|
表 1 两组HOCM模型猪手术前后心脏超声和心力衰竭评估指标的比较 |
2.4 术后早期死亡和并发症发生情况
对照组和实验组HOCM猪在改良扩大Morrow术后72 h均存活,无早期死亡。术后72 h心脏超声和心电图检查提示,对照组和实验组各有1只HOCM猪发生主动脉瓣损伤,均无左束支传导阻滞和医源性室间隔穿孔。
3 讨论HOCM治疗的主要目的是缓解症状、改善运动耐量和预防猝死,药物治疗主要是应用β-受体阻滞剂或钙通道阻滞剂减少梗阻和改善舒张功能障碍。心脏起搏治疗(DDD模式)仅被推荐用于高危猝死患者[3]。室间隔酒精消融术被推荐用于高龄或有外科手术禁忌证而不适合行室间隔心肌切除术的患者[6]。对于症状明显、药物治疗无效或心源性猝死风险高的HOCM患者,首选室间隔心肌切除术,即Morrow手术[5-6],但该术式至今仍未能在心脏外科普及,其技术难点主要在于心内结构暴露、精准切除困难,术者完全凭经验切除肥厚室间隔,难以把控切除范围,容易出现一系列并发症。例如室间隔切除过多可导致医源性室间隔穿孔(3%)或传导束损伤(2.5%~10%),室间隔切除过少则可能因术后残余梗阻而再次手术(5%)或因反复牵拉导致医源性主动脉瓣损伤(5%~50%)[2]等。总之,Morrow手术及其改良术式仍属于传统经验外科的范畴,不甚符合精准外科的要求。
精准外科是一种基于高度确定性的外科实践,其追求病灶清除、脏器保护和损伤控制3个要素的精确平衡,致力外科治疗的安全、高效和微创的多目标优化,最终实现病患康复最大化的目标[7]。本实验结果表明,与传统手术器械相比,新型精准手术系统可调节单次切割室间隔组织的厚度,能在微型超声探头等可视化组件的协助下实时监测剩余室间隔,从而使外科医师按预定计划准确控制切除范围、最大化地清除多余的室间隔组织,有较高的病灶切除可控性和精准性; 能在有效疏通左心室流出道的同时,显著降低血清NT-proBNP水平,有效保护心脏功能; 并能显著缩短手术时间,也不会增加术后早期死亡率及并发症发生率,改善了近期疗效。因此,与传统手术器械相比,新型精准手术系统更贴合精准外科的目标与要求。但由于经费有限,本实验动物数较少,且未能对远期疗效进行随访,拟在下一步研究中扩大样本量并进行术后远期疗效观察。
| [1] |
MARIAN A J. Molecular genetic basis of hypertrophic cardiomyopathy[J]. Circ Res, 2021, 128: 1533-1553. DOI:10.1161/CIRCRESAHA.121.318346 |
| [2] |
MARIAN A J, BRAUNWALD E. Hypertrophic cardiomyopathy: genetics, pathogenesis, clinical manifestations, diagnosis, and therapy[J]. Circ Res, 2017, 121: 749-770. DOI:10.1161/CIRCRESAHA.117.311059 |
| [3] |
MEMBERS A F, ELLIOTT P M, ANASTASAKIS A, BORGER M A, BORGGREFE M, CECCHI F, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2014, 35: 2733-2779. DOI:10.1093/eurheartj/ehu284 |
| [4] |
GYÖNGYÖSI M, PAVO N, LUKOVIC D, ZLABINGER K, SPANNBAUER A, TRAXLER D, et al. Porcine model of progressive cardiac hypertrophy and fibrosis with secondary postcapillary pulmonary hypertension[J/OL]. J Transl Med, 2017, 15: 202. DOI: 10.1186/s12967-017-1299-0.
|
| [5] |
SAMEH S, GAMAL M. Transaortic extended left ventricular septal myectomy in an adult with hypertrophic obstructive cardiomyopathy[J/OL]. Multimed Man Cardiothorac Surg MMCTS, 2020, 2020. DOI: 10.1510/mmcts.2020.074.
|
| [6] |
OSMAN M, KHEIRI B, OSMAN K, BARBARAWI M, ALHAMOUD H, ALQAHTANI F, et al. Alcohol septal ablation vs myectomy for symptomatic hypertrophic obstructive cardiomyopathy: systematic review and meta-analysis[J]. Clin Cardiol, 2019, 42: 190-197. DOI:10.1002/clc.23113 |
| [7] |
董家鸿, 张宁. 精准外科[J]. 中华外科杂志, 2015, 53: 321-323. |
 2022, Vol. 43
2022, Vol. 43


