2. 海军军医大学(第二军医大学)第三附属医院肝外四科,上海200438
2. Department of Hepatic Surgery (Ⅳ), The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200438, China
肝细胞癌(hepatocellular carcinoma,HCC)是我国常见的恶性肿瘤,其发病率和死亡率居所有恶性肿瘤的前列[1]。我国是肝癌大国,全球每年超过50%的新发病例发生在我国[2]。肝癌切除术是目前临床治疗HCC最有效的治疗手段,但术后复发率较高,预后面临巨大挑战[3]。
不同部位的HCC其手术切除方式不同,可分为解剖性肝切除和非解剖性肝切除、局部切除和扩大范围切除等。既往研究认为相较于非解剖性肝切除,解剖性肝切除可以获得更好的长期预后[4-5]。但无论哪种肝切除方式,根治性切除是所有HCC的手术原则。对于左外叶HCC,左外叶切除和左半肝切除是常见的手术方式,可以行腹腔镜下左外叶或左半肝切除,也可以行开腹左外叶或左半肝切除[6-8]。有研究报道,腹腔镜下左半肝切除相较于左外叶切除可能获得更好的总体生存[8],但左外叶HCC行开腹左外叶切除或左半肝切除对术后并发症、总体生存和肿瘤复发的影响尚不明确。因此本研究系统性分析了不同肝切除方式对左外叶HCC患者术后并发症、总体生存和肿瘤复发的影响,以期为左外叶HCC患者选择左外叶切除还是左半肝切除提供理论支持。
1 资料和方法 1.1 研究对象选取2011年1月至2013年1月于我院接受左外叶切除术或左半肝切除术的278例左外叶HCC患者。患者的随访截止时间为2017年5月,中位随访时间为55.1(5.8~70.0)个月。所有患者术前均常规接受检验、检查,评估手术耐受性和肿瘤的可切除性。纳入标准:(1)术前肝功能评估Child-Pugh A级;(2)肿瘤仅位于左外叶(肝Ⅱ段或Ⅲ段)[9],无其他肝段肿瘤;(3)肿瘤单发或多发,未侵犯门静脉矢状部;(4)肿瘤无大血管侵犯,无膈肌等周边脏器侵犯,无其他部位转移灶;(5)肿瘤完整切除,手术切缘为阴性;(6)术后病理证实为HCC。排除标准:(1)肿瘤位于左外叶以外的部位;(2)伴有膈肌侵犯或其他部位转移灶;(3)术前接受其他抗肿瘤治疗;(4)切缘阳性,手术为非根治性手术。
本研究中手术切缘分为宽切缘和窄切缘,宽切缘指手术切缘距离肿瘤≥1 cm,窄切缘指手术切缘距离肿瘤<1 cm[10]。
所有患者在参与本研究前均签署书面知情同意书,同意将诊治期间的临床病理资料用于医学研究。
1.2 肝切除方式左外叶切除:术中切断肝圆韧带,用丝线结扎断端。沿门静脉矢状支左侧用超声刀依次由下至上逐步离断肝组织、打薄肝组织,或用血管钳依次分离肝内管道,予以丝线结扎,再用切割闭合器切闭剩余肝组织,肝Ⅱ、Ⅲ段的Glisson蒂及左肝静脉。游离左、右侧三角韧带及冠状韧带,完整离断左外叶,肝断面彻底止血[9]。
左半肝切除:分离附着在左半肝上的结缔组织和韧带,切断左三角韧带、肝十二指肠韧带等。切断、结扎肝圆韧带、镰状韧带。分离第一肝门和第二肝门,明确中肝静脉,沿中肝静脉左侧缘0.5 cm处切开肝包膜,用刀背钝性分离肝实质,将所遇的左肝脉管依次用弯止血钳钳夹后切断、结扎。再从肝的脏面前缘向肝实质内钝性分离,最后切断门静脉左支,完全离断左半肝,肝断面彻底止血[9]。
1.3 术后随访所有患者在术后均接受常规复查,复查项目包括血常规、肝肾功能、肿瘤指标[癌胚抗原(carcinoembryonic antigen,CEA)、CA19-9、甲胎蛋白(alpha-fetoprotein,AFP)],腹部B超、腹部增强MRI或CT等。复查频率为术后2年内每2个月复查1次,2年后改为每3个月复查1次。将AFP再次异常升高或影像学出现新发肿块定义为肿瘤复发。术后根据肿瘤大小、个数、微血管侵犯(microvascular invasion,MVI)等指标评估肿瘤复发风险较大的患者,建议术后1个月行预防性经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)。本研究中的术后并发症根据Clavien-Dindo标准[11]进行评定。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析。计量资料以中位数(范围)表示,采用Mann-Whitney U检验。计数资料以例数和百分数表示,采用χ2检验。采用Kaplan-Meier法绘制生存、复发曲线,采用单因素和多因素Cox回归分析患者术后总体生存和肿瘤复发的独立危险因素。总体生存时间定义为手术至死亡或者最后1次随访的时间,肿瘤复发时间定义为手术至术后第1次诊断复发或转移的时间。检验水准(α)为0.05。
2 结果 2.1 患者基本临床病理特征278例左外叶HCC患者中行左外叶切除术223例,行左半肝切除术55例。患者中位年龄为52.0(18.0~79.0)岁,男性231例(83.1%),糖尿病患者14例(5.0%),乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)阳性236例(84.9%),HBV-DNA>2 000 IU/mL 153例(55.0%),术前接受抗病毒治疗17例(6.1%),术中输血15例(5.4%),窄切缘93例(33.5%),肝硬化149例(53.6%),肿瘤多发43例(15.5%),术后病理有MVI 118例(42.4%),肿瘤包膜完整147例(52.9%),肿瘤分化Ⅲ/Ⅳ级196例(70.5%),术后接受辅助性TACE 106例(38.1%)。血小板、凝血酶原时间、总胆红素、人血白蛋白、丙氨酸转氨酶、AFP、CEA、CA19-9、肿瘤直径中位值分别为150.5(65.0~419.0)×109/L、12.0(10.0~15.7)s、14.1(4.4~52.8)μmol/L、40.1(32.1~47.8)g/L、33.3(6.6~102.4)U/L、73.3(0.8~92 749.0)µg/L、2.7(0.4~33.6)µg/L、18.7(0.6~97.4)U/mL、4.2(2.0~11.4)cm。左外叶切除的窄切缘比例明显高于左半肝切除患者,差异有统计学意义[41.7%(93/223)vs 0(0/55),P<0.001];左外叶切除和左半肝切除的肿瘤直径中位值差异有统计学意义[4.1(2.0~10.0)cm vs 4.7(3.3~11.4)cm,P=0.016];左外叶切除和左半肝切除两组患者的其他临床病理特征差异无统计学意义(P>0.05)。患者基本临床病理特征见表 1。
|
|
表 1 患者基本临床病理特征 Tab 1 Baseline clinicopathological features of patients |
2.2 左外叶HCC患者术后总体生存和肿瘤复发的单因素及多因素Cox回归分析
左外叶HCC患者术后总体生存和肿瘤复发的单因素Cox回归分析结果见表 2,将差异有统计学意义的变量纳入多因素Cox回归分析。多因素Cox回归分析结果(表 3)显示,窄切缘(HR=1.427,95% CI 1.014~2.006,P=0.041)、MVI阳性(HR=1.598,95% CI 1.137~2.246,P=0.007)、肿瘤直径≥5 cm(HR=1.691,95% CI1.188~2.408,P=0.004)、肿瘤多发(HR=1.855,95% CI 1.211~2.840,P= 0.005)是术后总体生存的独立危险因素。窄切缘(HR=1.441,95% CI 1.062~1.955,P=0.019)、MVI阳性(HR=1.374,95% CI 1.018~1.854,P= 0.038)、肿瘤直径≥5 cm(HR=1.359,95% CI 1.003~ 1.841,P=0.048)、肿瘤多发(HR=1.950,95% CI 1.327~2.863,P=0.001)是术后肿瘤复发的独立危险因素。手术切除方式既不是术后总体生存也不是肿瘤复发的独立危险因素。
|
|
表 2 左外叶HCC患者接受肝左外叶切除术或左半肝切除术预后的单因素Cox回归分析 Tab 2 Univariate Cox regression analysis of left lateral lobe HCC patients undergoing left lateral lobectomy or left hepatectomy |
|
|
表 3 左外叶HCC患者接受肝左外叶切除术或左半肝切除术预后的多因素Cox回归分析 Tab 3 Multivariate Cox regression analysis of left lateral lobe HCC patients undergoing left lateral lobectomy or left hepatectomy |
2.3 两组左外叶HCC患者术后总体生存和肿瘤复发率的比较
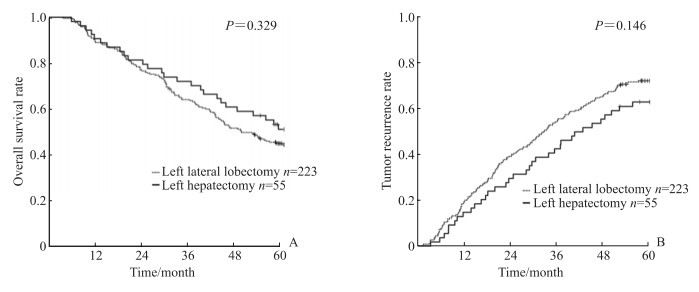
全组患者术后1、3、5年的总体生存率和肿瘤复发率分别为89.9%、66.2%、47.0%和17.6%、51.1%、69.6%。左外叶切除和左半肝切除术后1、3、5年的术后总体生存率分别为89.7%、64.5%、45.5%和90.9%、72.7%、52.2%(P=0.329,图 1A),术后1、3、5年的肿瘤复发率分别为18.4%、53.4%、71.5%和14.5%、41.8%、62.1%(P=0.146,图 1B),差异均无统计学意义。
|
图 1 左外叶HCC行左外叶切除或左半肝切除患者术后总体生存和肿瘤复发曲线 Fig 1 Overall survival and tumor recurrence curves of left lateral lobe HCC patients undergoing left lateral lobectomy or left hepatectomy A: Overall survival curves; B: Tumor recurrence curves. HCC: Hepatocellular carcinoma. |
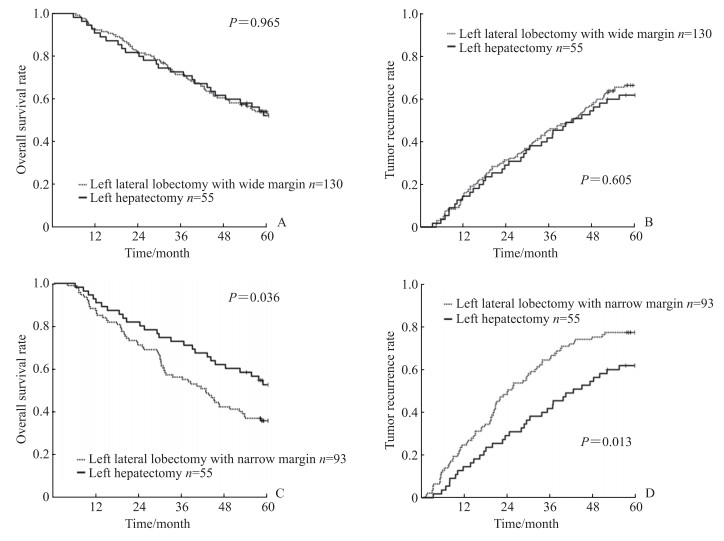
左外叶切除中宽切缘患者和左半肝切除患者术后1、3、5年的总体生存率分别为92.3%、71.5%、53.1%和90.9%、72.7%、52.2%(P=0.965,图 2A),术后1、3、5年的肿瘤复发率分别为13.8%、45.4%、67.1%和14.5%、41.8%、62.1%(P=0.605,图 2B),差异均无统计学意义。左外叶切除中窄切缘患者和左半肝切除患者的术后1、3、5年的总体生存率分别为86.0%、54.8%、34.9%和90.9%、72.7%、52.2%(P=0.036,图 2C),术后1、3、5年的肿瘤复发率分别为24.7%、64.5%、77.7%和14.5%、41.8%、62.1%(P=0.013,图 2D),差异均有统计学意义。
|
图 2 左外叶HCC不同切缘的左外叶切除或左半肝切除患者术后总体生存和肿瘤复发曲线 Fig 2 Overall survival and tumor recurrence curves of left lateral lobe HCC patients undergoing left lateral lobectomy with different margins or left hepatectomy A: The overall survival curves of left lateral lobectomy with wide margin and left hepatectomy; B: The tumor recurrence curves of left lateral lobectomy with wide margin and left hepatectomy; C: The overall survival curves of left lateral lobectomy with narrow margin and left hepatectomy; D: The tumor recurrence curves of left lateral lobectomy with narrow margin and left hepatectomy. HCC: Hepatocellular carcinoma. |
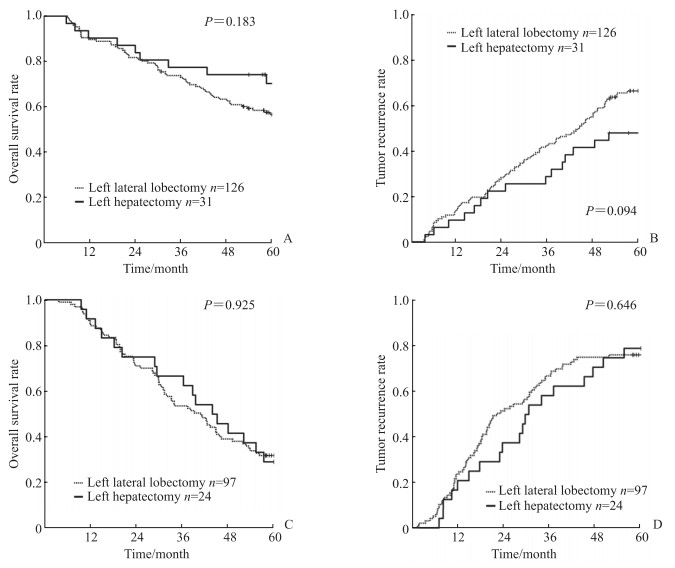
根据不同肿瘤直径做亚组分析,结果显示在肿瘤直径<5 cm的患者中行肝左外叶切除和左半肝切除的术后1、3、5年总体生存率分别是89.7%、73.0%、56.5%和90.3%、77.4%、70.7%(P=0.183,图 3A),术后1、3、5年的肿瘤复发率分别为14.3%、42.9%、67.6%和9.7%、29.0%、48.8%(P=0.094,图 3B),差异均无统计学意义。在肿瘤直径≥5 cm的患者中行肝左外叶切除和左半肝切除的术后1、3、5年总体生存率分别是89.7%、53.6%、31.3%和91.7%、66.7%、29.2%(P=0.925,图 3C),术后1、3、5年的肿瘤复发率分别为23.7%、67.0%、76.4%和20.8%、58.3%、79.2%(P=0.646,图 3D),差异均无统计学意义。
|
图 3 不同肿瘤直径的左外叶HCC行左外叶切除或左半肝切除患者术后总体生存和肿瘤复发曲线 Fig 3 Overall survival and tumor recurrence curves of left lateral lobe HCC patients with different tumor sizes undergoing left lateral lobectomy or left hepatectomy A: The overall survival curves of left lateral lobectomy and left hepatectomy for tumor size < 5 cm; B: The tumor recurrence curves of left lateral lobectomy and left hepatectomy for tumor size < 5 cm; C: The overall survival curves of left lateral lobectomy and left hepatectomy for tumor size≥5 cm; D: The tumor recurrence curves of left lateral lobectomy and left hepatectomy for tumor size≥5 cm. HCC: Hepatocellular carcinoma. |
2.4 两组左外叶HCC患者术后并发症的比较
278例左外叶HCC患者共有47例发生术后并发症,其中38例只发生1种术后并发症,9例发生2种不同的术后并发症,术后并发症发生率为47/278(16.9%)。
左外叶切除的术后并发症发生率为16.1%(36/223;29例只发生1种,7例发生2种),左半肝切除的术后并发症发生率为20.0%(11/55;9例发生1种,2例发生2种),两组差异无统计学意义(P=0.494)。在左外叶切除和左半肝切除患者中Ⅲ/Ⅳ级术后并发症的发生率分别为1.8%(4/223;均只发生1种)和3.6%(2/55;均只发生1种),两组差异无统计学意义(P=0.430)。
3 讨论左外叶切除或左半肝切除是左外叶HCC常见的手术方案。肝左外叶切除即沿矢状部左侧依次离断肝组织,而左半肝切除即沿中肝静脉左侧0.5 cm至第一肝门逐渐离断肝组织[9]。由于解剖上的限制部分肝左外叶切除患者无法取得宽切缘,相较于左外叶切除,左半肝切除的肝脏组织更多。尽管左半肝切除对肝脏的创伤相对较大,但对于部分HCC患者却可以取得宽切缘并获得更为彻底的治疗。
本研究结果显示,切缘是影响左外叶HCC患者术后总体生存和肿瘤复发的因素,宽切缘可改善患者预后,与既往研究[10]结果一致。尽管本研究结果显示手术切除方式不是预后的独立危险因素,但进一步分析发现,肝左外叶切除的患者中手术切缘为窄切缘的有93例(41.7%),而左半肝切除患者均为宽切缘,两组差异有统计学意义。本研究还发现,左外叶切除中切缘为宽切缘患者的预后与左半肝切除患者相似,即手术方式对这部分患者的预后无明显影响,而左外叶切除窄切缘的患者预后较左半肝切除差。分析原因,临床上左外叶切除窄切缘的患者,肿瘤邻近矢状部,因此在实施左外叶切除时切缘取窄切缘。这部分患者由于左外叶切除解剖上的局限性,即左外叶切除只能是沿着门静脉左支矢状部左侧进行肝切除,无法通过扩大切缘来获得宽切缘,要想获得宽切缘只能进行左半肝切除。因此,对于这部分患者,行左半肝切除可以改善患者预后,即手术方式可以影响这部分患者的预后。这可能与癌旁子灶和MVI有关。癌旁子灶和MVI统称为癌周微转移,是HCC术后复发尤其是早期复发的重要因素[12-13]。研究显示癌周微转移与肿瘤的转移、复发和预后较差有关[14-15]。本研究结果也显示,MVI是患者术后总体生存和肿瘤复发的独立危险因素。即便是肿瘤直径较小的HCC,在邻近肿瘤的肝组织中也会发生肿瘤微转移,而直径较大的肿瘤在邻近和远端微转移的概率明显提高[16]。本研究结果显示,左半肝切除的患者其肿瘤直径与左外叶切除患者比较相对较大,差异有统计学意义[4.7(3.3~11.4)cm vs 4.1(2.0~10.0)cm,P=0.016)]。左半肝切除患者对应的MVI阳性也相对较多,可能和肿瘤直径较大有关,与既往研究[16]结果一致。本研究根据不同肿瘤直径进行了亚组分析,结果显示在肿瘤直径<5 cm和≥5 cm的患者中,行左外叶切除和左半肝切除患者的预后差异均无统计学意义。有研究显示多发肿瘤预后较差[17],这可能与肿瘤起源以及MVI发生率有关。研究发现,多发肿瘤的MVI发生率明显高于单发肿瘤[18]。宽切缘可提高切除潜在癌周微转移的概率,从而减少术后肝内转移复发的可能[19],进而提高患者预后。肝功能评估是影响手术方案的重要因素[20]。对于肝硬化较重的患者,如果术前评估术后可能导致严重的肝功能损伤,即便肿瘤邻近门静脉矢状部,实施手术时临床医师会更多地考虑行左外叶切除。而术前评估肝功能储备较好的患者,如果肿瘤邻近门静脉矢状部,则行左半肝切除的可能性相对更大。本研究结果显示,左外叶切除和左半肝切除的患者术后第1天、第3天的总胆红素水平和丙氨酸转氨酶水平差异均无统计学意义,即行左外叶切除和左半肝切除患者在术后肝功能方面无明显差异。这可能得益于左半肝切除患者术前较为严格的筛查。本研究同时分析了左外叶切除和左半肝切除对术后并发症的影响,结果显示这2种手术方式的术后并发症差异无统计学意义,即尽管左半肝切除的肝组织更多,但相较于左外叶切除并不会显著增加患者术后并发症的发生率,与既往研究[8]结果一致。
综上所述,对于左外叶HCC,手术方式不是预后的独立危险因素,在确保手术切缘为宽切缘的前提下,手术方式对左外叶HCC患者的长期预后无明显影响,但对于邻近门静脉矢状部的左外叶HCC确保足够的切缘至关重要,这部分患者建议行左半肝切除以获得较好的预后。本研究存在一定的局限性,纳入的患者数量相对较少,且属于单中心的回顾性研究,未来将开展大样本、多中心、前瞻性研究以进一步证实。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
FENG R M, ZONG Y N, CAO S M, XU R H. Current cancer situation in China: good or bad news from the 2018 global cancer statistics?[J/OL]. Cancer Commun (Lond), 2019, 39: 22. DOI: 10.1186/s40880-019-0368-6.
|
| [3] |
European Association for the Study of the Liver; European Organisation for Research and Treatment of Cancer. Easl-eortc Clinical Practice Guidelines: Management of Hepatocellular Carcinoma[J]. J Hepatol, 2012, 56: 908-943. DOI:10.1016/j.jhep.2011.12.001 |
| [4] |
XU H W, LIU F, HAO X Y, WEI Y G, LI B, WEN T F, et al. Laparoscopically anatomical versus non-anatomical liver resection for large hepatocellular carcinoma[J]. HPB (Oxford), 2020, 22: 136-143. DOI:10.1016/j.hpb.2019.06.008 |
| [5] |
刘煜, 代扬, 张欣雪, 李沈铭, 刘荣军, 樊华. 单发小肝癌合并微血管侵犯解剖性与非解剖性肝切除疗效对比分析[J]. 中华医学杂志, 2018, 98: 1937-1940. DOI:10.3760/cma.j.issn.0376-2491.2018.24.009 |
| [6] |
王小磊, 孟珊珊, 段科行, 胡耀炜, 魏锋. 腹腔镜与开腹左半肝切除术疗效的meta分析[J]. 肝胆胰外科杂志, 2020, 32: 610-618. DOI:10.11952/j.issn.1007-1954.2020.10.008 |
| [7] |
原春辉, 修典荣, 马朝来, 蒋斌, 李智飞, 李磊, 等. 腹腔镜解剖性左半肝切除治疗肝肿瘤[J]. 中华肝胆外科杂志, 2014, 20: 845-847. DOI:10.3760/cma.j.issn.1007-8118.2014.12.003 |
| [8] |
ZOU J W, LI S H, WANG Q X, MEI J, LU L H, LIN W P, et al. Surgical strategies for hepatocellular carcinoma located in the left lateral lobe: a propensity score-matched and prognostic nomogram study[J]. Cancer Med, 2021, 10: 3274-3287. DOI:10.1002/cam4.3894 |
| [9] |
幕内雅敏.曾勇, 唐伟主译. 幕内肝脏外科学[M]. 北京: 人民卫生出版社, 2016: 110-146.
|
| [10] |
YANG P H, SI A F, YANG J, CHENG Z J, WANG K, LI J, et al. A wide-margin liver resection improves long-term outcomes for patients with HBV-related hepatocellular carcinoma with microvascular invasion[J]. Surgery, 2019, 165: 721-730. DOI:10.1016/j.surg.2018.09.016 |
| [11] |
DINDO D, DEMARTINES N, CLAVIEN P A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6 336 patients and results of a survey[J]. Ann Surg, 2004, 240: 205-213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [12] |
ERSTAD D J, TANABE K K. Prognostic and therapeutic implications of microvascular invasion in hepatocellular carcinoma[J]. Ann Surg Oncol, 2019, 26: 1474-1493. DOI:10.1245/s10434-019-07227-9 |
| [13] |
SUBBOTIN V M. Privileged portal metastasis of hepatocellular carcinoma in light of the coevolution of a visceral portal system and liver in the chordate lineage: a search for therapeutic targets[J]. Drug Discov Today, 2018, 23: 548-564. DOI:10.1016/j.drudis.2018.01.020 |
| [14] |
MANSI J, MORDEN J, BLISS J M, NEVILLE M, COOMBES R C. Bone marrow micrometastases in early breast cancer-30-year outcome[J]. Br J Cancer, 2016, 114: 243-247. DOI:10.1038/bjc.2015.447 |
| [15] |
SASAKI E, NAGINO M, EBATA T, ODA K, ARAI T, NISHIO H, et al. Immunohistochemically demonstrated lymph node micrometastasis and prognosis in patients with gallbladder carcinoma[J]. Ann Surg, 2006, 244: 99-105. DOI:10.1097/01.sla.0000217675.22495.6f |
| [16] |
CHENG Z J, YANG P H, QU S P, ZHOU J H, YANG J, YANG X W, et al. Risk factors and management for early and late intrahepatic recurrence of solitary hepatocellular carcinoma after curative resection[J]. HPB, 2015, 17: 422-427. DOI:10.1111/hpb.12367 |
| [17] |
BRUIX J, HAN K H, GORES G, LLOVET J M, MAZZAFERRO V. Liver cancer: approaching a personalized care[J]. J Hepatol, 2015, 62(1 Suppl): S144-S156. |
| [18] |
LEI Z Q, LI J, WU D, XIA Y, WANG Q, SI A F, et al. Nomogram for preoperative estimation of microvascular invasion risk in hepatitis B virus-related hepatocellular carcinoma within the Milan criteria[J]. JAMA Surg, 2016, 151: 356-363. DOI:10.1001/jamasurg.2015.4257 |
| [19] |
施长鹰, 廖博懿, 董志涛, 王灿, 沈伟峰, 杨甲梅. 手术方式和癌周微转移对肝细胞癌疗效的影响[J]. 腹部外科, 2019, 32: 439-444. DOI:10.3969/j.issn.1003-5591.2019.06.012 |
| [20] |
KOKUDO T, HASEGAWA K, SHIRATA C, TANIMOTO M, ISHIZAWA T, KANEKO J, et al. Assessment of preoperative liver function for surgical decision making in patients with hepatocellular carcinoma[J]. Liver Cancer, 2019, 8: 447-456. |
 2022, Vol. 43
2022, Vol. 43


