2. 战略支援部队特色医学中心心血管内科,北京 100101
2. Department of Cardiovasology, PLA Strategic Support Force Characteristic Medical Center, Beijing 100101, China
急性心肌梗死(acute myocardial infarction,AMI)是临床上的高危病症,具有发病急、预后差、死亡率高等特点[1]。其主要病因是在冠状动脉粥样硬化的基础上,发生1支或多支血管急性闭塞致使心肌持续性缺血坏死。在此进程中,细胞因子可以促进免疫细胞浸润、加快血小板激活和粥样斑块破裂,与AMI的发生和进展密切相关[2-3]。因此,进一步理解患者血浆中细胞因子水平的变化及意义有助于疾病的诊断并为治疗提供新靶点。
IL-22属于IL-10家族成员,主要由辅助性T细胞22(T-helper cell 22,Th22)等淋巴细胞分泌,与炎症反应和脂质代谢有关[4]。既往研究表明,在人类不稳定颈动脉斑块中IL-22水平显著增高,且与干扰素γ等细胞因子表达水平呈正相关[5]。其机制可能为IL-22通过抑制巨噬细胞中胆固醇的排出、促进低密度脂蛋白的氧化浸润参与粥样斑块的形成和不稳定性[6]。AMI患者外周血中Th22比例及IL-22水平显著升高[7],但目前关于血浆IL-22水平与AMI患者冠状动脉病变程度及预后关系的报道甚少。本研究通过分析AMI患者血浆中IL-22的水平及其与其他炎症因子、冠状动脉病变程度及主要不良心脑血管事件(major adverse cardiovascular and cerebrovascular event,MACCE)的相关性,探讨IL-22在AMI病情判断及预后预测中的价值。
1 资料和方法 1.1 研究对象连续选择2014年10月至2016年12月在战略支援部队特色医学中心行急诊经皮冠状动脉介入治疗的AMI患者130例。AMI定义为心肌生化标志物(主要为肌钙蛋白)明显升高(至少超过正常参考值上限的99%),且合并以下至少1项心肌缺血的临床证据:(1)存在心肌缺血症状;(2)发生缺血性心电图改变;(3)心电图病理性Q波形成;(4)影像学显示有新的心肌活性丧失或局部室壁运动异常;(5)冠状动脉造影或尸体解剖证实冠状动脉血栓[8]。排除标准:(1)不同意行经皮冠状动脉介入治疗者;(2)溶栓治疗未成功,行经皮冠状动脉介入治疗补救治疗者;(3)存在手术禁忌证者;(4)临床及检验资料不完善者。根据以上标准,最终纳入98例AMI患者,包括ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)患者58例和非ST段抬高型心肌梗死(non-ST segment elevation myocardial infarction,NSTEMI)患者40例。连续入组同期在战略支援部队特色医学中心心血管内科就诊、冠状动脉造影结果无异常(狭窄程度<50%)且不符合AMI诊断标准者40例为对照组[9]。本研究获得战略支援部队特色医学中心伦理委员会审批。
1.2 临床资料收集收集所有研究对象的年龄、性别、吸烟史、既往史、BMI及常规检查和检验指标,包括甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、尿酸、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹血糖(fasting plasma glucose,FPG)、超敏C反应蛋白(hypersensitive C reactive protein,hs-CRP)、心肌肌钙蛋白I(cardiac troponin I,cTnI)、脑钠肽(brain natriuretic peptide,BNP)及左室射血分数(left ventricular ejection fraction,LVEF)等。
1.3 血浆细胞因子及测定入院当日或次日清晨收集所有研究对象空腹外周静脉血约3 mL,离心提取血浆(800×g,10 min),置于EP管并放入-80 ℃冰箱待检。采用Luminex液相芯片技术对血浆IL-22、IL-1β、IL-6和TNF-α水平同时检测,检测过程严格按照试剂说明书及设备操作指南进行(eBioscience Procarta Plex试剂盒,货号:EPXR450-12171-901)。
1.4 冠状动脉病变程度评估由1~2名经验丰富的心脏介入医师进行多体位冠状动脉造影投照,并对冠状动脉靶血管及管腔狭窄程度进行判读。根据冠状动脉病变位置、严重程度、分叉、钙化等指标及心脏外科与介入治疗狭窄冠状动脉研究(SYNergy between percutaneous coronary intervention with TAXUSTM and cardiac surgery,SYNTAX)积分体系标准计算SYNTAX积分。SYNTAX积分是一种根据冠状动脉病变解剖特点进行危险分层的积分系统,积分越高表明冠状动脉病变程度越重,其中0~22分为低分,23~32分为中分,33分及以上为高分[10]。
1.5 MACCE评价以手术结束为观察起点,通过门诊或电话等方式,对AMI患者进行为期5年的随访。终点事件定义为MACCE,包括心源性死亡、再发心肌梗死、靶血管血运重建及非致死性脑卒中。患者出院5年内发生其中任何一种情况均认为出现终点事件,记录发生的具体终点事件及时间。
1.6 统计学处理采用SPSS 25.0软件对数据进行处理。符合正态分布的计量资料以x±s表示,组间差异性分析采取t检验或单因素方差分析;不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,差异性分析采取秩和检验。多重比较采用Bonferroni法校正P值。计数资料以例数和百分数表示,组间比较采用χ2检验。采用Pearson相关性分析探究各指标之间的相关性,采用多元线性回归、二分类logistic回归进行多因素回归分析,采用ROC曲线分析各指标对中高SYNTAX积分的预测能力。检验水准(α)为0.05。
2 结果 2.1 各组患者临床资料比较年龄、性别、高血压病史、糖尿病史、吸烟史、BMI、高脂血症、TC、TG、LDL-C、HbA1c及尿酸在STEMI、NSTEMI及对照组间差异均无统计学意义(P均>0.05);有冠心病家族史的患者比例,HDL-C、FPG、hs-CRP、BNP水平,以及LVEF在3组间差异均有统计学意义(P均<0.05)。进一步多重比较发现,STEMI与NSTEMI组有冠心病家族史的患者比例及FPG、hs-CRP、BNP水平均高于对照组(P均<0.05),HDL-C水平和LVEF均低于对照组(P均<0.05);各指标在STEMI与NSTEMI组间差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 各组患者临床资料比较 Tab 1 Comparison of clinical data of patients in each group |
2.2 血浆炎症因子水平及相关性
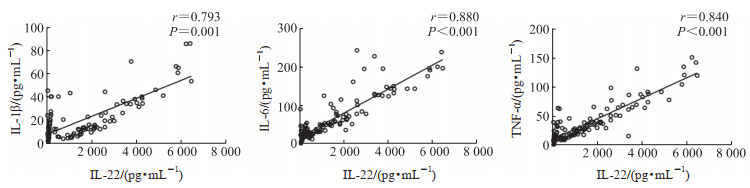
STEMI、NSTEMI组血浆炎症因子IL-22、IL-1β、IL-6及TNF-α水平均高于对照组(P均<0.05),但STEMI及NSTEMI组间炎症因子水平差异均无统计学意义(P均>0.05),见表 2。相关性分析结果显示,AMI患者血浆IL-22水平与IL-1β(r=0.793,P=0.001)、IL-6(r=0.880,P<0.001)、TNF-α(r=0.840,P<0.001)水平均呈正相关(图 1)。
|
|
表 2 各组患者血浆炎症因子水平比较 Tab 2 Comparison of plasma levels of inflammatory cytokines in each group |
|
图 1 AMI患者血浆IL-22与其他炎症因子水平的Pearson相关性分析 Fig 1 Pearson correlation analysis between plasma levels of IL-22 and other inflammatory cytokines in AMI patients AMI: Acute myocardial infarction; IL: Interleukin; TNF-α: Tumor necrosis factor α. |
2.3 SYNTAX积分与各变量的相关性
AMI患者SYNTAX积分为(17.24±8.86)分。相关性分析结果显示,SYNTAX积分与IL-22水平(r=0.478,P=0.001)、IL-6水平(r=0.242,P=0.017)、年龄(r=0.217,P=0.032)和cTnI水平(r=0.261,P=0.010)呈正相关,与LVEF(r=-0.224,P=0.034)呈负相关。IL-1β(r=0.100,P=0.348)、TNF-α(r=0.130,P=0.209)、FPG(r=0.089,P=0.393)、HDL-C(r=0.095,P=0.362)和LDL-C(r=0.085,P=0.411)等的水平与SYNTAX积分无关。
2.4 SYNTAX积分的影响因素分析根据相关性分析结果取年龄、LVEF、cTnI、IL-6和IL-22为自变量,以SYNTAX积分为因变量进行多元线性回归分析,结果显示IL-22(β=0.269,P=0.023)、年龄(β=0.236,P=0.016)、LVEF(β=-0.235,P=0.023)为SYNTAX积分的影响因素(表 3)。结果表明在校正混杂因素后,IL-22水平、年龄及LVEF对SYNTAX积分的变化具有影响。
|
|
表 3 AMI患者SYNTAX积分影响因素的多元线性回归分析 Tab 3 Multiple linear regression analysis of influencing factors of SYNTAX score in AMI patients |
2.5 中高SYNTAX积分的预测因素分析
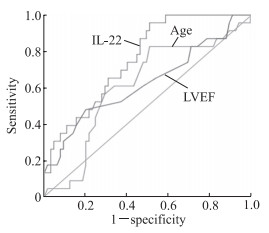
根据SYNTAX积分标准,有24例AMI患者SYNTAX积分为中高分[23~44分,平均(29.33±5.97)分]。采用ROC曲线分析血浆IL-22水平、年龄及LVEF对AMI患者中高SYNTAX积分的预测能力,结果(图 2)显示,IL-22对中高SYNTAX积分的预测能力(AUC=0.760,95% CI 0.656~0.863,P=0.001)高于年龄(AUC=0.612,95% CI 0.478~0.746,P=0.112)和LVEF(AUC=0.628,95% CI0.485~0.770,P=0.070)。IL-22预测中高SYNTAX积分的最佳截断值为837.125 pg/mL,此时灵敏度为95.7%,特异度为55.4%。
|
图 2 血浆IL-22水平、年龄及LVEF预测AMI患者中高SYNTAX积分的ROC曲线 Fig 2 ROC curves of plasma IL-22 level, age and LVEF for predicting medium-high SYNTAX score in AMI patients IL-22: Interleukin 22; LVEF: Left ventricular ejection fraction; AMI: Acute myocardial infarction; SYNTAX: SYNergy between percutaneous coronary intervention with TAXUSTM and cardiac surgery; ROC: Receiver operating characteristic. |
2.6 出院后5年MACCE随访
98例AMI患者中,失访11例,完成随访的87例患者平均随访时间为(4.74±1.18)年。有19例(21.84%,19/87)发生MACCE事件,其中心源性死亡8例、再发心肌梗死3例、靶血管血运重建3例、非致死性脑卒中5例。3个月、6个月、1年、2年、5年MACCE事件的发生率分别为4.60%(4/87)、5.75%(5/87)、9.20%(8/87)、14.94%(13/87)、21.84%(19/87)。根据出院后5年内是否发生MACCE将AMI患者分为MACCE组和非MACCE组,MACCE组SYNTAX积分、年龄及cTnI水平均高于非MACCE组,LDL-C水平低于非MACCE组,差异均有统计学意义(P均<0.05);两组患者性别、高血压病史、糖尿病史、HDL-C水平、FPG、血浆IL-6水平、血浆IL-22水平、LVEF等差异均无统计学意义(P均>0.05,表 4)。根据以上结果,纳入SYNTAX积分、年龄、LDL-C及cTnI对是否发生MACCE进行二分类logistic回归分析,结果显示在校正年龄等混杂因素后,SYNTAX积分并非AMI患者出院后5年内发生MACCE的危险因素(P>0.05,表 5)。
|
|
表 4 MACCE组和非MACCE组AMI患者各项指标比较 Tab 4 Comparison of indexes of AMI patients between MACCE group and non-MACCE group |
|
|
表 5 AMI患者出院后5年内发生MACCE危险因素的二分类logistic回归分析 Tab 5 Binary logistic regression analysis of risk factorsfor MACCE in AMI patients within 5 years after discharge |
3 讨论
AMI是世界范围内致残和致死的主要疾病之一,与动脉粥样硬化的进展密切相关。随着动脉粥样硬化斑块持续累积或斑块成分不稳定的加重,冠状动脉可发生急性阻塞,引起心肌缺血坏死。血管内皮炎症是动脉粥样硬化所致AMI的重要机制。炎症细胞因子参与整个动脉粥样斑块的形成过程,并可增加斑块不稳定性从而诱发急性冠状动脉综合征并参与心肌梗死后的心肌重构[11]。近年来,如何通过炎症因子表达的变化来预测AMI的发生或程度一直是人们关注的热点。2017年大规模随机对照临床研究CANTONS发现IL-1β抑制剂卡那单抗(canakinumab)可显著降低hs-CRP≥2 mg/L的AMI患者的炎症指标水平和MACCE发生率[12]。这为AMI的预防和治疗提供了新的方向,但心肌梗死炎症反应复杂,靶点众多,研究仍面临诸多困难[13]。本研究探究AMI患者中有特殊意义的细胞因子,分析其水平及与病变程度等的关联,有助于在早期阶段正确认识患者病情,及早实施有效干预,并开展进一步的研究。
IL-22是近年发现的特征性细胞因子,与多种免疫炎症疾病的进展相关,并可作为动脉粥样硬化等疾病的潜在靶点[14-15]。文献报道,IL-22在动脉血管壁及平滑肌细胞等组织细胞表达,能下调巨噬细胞中ATP结合盒转运蛋白G1的水平,抑制巨噬细胞中游离胆固醇的排出;还可通过上调基质金属蛋白酶1引发基底膜及斑块纤维帽中的基质降解,促进低密度脂蛋白的氧化渗入及粥样斑块的不稳定性增加,引发斑块破裂堵塞血管[16-18]。动物实验发现,腹腔注射重组IL-22蛋白可以促进载脂蛋白E基因缺陷(apolipoprotein E gene deficient,ApoE-/-)小鼠主动脉根部动脉粥样硬化面积增加和T细胞、巨噬细胞聚集[19]。敲除IL-22基因则显著降低ApoE-/-小鼠粥样斑块面积及胶原含量[20]。也有研究者发现IL-22能够影响肠道微生物群抑制饮食或压力诱导的大鼠主动脉上粥样硬化面积[21]。
Lin等[22]通过ELISA法检测发现AMI患者血浆IL-22水平[(61.67±8.77)pg/mL]高于对照组[(52.93±8.64)pg/mL],提出IL-22可能在AMI的发生中起作用。本研究结果与此一致,发现STEMI患者和NSTEMI患者血浆IL-22水平高于对照组。
本研究发现血浆IL-22水平与其他炎症因子IL-1β、IL-6、TNF-α呈正相关。既往研究表明,急性冠状动脉综合征患者外周血IL-1β、IL-6、TNF-α水平增高被认为可以促进冠状动脉粥样硬化的发生与发展[23]。其中,IL-1β和TNF-α可激活免疫细胞,抑制舒血管物质的释放、增加黏附分子和趋化因子的表达促进动脉粥样硬化形成;IL-6可通过促进趋化因子等炎症介质的表达促使动脉粥样硬化斑块结构改变和不稳定性增加,参与心肌缺血区域的再灌注损伤[24]。本研究也证实IL-22参与了AMI的进程,并与心肌梗死相关性细胞因子密切相关。
本研究首次发现AMI患者血浆IL-22水平与SYNTAX积分呈正相关,这对冠状动脉病变程度的判断有一定价值。冠状动脉病变的严重程度与心肌缺血的范围和持续时间呈正相关,是制订AMI患者临床治疗策略的重要影响因素[25]。SYNTAX积分基于病变位置、严重程度、分叉、钙化等因素建立,是临床上用于冠状动脉病变严重程度和危险程度的量化指标[26]。本研究通过简单相关分析发现,IL-22、LVEF、年龄、IL-6及cTnI与SYNTAX积分有关。进一步多元线性回归分析显示,校正混杂因素后,IL-22、LVEF及年龄是SYNTAX积分的影响因素,IL-6和cTnI并非SYNTAX积分的独立危险因素。ROC曲线分析提示,IL-22对中高SYNTAX积分具有较好的预测作用。炎症因子在AMI中的致病作用已然明确,临床上一些细胞因子抑制剂开始应用于AMI患者的抗炎治疗策略[27]。但AMI炎症反应复杂且存在个体差异,理论机制向临床转化的研究有待持续开展[28]。本研究发现,血浆IL-22与IL-6等细胞因子相关,是冠状动脉病变程度的独立危险因素,相较于其他变量对冠状动脉病变程度有更佳的预测能力。2021年发表的一项多中心临床试验证实了IL-6受体抑制剂托珠单抗(tocilizumab)对缺血再灌注过程中炎症反应的抑制作用,可促进AMI患者的心肌挽救[29]。IL-22作为与冠状动脉病变程度相关的炎症因子,也可能在未来成为心肌挽救的潜在治疗靶点,用于抑制炎症反应,减少梗死面积,改善患者预后。
本研究对患者出院后5年内MACCE的发生情况进行了随访,分析发现,排除年龄等混杂因素后,SNYATX积分和血浆IL-22水平并非AMI患者出院后5年内发生MACCE事件的危险因素。一方面,这提示IL-22对MACCE事件发生的预测能力较弱。另一方面,可能是由于本研究的纳入病例较少,未监测血浆IL-22水平的动态变化,需要扩大样本量进一步验证。
综上所述,AMI患者血浆IL-22表达水平增高,与IL-1β、IL-6等炎症指标呈正相关,且可在一定程度上反映冠状动脉病变的严重程度,其水平与出院后5年内MACCE的发生无关。本研究结果提示IL-22对于AMI患者病情的早期判断有潜在预测价值,有助于开展进一步的相关靶点研究。
| [1] |
中国医师协会急诊医师分会, 国家卫健委能力建设与继续教育中心急诊学专家委员会, 中国医疗保健国际交流促进会急诊急救分会. 急性冠脉综合征急诊快速诊治指南(2019)[J]. 中国急救医学, 2019, 39: 301-308. DOI:10.3969/j.issn.1002-1949.2019.04.001 |
| [2] |
ONG S B, HERNÁNDEZ-RESÉNDIZ S, CRESPO-AVILAN G E, MUKHAMETSHINA R T, KWEK X Y, CABRERA-FUENTES H A, et al. Inflammation following acute myocardial infarction: multiple players, dynamic roles, and novel therapeutic opportunities[J]. Pharmacol Ther, 2018, 186: 73-87. DOI:10.1016/j.pharmthera.2018.01.001 |
| [3] |
WOLF D, LEY K. Immunity and inflammation in atherosclerosis[J]. Circ Res, 2019, 124: 315-327. DOI:10.1161/CIRCRESAHA.118.313591 |
| [4] |
DUDAKOV J A, HANASH A M, VAN DEN BRINK M R M. Interleukin-22: immunobiology and pathology[J]. Annu Rev Immunol, 2015, 33: 747-785. DOI:10.1146/annurev-immunol-032414-112123 |
| [5] |
XIA Q, XIANG X G, PATEL S, PURANIK R, XIE Q, BAO S S. Characterisation of IL-22 and interferon-gamma-inducible chemokines in human carotid plaque[J]. Int J Cardiol, 2012, 154: 187-189. DOI:10.1016/j.ijcard.2011.10.093 |
| [6] |
孙懿, 胡志德, 黄元兰, 熊怡淞, 邓安梅, 仲人前. IL-22抑制ox-LDL诱导的CRL-1730细胞凋亡并上调其Bcl-2表达[J]. 第二军医大学学报, 2011, 32: 233-237. SUN Y, HU Z D, HUANG Y L, XIONG Y S, DENG A M, ZHONG R Q. IL-22 inhibits ox-LDL-induced apoptosis and increases Bcl-2 expression in CRL-1730 cells[J]. Acad J Sec Mil Med Univ, 2011, 32: 233-237. |
| [7] |
ZHANG L, WANG T, WANG X Q, DU R Z, ZHANG K N, LIU X G, et al. Elevated frequencies of circulating Th22 cell in addition to Th17 cell and Th17/Th1 cell in patients with acute coronary syndrome[J/OL]. PLoS One, 2013, 8: e71466. DOI: 10.1371/journal.pone.0071466.
|
| [8] |
THYGESEN K, ALPERT J S, JAFFE A S, CHAITMAN B R, BAX J J, MORROW D A, et al. Fourth universal definition of myocardial infarction (2018)[J/OL]. Circulation, 2018, 138: e618-e651. DOI: 10.1161/CIR.0000000000000617.
|
| [9] |
AUSTEN W G, EDWARDS J E, FRYE R L, GENSINI G G, GOTT V L, GRIFFITH L S, et al. A reporting system on patients evaluated for coronary artery disease. Report of the Ad Hoc Committee for Grading of Coronary Artery Disease, Council on Cardiovascular Surgery, American Heart Association[J]. Circulation, 1978, 51: 5-40. DOI:10.1161/01.CIR.51.4.5 |
| [10] |
SIANOS G, MOREL M A, KAPPETEIN A P, MORICE M C, COLOMBO A, DAWKINS K, et al. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease[J]. EuroIntervention, 2005, 1: 219-227. DOI:10.1182/blood-2006-09-048868 |
| [11] |
WESTMAN P C, LIPINSKI M J, LUGER D, WAKSMAN R, BONOW R O, WU E, et al. Inflammation as a driver of adverse left ventricular remodeling after acute myocardial infarction[J]. J Am Coll Cardiol, 2016, 67: 2050-2060. |
| [12] |
RIDKER P M, EVERETT B M, THUREN T, MACFADYEN J G, CHANG W H, BALLANTYNE C, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease[J]. N Engl J Med, 2017, 377: 1119-1131. DOI:10.1056/NEJMoa1707914 |
| [13] |
AYDIN S, UGUR K, AYDIN S, SAHIN İ, YARDIM M. Biomarkers in acute myocardial infarction: current perspectives[J]. Vasc Health Risk Manag, 2019, 15: 1-10. DOI:10.2147/VHRM.S166157 |
| [14] |
HUBER S, GAGLIANI N, ZENEWICZ L A, HUBER F J, BOSURGI L, HU B, et al. IL-22BP is regulated by the inflammasome and modulates tumorigenesis in the intestine[J]. Nature, 2012, 491: 259-263. DOI:10.1038/nature11535 |
| [15] |
KANDA N, WATANABE S. Increased serum human β-defensin-2 levels in atopic dermatitis: relationship to IL-22 and oncostatin M[J]. Immunobiology, 2012, 217: 436-445. DOI:10.1016/j.imbio.2011.10.010 |
| [16] |
GORZELAK-PABIS P, CHAŁUBIŃSKI M, WOJDAN K, ŁUCZAK E, BOROWIEC M, BRONCEL M. IL-22 modulates inflammatory properties of human primary aortic smooth muscle cells[J]. Adv Clin Exp Med, 2017, 26: 461-466. DOI:10.17219/acem/62218 |
| [17] |
CHE Y, SU Z L, XIA L. Effects of IL-22 on cardiovascular diseases[J/OL]. Int Immunopharmacol, 2020, 81: 106277. DOI: 10.1016/j.intimp.2020.106277.
|
| [18] |
WOLK K, WITTE E, WALLACE E, DÖCKE W D, KUNZ S, ASADULLAH K, et al. IL-22 regulates the expression of genes responsible for antimicrobial defense, cellular differentiation, and mobility in keratinocytes: a potential role in psoriasis[J]. Eur J Immunol, 2006, 36: 1309-1323. DOI:10.1002/eji.200535503 |
| [19] |
SHI L, JI Q W, LIU L, SHI Y, LU Z D, YE J, et al. IL-22produced by Th22 cells aggravates atherosclerosis development in ApoE-/- mice by enhancing DC-induced Th17 cell proliferation[J]. J Cell Mol Med, 2020, 24: 3064-3078. DOI:10.1111/jcmm.14967 |
| [20] |
RATTIK S, HULTMAN K, RAUCH U, SÖDERBERG I, SUNDIUS L, LJUNGCRANTZ I, et al. IL-22 affects smooth muscle cell phenotype and plaque formation in apolipoprotein E knockout mice[J]. Atherosclerosis, 2015, 242: 506-514. DOI:10.1016/j.atherosclerosis.2015.08.006 |
| [21] |
FATKHULLINA A R, PESHKOVA I O, DZUTSEV A, AGHAYEV T, MCCULLOCH J A, THOVARAI V, et al. An interleukin-23-interleukin-22 axis regulates intestinal microbial homeostasis to protect from diet-induced atherosclerosis[J/OL]. Immunity, 2018, 49: 943-957. e9. DOI: 10.1016/j.immuni.2018.09.011.
|
| [22] |
LIN Y Z, WU B W, LU Z D, HUANG Y, SHI Y, LIU H, et al. Circulating Th22 and Th9 levels in patients with acute coronary syndrome[J/OL]. Mediators Inflamm, 2013, 2013: 635672. DOI: 10.1155/2013/635672.
|
| [23] |
COSTE M E R, FRANÇA C N, IZAR M C, TEIXEIRA D, ISHIMURA M E, LONGO-MAUGERI I, et al. Early changes in circulating interleukins and residual inflammatory risk after acute myocardial infarction[J]. Arq Bras Cardiol, 2020, 115: 1104-1111. |
| [24] |
NERI M, FINESCHI V, DI PAOLO M, POMARA C, RIEZZO I, TURILLAZZI E, et al. Cardiac oxidative stress and inflammatory cytokines response after myocardial infarction[J]. Curr Vasc Pharmacol, 2015, 13: 26-36. DOI:10.2174/15701611113119990003 |
| [25] |
孙明壮, 胡舜英, 孙志军. 冠状动脉疾病评分系统研究进展[J]. 中华老年多器官疾病杂志, 2021, 20: 224-228. DOI:10.11915/j.issn.1671-5403.2021.03.048 |
| [26] |
THUIJS D J F M, KAPPETEIN A P, SERRUYS P W, MOHR F W, MORICE M C, MACK M J, et al. Percutaneous coronary intervention versus coronary artery bypass grafting in patients with three-vessel or left main coronary artery disease: 10-year follow-up of the multicentre randomised controlled SYNTAX trial[J]. Lancet, 2019, 394: 1325-1334. DOI:10.1016/S0140-6736(19)31997-X |
| [27] |
LAWLER P R, BHATT D L, GODOY L C, LÜSCHER T F, BONOW R O, VERMA S, et al. Targeting cardiovascular inflammation: next steps in clinical translation[J]. Eur Heart J, 2021, 42: 113-131. DOI:10.1093/eurheartj/ehaa099 |
| [28] |
CREA F, LIBBY P. Acute coronary syndromes: the way forward from mechanisms to precision treatment[J]. Circulation, 2017, 136: 1155-1166. DOI:10.1161/CIRCULATIONAHA.117.029870 |
| [29] |
BROCH K, ANSTENSRUD AK, WOXHOLT S, SHARMA K, TØLLEFSEN I M, BENDZ B, et al. Randomized trial of interleukin-6 receptor inhibition in patients with acute ST-segment elevation myocardial infarction[J]. J Am Coll Cardiol, 2021, 77: 1845-1855. |
 2022, Vol. 43
2022, Vol. 43


