2. 海军军医大学(第二军医大学)药学系有机化学教研室,上海 200433;
3. 海军军医大学(第二军医大学)第一附属医院烧创伤中心,上海 200433;
4. 海军军医大学(第二军医大学)第一附属医院中医妇科,上海 200433
2. Department of Organic Chemistry, School of Pharmacy, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Burn and Trauma Center, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China;
4. Department of Traditional Chinese Medicine (Gynaecology), The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China
乳腺癌是乳腺上皮细胞在多种致癌因子的作用下发生增殖失控进而恶变的一种疾病。尽管随着新治疗策略的普及,乳腺癌患者得到了更好的治疗,但我国乳腺癌患者死亡率的下降趋势并不显著[1]。因此,研究乳腺癌患者的预后模型对乳腺癌的治疗具有重要意义。
铁死亡是一种铁依赖性的细胞程序性死亡方式,其主要机制是在亚铁离子或脂氧合酶的作用下,细胞膜上高表达的不饱和脂肪酸发生脂质过氧化,从而诱导细胞死亡[2]。研究表明乳腺癌与某些铁死亡基因存在一定的相关性,如陆劲松团队研究报道调控铁死亡的重要基因酰基辅酶A合成酶长链4(acly-CoA synthetase long chain family 4,ACSL4)和谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)可作为接受新辅助化疗乳腺癌患者预后的新型生物标志物[3];张伟等[4]研究发现miRNA-1287通过抑制GPX4表达促进肿瘤细胞的铁死亡过程,最终抑制乳腺癌细胞的增殖能力;闫莉[5]研究发现隐丹参酮可以通过铁死亡抑制三阴性乳腺癌细胞的生长。虽然上述实验结果表明乳腺癌与某些铁死亡基因相关,但是否还存在其他与乳腺癌预后相关的铁死亡基因仍值得进一步研究。本研究通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库挖掘与乳腺癌预后相关的铁死亡基因并构建预后模型,利用国际肿瘤基因组协作组(International Cancer Genome Consortium,ICGC)数据库与基因表达汇编(Gene Expression Omnibus,GEO)数据库进行验证,为探讨基于铁死亡相关靶点的乳腺癌治疗策略提供研究方向。
1 资料和方法 1.1 乳腺癌转录组数据差异表达铁死亡基因的筛选选取TCGA数据库中2021年前收录并具有完整随访信息的乳腺癌患者样本1 164例,其中肿瘤样本1 053例、癌旁正常组织样本111例,所有样本均来自乳腺癌术后患者。下载该乳腺癌数据集相关转录组测序(RNA sequencing,RNAseq)数据用于后续分析。基于美国国家生物信息中心数据库挖掘能够调控肿瘤发生和发展的铁死亡基因60个。用R 4.0.5软件limma包提取1 053例乳腺癌样本中的铁死亡基因,并进行差异分析,P<0.05为差异有统计学意义。
1.2 乳腺癌临床数据预后相关铁死亡基因的筛选从TCGA数据库纳入基本信息完整的乳腺癌患者1 017例。患者均为女性,年龄≤50岁313例,>50岁704例;肿瘤TNM分期Ⅰ~Ⅱ期761例,Ⅲ~Ⅳ期256例;原发肿瘤浸润T1~T2期857例,T3~T4期160例;淋巴结转移N0期476例,N1~N3期541例;存活887例,死亡130例。剔除生存时间数据有明显错误(状态为存活,生存时间记录为0 d)的3例,用R 4.0.5软件survival包对铁死亡基因与乳腺癌预后(生存时间)的关系进行单因素Cox回归分析,P<0.05为差异有统计学意义,认为基因与预后相关,HR>1代表该基因表达量与预后呈负相关(即基因表达量越高,预后越差),HR<1则相反。
1.3 与乳腺癌预后相关的差异表达铁死亡基因的获取利用维恩图将差异表达铁死亡基因与预后相关铁死亡基因取交集,获得与预后相关的差异表达铁死亡基因。分别利用热图和树状图将这些基因在转录组数据和临床数据中可视化。利用STRING网站(https://cn.string-db.org/)
1.4 基于铁死亡基因的乳腺癌预后模型的建立和评估利用TCGA数据库中的样本数据作为测试集数据,通过最小绝对收缩和选择算子(least absolute shrinkage and selectionoperator,LASSO)回归法构建预后风险评分模型,风险评分=基因1表达水平×b1+基因2表达水平×b2+…+基因n表达水平×bn。根据风险评分中位数将患者分为高风险组和低风险组,利用R 4.0.5软件survival包对两组患者进行生存分析。利用R 4.0.5软件survivalROC包建立时间依赖ROC曲线以评估预后模型对乳腺癌预后的预测效能。进一步构建风险曲线和散点图观察风险评分对患者死亡与存活状态的影响。最后利用单因素和多因素Cox回归分析评价风险评分能否作为预后因子。
1.5 基于铁死亡基因的乳腺癌预后模型的验证获取GEO数据库(GSE20685、GSE20711、GSE48391、GSE135565、GSE146558、GSE42568数据集)和ICGC数据库(exp_array.BRCA-FR数据集)中的样本名称、生存时间、生存状态、差异表达基因的表达量作为验证集数据,根据预后模型风险评分中位数将乳腺癌患者分为高风险组与低风险组,基于R 4.0.5软件survival包对两组患者进行生存分析。利用R 4.0.5软件survivalROC包建立时间依赖ROC曲线以评估预后模型对乳腺癌预后的预测效能。
1.6 高风险组与低风险组差异表达基因分析利用R 4.0.5软件limma包获取TCGA数据库中高风险组患者与低风险组患者的差异表达基因,进行基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,同时利用单样本基因集富集分析(single sample gene set enrichment analysis,ssGSEA)对每个样品进行免疫细胞及免疫功能评分。
2 结果 2.1 与乳腺癌预后相关的差异表达铁死亡基因筛选共筛选出51个在乳腺癌组织与癌旁正常组织中存在差异表达的铁死亡基因(表 1)。共筛选出11个与乳腺癌预后相关的铁死亡基因,分别为花生四烯酸15-脂加氧酶(arachidonate 15-lipoxygenase,ALOX15)、CDGSH铁硫结构域1(CDGSH iron sulfur domain 1,CISD1)、阳离子转运调控样蛋白1(cation transport regulator-like protein 1,CHAC1)、柠檬酸合酶(citrate synthase,CS)、谷氨酸-半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、GPX4、核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)、内质网膜蛋白复合物2(endoplasmic reticulum membrane protein complex subunit 2,EMC2)、角鲨烯环氧化酶(squalene epoxidase,SQLE)、葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)、酰基辅酶A合成酶家族成员2(acyl-CoA synthetase family member 2,ACSF2),其中ALOX15(HR=1.282,95% CI 1.068~1.540,P=0.008)、CISD1(HR=1.565,95% CI 1.170~2.093,P=0.003)、CHAC1(HR=1.254,95% CI 1.022~1.539,P=0.030)、CS(HR=1.789,95% CI 1.230~2.601,P=0.002)、GCLC(HR=1.342,95% CI 1.018~1.769,P=0.037)、NCOA4(HR=1.349,95% CI 1.027~1.771,P=0.031)、EMC2(HR=1.768,95% CI 1.324~2.362,P<0.001)、SQLE(HR=1.231,95% CI 1.052~1.442,P=0.010)、G6PD(HR=1.317,95% CI 1.078~1.610,P= 0.007)为高风险基因,GPX4(HR=0.777,95% CI0.611~0.987,P=0.039)、ACSF2(HR=0.814,95% CI 0.685~0.968,P=0.020)为保护基因。
|
|
表 1 乳腺癌组织与癌旁正常组织中存在差异表达的铁死亡基因 Tab 1 Differentially expressed ferroptosis-related genes in breast cancer tissues and adjacent normal tissues |
将51个差异表达铁死亡基因与11个预后相关铁死亡基因进行交集,共获得11个与预后相关的差异表达铁死亡基因,分别为ALOX15、CHAC1、CISD1、CS、GCLC、NCOA4、EMC2、SQLE、G6PD、GPX4、ACSF2,其中GPX4与ACSF2是乳腺癌预后保护因素,其他均为预后危险因素。11个与乳腺癌预后相关的差异表达铁死亡基因在转录组数据和临床数据中的可视化分析、蛋白质-蛋白质相互作用网络图和共表达关系见图 1。

|
图 1 与乳腺癌预后相关的11个差异表达铁死亡基因可视化分析 Fig 1 Visual analysis of 11 differentially expressed ferroptosis-related genes associated with prognosis of breast cancer A: Heatmap based on transcriptome data; B: Tree diagram based on clinical data; C: Protein-protein interaction network; D: Correlation analysis. GPX4: Glutathione peroxidase 4; ACSF2: Acyl-CoA synthetase family member 2; CHAC1: Cation transport regulator-like protein 1; G6PD: Glucose-6-phosphate dehydrogenase; CISD1: CDGSH iron sulfur domain 1; EMC2: Endoplasmic reticulum membrane protein complex subunit 2; SQLE: Squalene epoxidase; ALOX15: Arachidonate 15-lipoxygenase; CS: Citrate synthase; GCLC: Glutamate-cysteine ligase catalytic subunit; NCOA4: Nuclear receptor coactivator 4; FC: Fold change; HR: Hazard ratio; CI: Confidence interval. |
2.2 基于铁死亡基因的乳腺癌预后模型的预测效能
利用LASSO回归方法得出乳腺癌预后风险评分模型:风险评分=ALOX15×0.11+CHAC1×0.07+ CISD1×0.15+CS×0.24+GCLC×0.04+GPX4×(-0.07)+NCOA4×0.17+EMC2×0.30+G6PD× 0.19+ACSF2×(-0.04)+SQLE×0.12。根据公式计算出每例患者的风险评分,中位数为4.277,风险评分≥4.277的患者归为高风险组,风险评分<4.277的患者归为低风险组,每组507例样本。对两组患者进行生存分析,结果显示高风险组与低风险组患者的生存率差异有统计学意义(P<0.001,图 2A);ROC曲线分析结果显示,该模型预测乳腺癌患者术后2、4、6年生存率的AUC分别为0.678、0.680、0.612(图 2B)。进一步绘制风险曲线和散点图,可见随着风险评分升高死亡患者逐渐增多(图 2C、2D)。单因素Cox回归分析结果(图 2E)显示,年龄(HR=1.507,95% CI 1.041~2.183,P=0.030)、肿瘤分期(HR=2.470,95% CI 1.759~ 3.469,P<0.001)、预后模型风险评分(HR=3.388,95% CI 2.283~5.029,P<0.001)均可影响乳腺癌患者的生存状态;多因素Cox回归分析结果(图 2F)显示,年龄(HR=1.610,95% CI 1.109~2.336,P=0.012)、肿瘤分期(HR=2.364,95% CI 1.679~ 3.328,P<0.001)、预后模型风险评分(HR=3.104,95% CI 2.103~4.580,P<0.001)均可作为乳腺癌的独立预后因子。
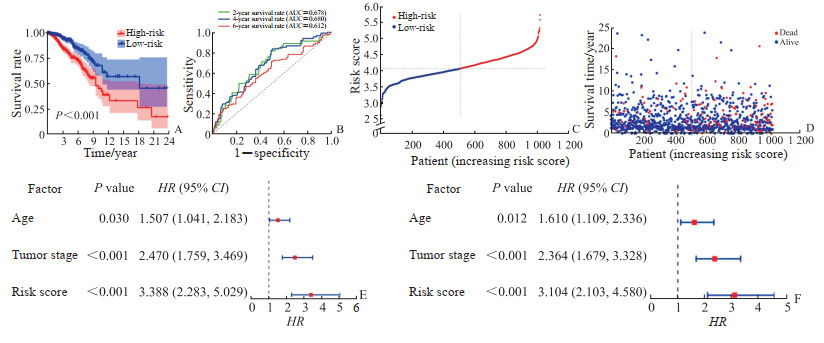
|
图 2 基于铁死亡基因的乳腺癌预后模型的预测效能 Fig 2 Prediction efficiency of breast cancer prognosis model based on ferroptosis-related genes A: Survival analysis; B: ROC curve analysis; C: Curve of risk model; D: Scatter diagram of risk model; E: Univariate Cox regression analysis; F: Multivariate Cox regression analysis. ROC: Receiver operating characteristic; AUC: Area under curve; HR: Hazard ratio; CI: Confidence interval. |
2.3 基于铁死亡基因的乳腺癌预后模型的验证
根据预后模型风险评分是否≥4.277将GEO数据库和ICGC数据库中的1 047例患者分为高风险组(201例)与低风险组(846例),生存分析结果显示,高风险组与低风险组患者生存率差异有统计学意义(P<0.001,图 3A)。ROC曲线分析显示该模型预测乳腺癌患者术后2、4、6年生存率的AUC分别为0.750、0.700、0.610(图 3B)。
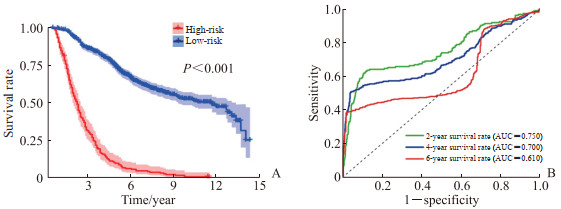
|
图 3 基于铁死亡基因的乳腺癌预后模型的验证 Fig 3 Validation of breast cancer prognosis model based on ferroptosis-related genes A: Survival analysis; B: ROC curve analysis. The model was validated by Gene Expression Omnibus (GEO) database and International Cancer Genome Consortium (ICGC) database. ROC: Receiver operating characteristic; AUC: Area under curve. |
2.4 高风险组与低风险组差异表达基因的特征分析
共获得乳腺癌高风险组与低风险组患者差异表达基因276个。GO富集分析结果(图 4A)显示,这些差异表达基因的生物过程与体液免疫、吞噬作用、补体激活等有关,细胞组分与Ig复合物、外侧质膜、细胞外基质胶原等有关,分子功能与受体-配体活性、信号受体激活剂活性、抗原结合等有关。KEGG富集分析结果(图 4B)显示,高风险组与低风险组差异表达基因与细胞因子−细胞因子受体相互作用、IL-17、细胞周期等信号通路相关。免疫细胞评分结果(图 4C)显示,激活的树突状细胞、树突状细胞、巨噬细胞、肥大细胞、自然杀伤细胞、滤泡辅助性T细胞、辅助性T细胞1、辅助性T细胞2、调节性T细胞、肿瘤浸润淋巴细胞在高风险组与低风险组之间存在差异(P均<0.05)。免疫功能评分结果(图 4D)显示,抗原提呈细胞共抑制、抗原提呈细胞共刺激、C-C基序趋化因子受体、检查点、促炎、主要组织相容性复合体Ⅰ、副炎症、T细胞共抑制、Ⅰ型干扰素反应、Ⅱ型干扰素反应、T细胞共刺激在高风险组与低风险组之间存在差异(P均<0.01)。
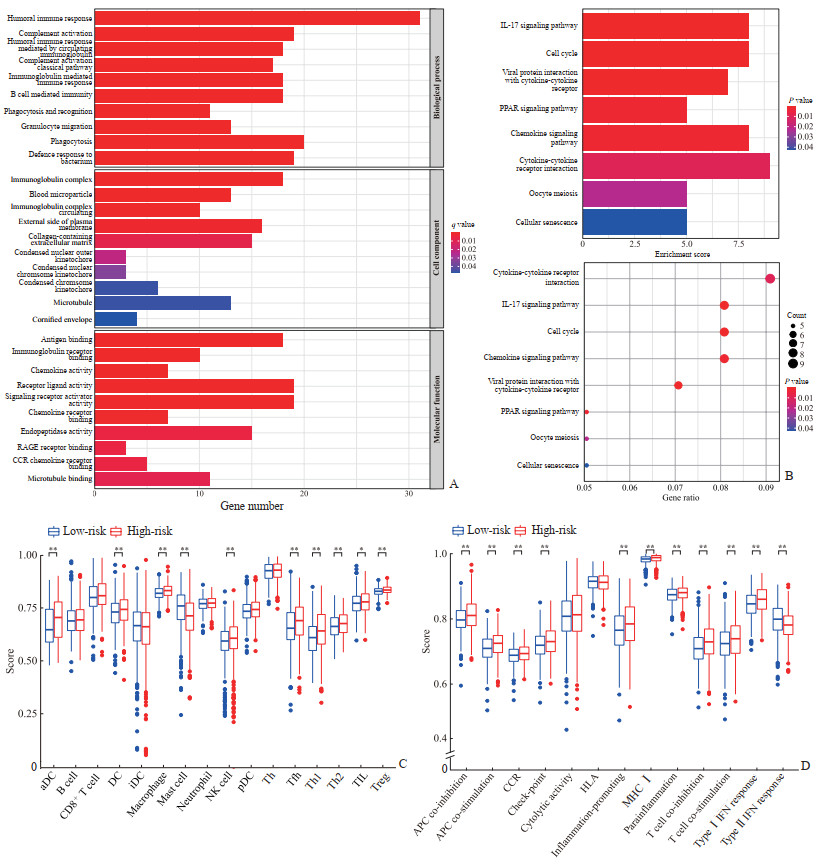
|
图 4 乳腺癌高风险组与低风险组差异表达基因的特征 Fig 4 Characteristics of differentially expressed genes between high-risk group and low-risk group A: GO enrichment analysis of differentially expressed genes; B: KEGG enrichment analysis of differentially expressed genes; C: Immune cell correlation score of differentially expressed genes; D: Immune function correlation score of differentially expressed genes. *P < 0.05, **P < 0.01. n=507, x±s. GO: Gene Ontology; KEGG: Kyoto Encyclopedia of Genes and Genomes; RAGE: Receptor of advanced glycation endproduct; CCR: C-C motif chemokine receptor; IL-17: Interleukin 17; PPAR: Peroxisome proliferator-activated receptor; aDC: Activated dendritic cell; DC: Dendritic cell; iDC: Immature dendritic cell; NK: Natural killer; pDC: Plasmacytoid dendritic cell; Tfh: Follicular helper T cell; Th: Helper T cell; TIL: Tumor infiltrating lymphocyte; Treg: Regulatery T cell; APC: Antigen presenting cell; HLA: Human leukocyte antigen; MHCⅠ: Major histocompatibility complex Ⅰ; IFN: Interferon. |
3 讨论
本研究通过挖掘TCGA数据库得到能够调控肿瘤发生、发展的铁死亡基因51个,与乳腺癌预后相关铁死亡基因取交集后,筛选出11个乳腺癌预后相关的差异表达铁死亡基因。对筛选得到的11个差异表达铁死亡基因构建乳腺癌预后模型,多因素Cox回归分析结果显示,该模型风险评分可作为乳腺癌预后的独立预测因子。根据风险评分中位数将患者分为高风险组与低风险组,在测试集与验证集中高风险组与低风险组患者生存率均存在差异。
本研究中构建乳腺癌预后模型的11个铁死亡基因分别为ALOX15、CHAC1、CISD1、CS、GCLC、NCOA4、EMC2、SQLE、G6PD、GPX4、ACSF2。CS作为三羧酸循环中的关键酶之一,在细胞能量代谢中发挥着重要作用。研究发现乳腺癌组织中的CS蛋白表达水平与癌旁组织相比明显上调,CS的表达升高与乳腺癌的恶性程度、组织学分级、淋巴结转移相关[6]。研究表明抑制糖酵解能够促进肿瘤细胞铁死亡的发生[7]。G6PD存在于红细胞内,协助葡萄糖进行代谢并产生还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)。除经典的GPX4抗氧化途径外,铁死亡抑制蛋白1-辅酶Q10-还原型烟酰胺腺嘌呤二核苷酸/NADPH途径也在铁死亡的抗氧化途径中发挥重要作用[8]。推测G6PD也可以通过抗氧化途径调节肿瘤细胞的铁死亡。ALOX15可促进erastin(一种铁死亡激活剂)诱导的血管平滑肌的铁死亡[9]。ALOX15特异性抑制剂能消除p53的转录靶标亚精胺/精胺N1-乙酰基转移酶1(spermidine/spermine N1-acetyltransferase 1,SAT1)过表达导致氧化应激下的脂质过氧化和铁死亡,过表达的SAT1能损伤肿瘤细胞[10]。CHAC1的下调通过激活三阴性乳腺癌的一般氨基酸调控阻遏蛋白2-真核细胞起始因子2α-转录激活因子4通路进而增强胱氨酸缺乏引起的铁死亡[11]。抑制CISD1能增强线粒体铁的聚集和一系列线粒体脂质过氧化来促进erastin诱导的铁死亡及肝细胞癌的铁死亡[12]。穿心莲和原花青素联合使用可通过激活代谢途径、增强铁死亡发挥抗肿瘤作用,GCLC可能参与该过程[13]。NCOA4与铁结合铁蛋白的相互作用在铁死亡过程中发挥着重要作用,阻断NCOA4-铁蛋白重链1(ferritin heavy chain 1,FTH1)与小分子的相互作用会导致生物可利用的Fe2+减少并抑制铁死亡[14]。EMC2在多种肿瘤中存在突变和甲基化,EMC2的高表达与乳腺癌的不良预后和肿瘤免疫细胞浸润有关[15]。SQLE的表达可以促进乳腺癌细胞的增殖,而阻断SQLE则可抑制其增殖、迁移和侵袭[16]。GPX4除作为铁死亡的经典抗氧化通路分子外,还可防止调节性T细胞发生脂质过氧化和铁死亡,从而调节免疫平衡和抗肿瘤免疫[17]。ACSF2和CS依赖的脂质合成通路可为铁死亡提供特定脂质前体[18]。此外,ACSF2的表达与深静脉血栓有关,在深静脉血栓的复发人群中ACSF2的表达显著下降[19],而乳腺癌患者术后外周中心静脉置管化学治疗可能会并发上肢深静脉血栓[20],提示ACSF2的表达有利于乳腺癌患者化学治疗后的预后。上述铁死亡基因在一定程度上能促进或抑制乳腺癌的进展,但是大部分铁死亡基因在乳腺癌预后机制中的具体通路尚不明确。
此外,本研究还探索了高风险组与低风险组之间生物过程、信号通路与免疫功能的差异。通过GO与KEGG富集分析对高风险组与低风险组患者之间差异表达的276个基因进行分析,结果显示这些基因与体液免疫、吞噬作用、补体激活、Ig复合物、抗原结合等有关,免疫细胞和免疫功能评分分析结果进一步提示高风险组与低风险组在免疫细胞和免疫功能上有显著差异。乳腺癌的预后与免疫密切相关,研究表明自然杀伤细胞与乳腺癌的治疗效果有关[21]。乳腺癌细胞能激活巨噬细胞中的信号转导与转录激活因子5(signal transducer and activator of transcription 5,STAT5),调节肿瘤微环境,从而影响乳腺癌的进展[22]。C-C基序趋化因子受体5作为一个潜在的抑癌基因,与三阴性乳腺癌预后相关,可作为三阴性乳腺癌潜在的治疗靶点[23]。较高的浆细胞水平能更好地改善激素受体阴性患者的预后,具有更长的无病生存期[24]。铁死亡在肿瘤的免疫治疗过程中具有重要作用,铁死亡抑制剂liproxstatin-1能减弱细胞毒性T淋巴细胞相关蛋白4抗体和程序性死亡配体1抗体联合使用对肿瘤细胞生长的抑制作用[25]。以上研究结果提示铁死亡很可能通过调节免疫而参与调控乳腺癌的预后。
本研究还存在一些局限性。首先,本研究主要依据TCGA数据库,为了提高模型的准确性,应采集更多的乳腺癌相关数据进一步验证。其次,本研究只对铁死亡基因进行分析,可能存在其他能更精准预测乳腺癌预后的基因。最后,本研究没有分析不同亚型乳腺癌铁死亡基因的差异,进一步收集数据探究铁死亡基因及其与不同亚型乳腺癌的关系对乳腺癌的临床治疗具有重要意义。
综上所述,本研究通过TCGA数据库挖掘到与乳腺癌预后相关的11个铁死亡基因并构建了预后模型,该模型中的铁死亡基因为乳腺癌靶向治疗策略提供了新的靶点。
| [1] |
李宜臻, 郑怡, 邓玉皎, 吴英, 杨思, 代志军. 1990-2019年中国女性乳腺癌疾病负担及危险因素研究[J]. 中国循证医学杂志, 2021, 21: 876-881. |
| [2] |
周文博, 孔晨飞, 秦高伟, 王媛媛, 刘新, 王晓峰. 铁死亡发生机制的研究进展[J]. 生物化学与生物物理进展, 2018, 45: 16-22. |
| [3] |
SHA R, XU Y, YUAN C, SHENG X, WU Z, PENG J, et al. Predictive and prognostic impact of ferroptosis-related genes ACSL4 and GPX4 on breast cancer treated with neoadjuvant chemotherapy[J/OL]. EBioMedicine, 2021, 71: 103560. DOI: 10.1016/j.ebiom.2021.103560
|
| [4] |
张伟, 刘洋, 田艳妮, 黄盼, 石静, 梁华, 等. miR-1287通过干扰GPX4的表达调控乳腺癌细胞的增殖[J]. 现代肿瘤医学, 2021, 29: 1124-1129. DOI:10.3969/j.issn.1672-4992.2021.07.006 |
| [5] |
闫莉. 隐丹参酮通过铁死亡抑制三阴性乳腺癌的机制研究[D]. 上海: 海军军医大学, 2021.
|
| [6] |
何广宁, 蔡志煅, 邓润枢, 温润耀, 邓丁梅, 张爱玲. 柠檬酸合成酶在乳腺癌中的表达及临床意义[J]. 岭南现代临床外科, 2018, 18: 257-260. DOI:10.3969/j.issn.1009-976X.2018.03.004 |
| [7] |
ŽDRALEVI Ć M, VU Č ETI Ć M, DAHER B, MARCHIQ I, PARKS S K, POUYSSÉGUR J. Disrupting the 'Warburg effect' re-routes cancer cells to OXPHOS offering a vulnerability point via 'ferroptosis'-induced cell death[J]. Adv Biol Regul, 2018, 68: 55-63. DOI:10.1016/j.jbior.2017.12.002 |
| [8] |
曾耀莹, 吴建春, 骆莹滨, 鞠旭东, 方志红, 许荣忠, 等. 天然化合物通过铁死亡途径抗肿瘤作用的研究进展[J]. 中国肿瘤, 2021, 30: 867-874. |
| [9] |
杨茜, 郑宪鑫, 朱亮, 唐锡龙, 李永红. ALOX15对血管平滑肌细胞铁死亡的影响[J]. 青岛大学学报(医学版), 2021, 57: 912-914. |
| [10] |
OU Y, WANG S J, LI D W, CHU B, GU W. Activation of SAT1 engages polyamine metabolism with p53-mediated ferroptotic responses[J/OL]. Proc Natl Acad Sci USA, 2016, 113: E6806-E6812. DOI: 10.1073/pnas.1607152113
|
| [11] |
CHEN M S, WANG S F, HSU C Y, YIN P H, YEH T S, LEE H C, et al. CHAC1 degradation of glutathione enhances cystine-starvation-induced necroptosis and ferroptosis in human triple negative breast cancer cells via the GCN2-eIF2α-ATF4 pathway[J]. Oncotarget, 2017, 8: 114588-114602. DOI:10.18632/oncotarget.23055 |
| [12] |
YUAN H, LI X M, ZHANG X Y, KANG R, TANG D L. CISD1 inhibits ferroptosis by protection against mitochondrial lipid peroxidation[J]. Biochem Biophys Res Commun, 2016, 478: 838-844. DOI:10.1016/j.bbrc.2016.08.034 |
| [13] |
SHIMURA T, SHARMA P, SHARMA G G, BANWAIT J K, GOEL A. Enhanced anti-cancer activity of andrographis with oligomeric proanthocyanidins through activation of metabolic and ferroptosis pathways in colorectal cancer[J/OL]. Sci Rep, 2021, 11: 7548. DOI: 10.1038/s41598-021-87283-y
|
| [14] |
FANG Y, CHEN X, TAN Q, ZHOU H, XU J, GU Q. Inhibiting ferroptosis through disrupting the NCOA4-FTH1 interaction: a new mechanism of action[J]. ACS Cent Sci, 2021, 7: 980-989. DOI:10.1021/acscentsci.0c01592 |
| [15] |
LIU X, YANG P, HAN L, ZHOU Q, QU Q, SHI X. The ncRNA-mediated overexpression of ferroptosis-related gene EMC2 correlates with poor prognosis and tumor immune infiltration in breast cancer[J/OL]. Front Oncol, 2021, 11: 777037. DOI: 10.3389/fonc.2021.777037
|
| [16] |
TANG W Q, XU F S, ZHAO M, ZHANG S Q. Ferroptosis regulators, especially SQLE, play an important role in prognosis, progression and immune environment of breast cancer[J/OL]. BMC Cancer, 2021, 21: 1160. DOI: 10.1186/s12885-021-08892-4
|
| [17] |
XU C X, SUN S G, JOHNSON T, QI R, ZHANG S Y, ZHANG J, et al. The glutathione peroxidase Gpx4 prevents lipid peroxidation and ferroptosis to sustain Treg cell activation and suppression of antitumor immunity[J/OL]. Cell Rep, 2021, 35: 109235. DOI: 10.1016/j.celrep.2021.109235
|
| [18] |
DIXON S J, LEMBERG K M, LAMPRECHT M R, SKOUTA R, ZAITSEV E M, GLEASON C E, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [19] |
MONTES R, GURUCEAGA E, GONZÁLEZ-PORRAS J R, REVERTER J C, MARCO P, PINA E, et al. Identification of new markers of recurrence in patients with unprovoked deep vein thrombosis by gene expression profiling: the retro study[J]. Eur J Haematol, 2016, 97: 128-136. DOI:10.1111/ejh.12692 |
| [20] |
邢雷, 孔令泉, 厉红元, 任国胜, 罗凤, 吴凯南. 乳腺癌患者携带PICC化疗并发PICC相关性上肢深静脉血栓形成的诊治探讨[J]. 中国肿瘤临床, 2011, 38: 1223-1226. DOI:10.3969/j.issn.1000-8179.2011.19.012 |
| [21] |
ZEMLIN C, STUHLERT C, SCHLEICHER J T, WÖRMANN C, ALTMAYER L, LANG M, et al. Longitudinal assessment of physical activity, fitness, body composition, immunological biomarkers, and psychological parameters during the first year after diagnosis in women with non-metastatic breast cancer: the BEGYN study protocol[J/OL]. Front Oncol, 2021, 11: 762709. DOI: 10.3389/fonc.2021.762709
|
| [22] |
JESSER E A, BRADY N J, HUGGINS D N, WITSCHEN P M, O CONNOR C H, SCHWERTFEGER K L. STAT5 is activated in macrophages by breast cancer cell-derived factors and regulates macrophage function in the tumor microenvironment[J/OL]. Breast Cancer Res, 2021, 23: 104. DOI: 10.1186/s13058-021-01481-0
|
| [23] |
WANG X, HAN Y, PENG J M, HE J. CCR5 is a prognostic biomarker and an immune regulator for triple negative breast cancer[J]. Aging, 2021, 13: 23810-23830. DOI:10.18632/aging.203654 |
| [24] |
SAKAGUCHI A, HORIMOTO Y, ONAGI H, IKARASHI D, NAKAYAMA T, NAKATSURA T, et al. Plasma cell infiltration and treatment effect in breast cancer patients treated with neoadjuvant chemotherapy[J/OL]. Breast Cancer Res, 2021, 23: 99. DOI: 10.1186/s13058-021-01477-w
|
| [25] |
WANG W M, GREEN M, CHOI J E, GIJÓN M, KENNEDY P D, JOHNSON J K, et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy[J]. Nature, 2019, 569: 270-274. DOI:10.1038/s41586-019-1170-y |
 2022, Vol. 43
2022, Vol. 43


