2. 海军军医大学(第二军医大学)第二附属医院医务处,上海 200003;
3. 海军军医大学(第二军医大学)第一附属医院肛肠外科,上海 200433
2. Medical Affair Office, The Second Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200003, China;
3. Department of Colorectal Surgery, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China
大多数新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)患者在感染严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)后会出现抗原抗体反应,在这一过程中免疫系统会产生IgA、IgG和IgM等多种抗体,并且抗体的滴度会随时间推移发生动态变化[1]。研究表明,COVID-19患者出现症状后7~14 d,其血清中可以明确检出抗SARS-CoV-2 IgM或IgG,并且这些抗体的滴度总体呈现先升高后降低的趋势[2-3]。通常在COVID-19患者出现症状1周后可检测到IgM,持续时间约1个月[4],其血清转换率峰值在症状出现后20~22 d。而IgG可在发病后10 d被检测到,其滴度在感染后3~4周达到峰值,并在7个月后开始下降[3],也有学者认为IgG在体内可能持续更长时间[5]。另有研究表明,COVID-19患者的IgG出现血清转换的时间可能与IgM相同或更早[6]。患者血清中的抗体水平也可能与疾病的临床分型及预后有关。Zhao等[2]的研究结果表明较高的抗体滴度与较差临床分型独立相关。Huang等[3]发现,重型COVID-19患者体内的抗体水平较高。但也有学者对这种关联提出了质疑[6]。
目前已发表的研究大多集中在SARS-CoV-2感染后抗体血清转换率的变化或特定患者的抗体滴度轨迹研究方面[3, 7],对抗体滴度轨迹的纵向发展模式及这些模式的内在异质性进行探索的研究较少。本研究假设不同轨迹组在基线特征及临床结局方面可能存在差异,分析COVID-19患者住院期间定量检测的IgG滴度的动态变化轨迹,并对轨迹中可能存在的不同模式(轨迹组)进行建模,探索不同模式下患者免疫过程的异质性,揭示抗体滴度与疾病特征的关联。
1 资料和方法 1.1 研究设计本研究为回顾性队列研究。COVID-19患者的数据来自武汉市火神山医院和湖北省妇幼保健院光谷院区。患者入院时间为2020年2月5日至4月15日。所有入选病例均为依据国家卫生健康委员会发布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》[8]确诊的COVID-19患者。本研究通过海军军医大学(第二军医大学)医学伦理委员会审批。本研究从医院病历系统中收集数据时隐去了患者姓名、住址等识别信息。
1.2 数据收集从医院的电子病历系统中提取COVID-19患者的基线资料,从实验室信息中提取患者症状出现后80 d内IgG滴度的定量检测数据。将研究时间内IgG定量检测不少于2次的确诊患者纳入最终数据集,收集所有纳入患者的入院病情、人口学资料、并发症、生命体征及实验室检查指标。患者的入院病情依据前述诊疗方案[8]分为轻、普通、重、危重4型。临床结局指标包括患者的病毒清除时间(患者从出现症状至最后一次鼻咽拭子RNA检测阴性的天数)、住院天数(入院至出院的天数)、住院期间病情恶化(患者入院时分配在普通病房,但住院期间存在转入ICU的记录)情况及全因死亡率。
1.3 统计学处理本研究应用基于组的轨迹模型(group-based trajectory modeling,GBTM)对IgG定量检测的时间序列数据进行处理,以识别出具有相似抗体轨迹的亚组。GBTM是有限混合模型的一种特殊形式,常被用于研究变量随时间变化的发展轨迹,可以识别出在时间线上具有相似发展模式的个体并将其归类到同一轨迹组[9-10]。本研究在对患者抗体滴度数据进行对数转换后分别采用0~3次模型的不同组合拟合了模型在2~6个轨迹组的所有可能情形。以贝叶斯信息准则(Bayesian information criterion,BIC)作为判断最优组数的标准。考虑到临床意义,分配到最小组的患者占比不低于纳入患者的5%。采用的其他验证指标包括Nagin[9]建议的平均后验分配概率(average posterior probability of assignment,AvePP)(>0.7)和正确分类的优势(odds of correct classification,OCC)(>5)。
正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析;偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis检验;计数资料以例数和百分数表示,组间比较采用χ2检验或Fisher确切概率法。所有检验均为双侧检验,检验水准(α)为0.05。轨迹模型的构建使用SAS 9.4软件中的TRAJ过程[11]和Stata中的traj包[12]实现。其他统计学分析使用SAS 9.4软件完成。
2 结果 2.1 基线特征共提取4 809例入院记录,剔除不符合诊断标准的5例后得到4 804例确诊COVID-19患者的数据。剔除2 839例无IgG滴度定量检测或检测值异常的患者,剔除1 231例抗体定量检测次数<2次的患者,最终纳入符合条件的患者734例。如表 1所示,COVID-19患者的年龄为62.00(51.00,70.00)岁,52.72%(387例)为男性。根据患者的病情分类,轻型和普通型患者占总纳入病例的62.13%(456例),重型和危重型COVID-19患者占37.87%(278例)。与轻型和普通型患者相比,重型和危重型患者的年龄较大,血红蛋白水平和淋巴细胞计数较低,中性粒细胞和白细胞计数较高,CRP、D-二聚体和IL-6水平较高,糖尿病和高血压患者占比较高(P均<0.001)。
|
|
表 1 纳入研究的COVID-19患者的基线特征 Tab 1 Baseline characteristics of COVID-19 patients enrolled in this study |
2.2 抗体轨迹
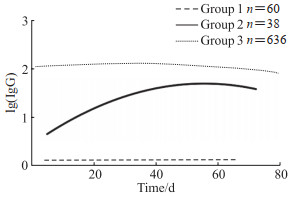
GBTM选择3组的组合为最优模型,模型选择过程的性能指标见表 2。患者的IgG滴度轨迹如图 1所示,其中组1(持续低抗体组)包含样本中8.17%(60例)的患者,该组患者的IgG滴度变化较小,且始终处于较低水平。组2(中等抗体组)包含样本中5.18%(38例)的患者,其初始IgG滴度处在其他两组之间,但随后呈现出上升趋势。组3(高抗体组)包含样本中86.65%(636例)的患者,该组患者IgG滴度最高,但随着时间增加有轻微下降趋势。
|
|
表 2 用于选择最优组数的性能指标 Tab 2 Performance indicators for choosing the best number of groups |
|
图 1 COVID-19患者的IgG滴度轨迹分组 Fig 1 Trajectory groups of IgG titers for COVID-19 patients COVID-19: Coronavirus disease 2019; IgG: Immunoglobulin G. |
各轨迹组COVID-19患者的结局资料见表 3。3组患者的住院天数和病毒清除时间差异均有统计学意义(P均<0.001),组1患者的住院天数和病毒清除时间均最短;而全因死亡率和病情恶化率在3组间差异均无统计学意义(P均>0.05)。
|
|
表 3 各IgG滴度轨迹组COVID-19患者结局的比较 Tab 3 Comparison of outcomes among different IgG titer trajectory groups |
各轨迹组的基线描述情况如表 4所示。3组间血小板计数、总蛋白、白蛋白/球蛋白、尿素水平、总胆红素水平、肌酸激酶同工酶水平和出现咳嗽、乏力、发热症状的患者占比差异均有统计学意义(P均<0.05),其中组1患者的白蛋白/球蛋白和出现咳嗽、乏力及发热症状者占比较低,组2患者的肌酸激酶同工酶水平较低,组3患者的血小板计数和尿素、总胆红素水平较低。另外,组1患者在入院时病情为轻型和普通型者占比较高,但3组间的差异无统计学意义(P=0.066)。
|
|
表 4 各IgG滴度轨迹组COVID-19患者的临床特征比较 Tab 4 Comparison of clinical characteristics of COVID-19 patients among different IgG titer trajectory groups |
3 讨论
本研究应用基于组的轨迹分析方法研究了COVID-19患者症状出现后IgG滴度的发展轨迹,识别出了3个不同的抗体轨迹组,3组间的临床结局特别是住院天数和病毒清除时间存在差异,表明IgG滴度稳定且持续较低的COVID-19患者有较好的临床结局。
有研究显示,患者感染SARS-CoV-2后体内的抗体浓度通常呈先升后降的趋势,并且抗体轨迹在不同患者间存在异质性[3]。既往研究表明,抗体反应较强的患者通常病情更严重,预后也较差[13]。本研究中不同轨迹组患者的IgG滴度变化模式及不同模式与临床结局的关联和上述研究结果一致。推测存在这种关联可能与病毒载量(viral load)有关。病毒载量反映了患者体内病毒数量的多少,它与疾病传染性、表型、发病率和死亡率有关,是患者临床结局的独立预测因素,入院时病情较重的患者通常有更高的病毒载量[14]。研究发现,入院时病情较重的患者体内有更高的抗体水平,并且有症状者的抗体水平比无症状者高[3, 15]。由此推测,对于部分重型COVID-19患者,高病毒载量可能使机体产生持续的强免疫反应,将抗体滴度维持在较高水平,从而表现出高抗体滴度与较差结局关联的现象。也有研究认为,患者感染后的抗体滴度可能与病毒载量呈负相关或无关[16-17],因此这种关联仍需进一步的前瞻性研究来验证。另一个可能的原因是细胞因子风暴(cytokine storm),当机体对SARS-CoV-2的免疫反应活跃时体内炎症反应增强,细胞因子短期分泌增加,从而加重组织细胞损伤。既往研究表明,细胞因子风暴与COVID-19患者的疾病严重程度显著相关[18]。另外,抗体依赖性增强(antibody-dependent enhancement,ADE)也可能在这一关联中发挥作用。当ADE发生时,病毒对免疫细胞的感染能力增强。这种效应在登革热和严重急性呼吸综合征(severe acute respiratory syndrome,SARS)等病毒感染性疾病患者中均有出现[19]。一项针对恢复期COVID-19患者血清样本的体外研究发现,血清中部分SARS-CoV-2抗受体结合域和抗S1抗体可通过Fcγ受体依赖的机制诱导病毒进入Raji细胞,从而产生ADE效应[20],说明IgG水平较高的患者体内可能出现更强的ADE效应。然而本研究纳入患者的实验室指标中未找到支持这一推测的证据。
不同轨迹组的患者在部分实验室指标和临床症状方面有所差异。然而在实验室检查中,只观察到少量指标在不同轨迹组间存在差异,且差异较小,因此,通过血常规和血生物化学指标来预测IgG的发展轨迹可能较为困难。本研究发现抗体滴度持续较低的患者入院时有临床症状者占比较低,并且有症状的患者中轻型和普通型患者的占比也相对较低,这与既往研究的结论[21]一致。
本研究存在一些局限:(1)在研究人群的纳入过程中,2家医院的部分患者由其他医疗机构转入,这些患者从症状出现到入院的时间间隔较长,发病早期抗体滴度数据缺失。(2)患者出院后的随访资料缺乏,长时间的定量检测数据较少,这限制了本研究在更长时间范围内对IgG滴度轨迹进行探索。(3)纳入的部分患者的身高、体重等基线资料缺失。有研究表明COVID-19患者的BMI可能与预后无关[22]。(4)由于接受IgG定量检测的患者较少,难以排除病例选择偏倚。(5)尽管控制了样本量最小组患者的比例,在模型中不同轨迹组内分配的患者数量仍存在较大差异,一些亚组中仅包含少数患者,这可能对统计效能造成影响。
综上所述,本研究通过基于组的轨迹分析方法从COVID-19患者的IgG滴度发展轨迹中识别出了具有不同模式的轨迹组,这些组中包含了抗体随时间变化的信息,它们可能反映了机体对SARS-CoV-2不同的免疫过程。研究结果表明抗体滴度持续较低的COVID-19患者可能有更好的临床结局,持续定量监测患者体内的抗体滴度可能为患者的风险评估提供帮助。未来仍然需要开展大样本量、长监测时间及针对不同类型抗体的前瞻性研究来验证这一结论。
| [1] |
HUESTON L, KOK J, GUIBONE A, MCDONALD D, HONE G, GOODWIN J, et al. The antibody response to SARS-CoV-2 infection[J/OL]. Open Forum Infect Dis, 2020, 7: ofaa387. DOI: 10.1093/ofid/ofaa387
|
| [2] |
ZHAO J J, YUAN Q, WANG H Y, LIU W, LIAO X J, SU Y Y, et al. Antibody responses to SARS-CoV-2 in patients with novel coronavirus disease 2019[J]. Clin Infect Dis, 2020, 71: 2027-2034. DOI:10.1093/cid/ciaa344 |
| [3] |
HUANG M, LU Q B, ZHAO H, ZHANG Y L, SUI Z W, FANG L Q, et al. Temporal antibody responses to SARS-CoV-2 in patients of coronavirus disease 2019[J/OL]. Cell Discov, 2020, 6: 64. DOI: 10.1038/s41421-020-00209-2.
|
| [4] |
ZHANG G X, NIE S K, ZHANG Z, ZHANG Z T. Longitudinal change of SARS-CoV2 antibodies in patients with COVID-19[J]. J Infect Dis, 2020, 222: 183-188. DOI:10.1093/infdis/jiaa229 |
| [5] |
GUDBJARTSSON D F, NORDDAHL G L, MELSTED P, GUNNARSDOTTIR K, HOLM H, EYTHORSSON E, et al. Humoral immune response to SARS-CoV-2 in Iceland[J]. N Engl J Med, 2020, 383: 1724-1734. DOI:10.1056/NEJMoa2026116 |
| [6] |
TO K K, TSANG O T, LEUNG W S, TAM A R, WU T C, LUNG D C, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study[J]. Lancet Infect Dis, 2020, 20: 565-574. DOI:10.1016/S1473-3099(20)30196-1 |
| [7] |
LEE Y L, LIAO C H, LIU P Y, CHENG C Y, CHUNG M Y, LIU C E, et al. Dynamics of anti-SARS-Cov-2 IgM and IgG antibodies among COVID-19 patients[J/OL]. J Infect, 2020, 81: e55-e58. DOI: 10.1016/j.jinf.2020.04.019.
|
| [8] |
中华人民共和国国家卫生健康委员会. 新型冠状病毒感染的肺炎诊疗方案(试行第五版)[EB/OL]. (2020-02-05)[2021-02-05]. http://www.nhc.gov.cn/yzygj/s7653p/202002/3b09b894ac9b4204a79db5b8912d4440/files/7260301a393845fc87fcf6dd52965ecb.pdf
|
| [9] |
NAGIN D S. Group-based modeling of development[M]. Cambridge, MA: Harvard University Press, 2005: 23-44, 84-89.
|
| [10] |
NAGIN D S, ODGERS C L. Group-based trajectory modeling in clinical research[J]. Annu Rev Clin Psychol, 2010, 6: 109-138. DOI:10.1146/annurev.clinpsy.121208.131413 |
| [11] |
JONES B L, NAGIN D S, ROEDER K. A SAS procedure based on mixture models for estimating developmental trajectories[J]. Sociol Methods Res, 2001, 29: 374-393. DOI:10.1177/0049124101029003005 |
| [12] |
JONES B L, NAGIN D S. A note on a Stata plugin for estimating group-based trajectory models[J]. Sociol Methods Res, 2013, 42: 608-613. DOI:10.1177/0049124113503141 |
| [13] |
BATRA M, TIAN R X, ZHANG C X, CLARENCE E, SACHER C S, MIRANDA J N, et al. Role of IgG against N-protein of SARS-CoV2 in COVID19 clinical outcomes[J/OL]. Sci Rep, 2021, 11: 3455. DOI: 10.1038/s41598-021-83108-0.
|
| [14] |
LIU Y, YAN L M, WAN L G, XIANG T X, LE A P, LIU J M, et al. Viral dynamics in mild and severe cases of COVID-19[J]. Lancet Infect Dis, 2020, 20: 656-657. DOI:10.1016/S1473-3099(20)30232-2 |
| [15] |
ZHANG X Y, LU S W, LI H, WANG Y, LU Z, LIU Z H, et al. Viral and antibody kinetics of COVID-19 patients with different disease severities in acute and convalescent phases: a 6-month follow-up study[J]. Virol Sin, 2020, 35: 820-829. DOI:10.1007/s12250-020-00329-9 |
| [16] |
REN L L, FAN G H, WU W J, GUO L, WANG Y M, LI X, et al. Antibody responses and clinical outcomes in adults hospitalized with severe coronavirus disease 2019 (COVID-19): a post hoc analysis of LOTUS China trial[J/OL]. Clin Infect Dis, 2021, 72: e545-e551. DOI: 10.1093/cid/ciaa1247.
|
| [17] |
LI L, TAN C, ZENG J, LUO C, HU S, PENG Y K, et al. Analysis of viral load in different specimen types and serum antibody levels of COVID-19 patients[J/OL]. J Transl Med, 2021, 19: 30. DOI: 10.1186/s12967-020-02693-2.
|
| [18] |
LUCAS C, WONG P, KLEIN J, CASTRO T B R, SILVA J, SUNDARAM M, et al. Longitudinal analyses reveal immunological misfiring in severe COVID-19[J]. Nature, 2020, 584: 463-469. DOI:10.1038/s41586-020-2588-y |
| [19] |
KATZELNICK L C, GRESH L, HALLORAN M E, MERCADO J C, KUAN G, GORDON A, et al. Antibody-dependent enhancement of severe dengue disease in humans[J]. Science, 2017, 358: 929-932. DOI:10.1126/science.aan6836 |
| [20] |
ZHOU Y J, LIU Z Z, LI S B, XU W, ZHANG Q Q, SILVA I T, et al. Enhancement versus neutralization by SARS-CoV-2 antibodies from a convalescent donor associates with distinct epitopes on the RBD[J/OL]. Cell Rep, 2021, 34: 108699. DOI: 10.1016/j.celrep.2021.108699.
|
| [21] |
GUAN W J, NI Z Y, HU Y, LIANG W H, OU C Q, HE J X, et al. Clinical characteristics of coronavirus disease 2019 in China[J]. N Engl J Med, 2020, 382: 1708-1720. DOI:10.1056/NEJMoa2002032 |
| [22] |
CUMMINGS M J, BALDWIN M R, ABRAMS D, JACOBSON S D, MEYER B J, BALOUGH E M, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study[J]. Lancet, 2020, 395: 1763-1770. DOI:10.1016/S0140-6736(20)31189-2 |
 2022, Vol. 43
2022, Vol. 43


