缺血性心脏病给人类健康带来巨大威胁,目前的传统治疗措施如药物溶栓、介入治疗及外科手术治疗均不能修复坏死的血管内皮,为疾病的转归带来极大的难题。间充质干细胞的发现为治疗缺血性疾病提供了新方法,它可在缺血缺氧环境下保护内皮细胞,维持内皮细胞的生理功能,并促进血管再生[1],它主要通过旁分泌机制促进内皮修复[2],而外泌体作为旁分泌机制中的重要部分受到越来越多的重视。
外泌体是细胞分泌的一种囊状小泡,直径为50~150 nm,可携带多种功能性小分子(如蛋白质、mRNA、miRNA等),也可用作生物活性物质或治疗药物的运载工具。外泌体具有免疫原性低、无成瘤风险、可外周静脉给药等优点[3],因此极具临床研究价值。目前外泌体在心脑血管病领域已经得到广泛研究。在各类急性心肌梗死和缺血/再灌注损伤动物模型中,注射移植间充质干细胞来源的外泌体可有效促进梗死区血管新生,从而恢复心功能[4]。
miRNA是外泌体中重要的内容物,研究发现血浆中外泌体包裹的miRNA不仅可传递心肌缺血信号,还可在心肌缺血中发挥保护功能[5]。已有研究证实,miRNA-132可以促进肿瘤血管新生,抑制miRNA-132可将血管新生维持在静息状态[6]。miRNA-132可增强人真皮成纤维细胞的迁移能力,从而促进损伤修复[7]。重组人血管内皮生长因子C(vascular endothelial growth factor-C,VEGF-C)可提高脂肪来源间充质干细胞中miRNA-132的表达量,从而促进淋巴管的生成[8]。上述研究结果均提示miRNA-132对内皮细胞具有保护作用,但其对缺氧环境中内皮细胞的保护功能及机制尚不清楚。本研究利用体外内皮细胞缺氧模型探讨装载miRNA-132的外泌体对内皮细胞的保护功能。
1 材料和方法 1.1 细胞培养人脐带间充质干细胞(umbilical cord mesenchymal stem cell,UMSC)与人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)均购于江苏和泽生物科技有限公司。UMSC培养于DMEM-F12完全培养基中[培养基配制:89% DMEM-F12(美国Gibco公司)+10% FBS(美国Gibco公司)+1%青霉素-链霉素混合液]。HUVEC培养于含EGM-2 MV的EBM-2培养基中(瑞士Lonza公司)。
1.2 外泌体分离与鉴定利用超速离心处理得到的无外泌体的FBS收集外泌体。UMSC来源外泌体的分离方法如下:先分别以300×g、2 000×g、10 000×g离心10、10和30 min,每次离心后的样品上清用于下一轮离心;然后以120 000×g离心70 min,并进行2轮;最后以0.5 mL PBS重悬外泌体。外泌体保存在4 ℃中,保存时间短于1周。利用BCA蛋白定量试剂盒(上海碧云天生物技术有限公司)对外泌体中的蛋白质进行定量,采用蛋白质印迹法检测外泌体表面标志物CD63和CD9的表达(CD63和CD9抗体购自英国Abcam公司,稀释比例为1∶1 000)。利用透射电子显微镜(日本Olympus公司)对外泌体的形态学进行观察。
1.3 外泌体装载miRNA-132利用电转移法将miRNA-132 mimics或miRNA-132阴性对照(negative control,NC)[生工生物工程(上海)股份有限公司]转导至外泌体中,具体方法如下:将外泌体(悬液和电穿孔缓冲液按照1∶1的比例充分混合均匀,室温静置5 min;向混合液中加入miRNA-132 NC或miRNA-132 mimics(每200 μL加入1 μmol miRNA-132 NC或miRNA-132 mimics),随后取200 μL加入电转管内;将电转管放入Gene Pulser Ⅱ电转系统(美国Bio-Rad公司)内,于150 V、100 μF条件下进行电转移。使用RNA酶H对电转移完毕的外泌体悬液进行处理,去除未电转入外泌体中的散在miRNA-132 NC、miRNA-132 mimics。将电转miRNA-132 NC的对照外泌体命名为Exo,电转miRNA-132 mimics的外泌体命名为miRNA-132 Exo。利用qPCR检测外泌体中miRNA-132的表达(qPCR试剂盒购自日本TaKaRa公司)。
1.4 HUVEC与外泌体的缺氧共培养为了模拟疾病中血管内皮细胞在缺氧状态下所受到的损伤,本研究利用低氧培养的方式诱导HUVEC的缺氧损伤。先将HUVEC分为3组,分别加入等体积的PBS、Exo和miRNA-132 Exo,然后将细胞在37 ℃、5% CO2、1% O2的低氧恒温培养箱中培养48 h,构建缺氧损伤的HUVEC模型。
1.5 HUVEC增殖能力检测采用CCK-8法检测HUVEC的增殖能力。细胞计数后制成密度为5×104/mL的悬液,按照每孔100 μL细胞悬液接种到96孔板中,培养24 h;取出培养板,弃上清,PBS洗涤细胞,然后每孔中加入10 μL CCK-8试剂,在培养箱中反应4 h;最后用酶标仪在450 nm波长处检测光密度(D450)值。
1.6 HUVEC成管能力检测采用管样形成实验评估HUVEC在体外的成管能力。将基质胶铺于96孔板中,待其凝固后每组取3×104个细胞接种到基质胶上;将完成接种的96孔板置于37 ℃、5% CO2培养箱内恒温培养6 h;使用相差显微镜观察成管情况,并拍照记录。利用ImageJ软件分析成管结果。
1.7 HUVEC迁移能力检测采用Transwell迁移实验评估HUVEC的迁移能力。使用无血清培养基将细胞制成密度为1×105/mL的细胞悬液,并按照每孔200 μL加入Transwell小室的上层,下层加入完全培养基;置于培养箱中孵育12 h;孵育完成后,用湿润的棉球轻轻擦去膜上层残留的细胞,然后用4%多聚甲醛溶液固定,利用DAPI对细胞核进行染色;最后在荧光显微镜下观察、拍照并计数。
1.8 miRNA-132靶点预测与验证利用TargetScan数据库对miRNA-132的靶点进行预测,筛选发现Ras p21蛋白活化子1(Ras p21 protein activator 1,RASA1)可能为其下游靶点且与血管形成过程有关。
(1)采用双萤光素酶报告基因实验验证miRNA-132与RASA1的结合活性。将293T细胞接种到24孔板,达到80%融合时开始转染;将3 µL Lipofectamine® 2000(美国Invitrogen公司)加入到50 µL无抗生素、无血清的培养基中,混匀;将构建的重组质粒加入50 µL无抗生素、无血清的培养基混匀,其中miRNA-132过表达质粒每孔100 ng,野生型或突变型RASA1的3'-非翻译区(untranslated region,UTR)重组质粒每孔300 ng;混合以上2个体系,室温孵育20 min;取混匀的转染体系100 µL加入细胞培养板,6 h后将培养基换成加青霉素-链霉素和FBS的培养基,培养48 h后用双萤光素酶报告系统分析萤光素酶活性。
(2)采用qPCR和蛋白质印迹法检测常氧条件下HUVEC、缺氧条件下PBS组HUVEC、缺氧条件下Exo组HUVEC和缺氧条件下miRNA-132 Exo组HUVEC中的RASA1表达量,qPCR试剂盒购自日本TaKaRa公司,RASA1抗体购自英国Abcam公司(稀释比例为1∶1 000)。
1.9 统计学处理数据均采用GraphPad Prism 8软件进行分析。所有实验均重复3次,符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用最小显著性差异法。检验水准(α)为0.05。
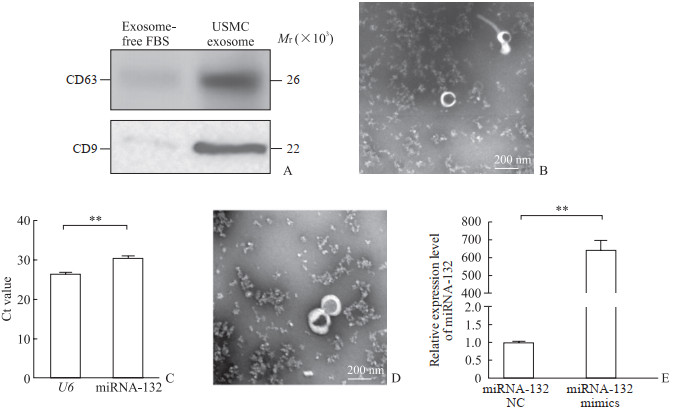
2 结果 2.1 电转法提高外泌体中miRNA-132的表达利用蛋白质印迹法和透射电子显微镜对外泌体进行鉴定。如图 1A所示,超速离心基本将FBS中的外泌体成分去除;相比之下UMSC外泌体样本中CD63和CD9高表达,符合外泌体表面标志物特征。如图 1B所示,透射电子显微镜图像中可以观察到亮圆小泡,呈杯状结构,直径约为100 nm,符合外泌体形态学特征。对UMSC外泌体中miRNA-132的表达量进行半定量检测,结果(图 1C)显示内参基因U6的循环阈值(cycle threshold,Ct)约为26.41±0.26,而miRNA-132约为30.48±0.30,证明miRNA-132在UMSC外泌体中表达量较低。电转实验并未影响外泌体的形态特征(图 1D),但电转miRNA-132 mimics组的miRNA-132表达量为电转miRNA-132 NC组的(647.21±66.29)倍(图 1E),证明电转实验成功。
|
图 1 UMSC来源外泌体的鉴定及miRNA-132电转实验结果 Fig 1 Identification of UMSC-derived exosomes and results of miRNA-132 electroporation A: The presence of exosomal specific markers CD63 and CD9 were confirmed by Western blotting; B: Representative transmission electron microscopic image of exosomes; C: The expression level of miRNA-132 in exosomes was detected by quantitative polymerase chain reaction; D: Representative transmission electron microscopic image of exosomes after electroporation; E: miRNA-132 expression level was increased significantly after electroporation detected by quantitative polymerase chain reaction. **P < 0.01. n=3, x±s. UMSC: Umbilical cord mesenchymal stem cell; miRNA: MicroRNA; FBS: Fetal bovine serum; Ct: Cycle threshold; NC: Negative control. |
2.2 miRNA-132 Exo在缺氧环境下提高HUVEC的增殖能力
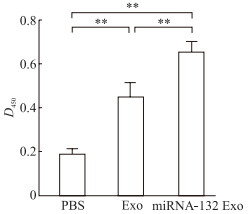
CCK-8法检测结果(图 2)显示,在缺氧环境下,PBS组HUVEC增殖能力有限,D450较低;Exo组和miRNA-132 Exo组HUVEC的D450均高于PBS组(P均<0.01),并且miRNA-132 Exo组高于Exo组(P<0.01)。该结果表明无论是否装载miRNA-132,UMSC来源外泌体均可提高HUVEC在缺氧环境下的增殖能力,并且装载miRNA-132后其促增殖能力更强。
|
图 2 CCK-8法检测各组HUVEC的增殖能力 Fig 2 Proliferation ability of HUVEC in each group detected by CCK-8 **P < 0.01. n=3, x±s. CCK-8: Cell counting kit 8; HUVEC: Human umbilical vein endothelial cell; PBS: Phosphate buffered saline; Exo: Control exosomes; miRNA-132 Exo: miRNA-132-loaded exosomes; miRNA: MicroRNA. |
2.3 miRNA-132 Exo在缺氧环境下提高HUVEC的成管能力
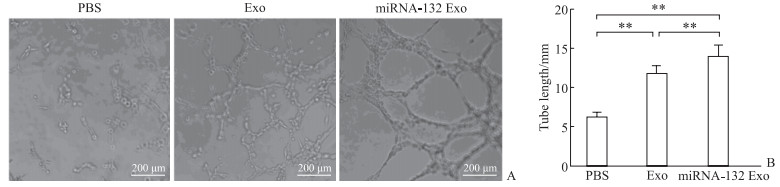
管样形成实验结果(图 3)显示,在缺氧环境下,PBS组HUVEC成管能力有限,形成的管样结构长度为(6.33±0.59)mm;Exo组和miRNA-132 Exo组HUVEC形成的管样结构长度分别为(11.97±0.83)和(14.20±1.25)mm,均高于PBS组(P均<0.01),并且miRNA-132 Exo组高于Exo组(P<0.01)。该结果表明无论是否装载miRNA-132,UMSC来源外泌体均可提高HUVEC在缺氧环境下的成管能力,并且装载miRNA-132后其促成管能力更强。
|
图 3 管样形成实验检测各组HUVEC的成管能力 Fig 3 Angiogenic ability of HUVEC in each group detected by tube formation assay A: Representative figures of tube structures of each group; B: Tube length was calculated by ImageJ software. **P < 0.01. n=3, x±s. HUVEC: Human umbilical vein endothelial cell; PBS: Phosphate buffered saline; Exo: Control exosomes; miRNA-132 Exo: miRNA-132-loaded exosomes; miRNA: MicroRNA. |
2.4 miRNA-132 Exo在缺氧环境下提高HUVEC的迁移能力
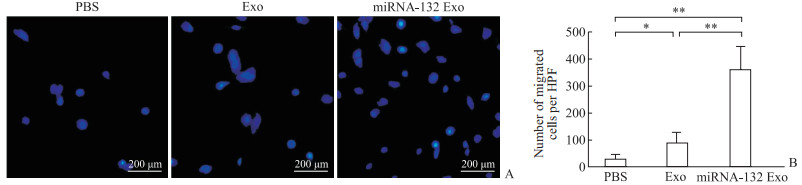
Transwell迁移实验结果(图 4)显示,在缺氧环境下,PBS组HUVEC迁移能力较低,迁移过膜的细胞个数为29.82±17.06;Exo组和miRNA-132 Exo组HUVEC迁移过膜的细胞个数分别为91.27±38.25和364.97±84.17,均高于PBS组(P<0.05,P<0.01),并且miRNA-132 Exo组高于Exo组(P<0.01)。该结果表明无论是否装载miRNA-132,UMSC来源外泌体均可提高HUVEC在缺氧环境下的迁移能力,并且装载miRNA-132后其促迁移能力更强。
|
图 4 Transwell迁移实验检测各组HUVEC的迁移能力 Fig 4 Migration ability of HUVEC in each group detected by Transwell migration assay A: Representative figures of migrated cells of each group; B: Migrated cells were counted. *P < 0.05, **P < 0.01. n=3, x±s. HUVEC: Human umbilical vein endothelial cell; PBS: Phosphate buffered saline; Exo: Control exosomes; miRNA-132 Exo: miRNA-132-loaded exosomes; miRNA: MicroRNA; HPF: High power field. |
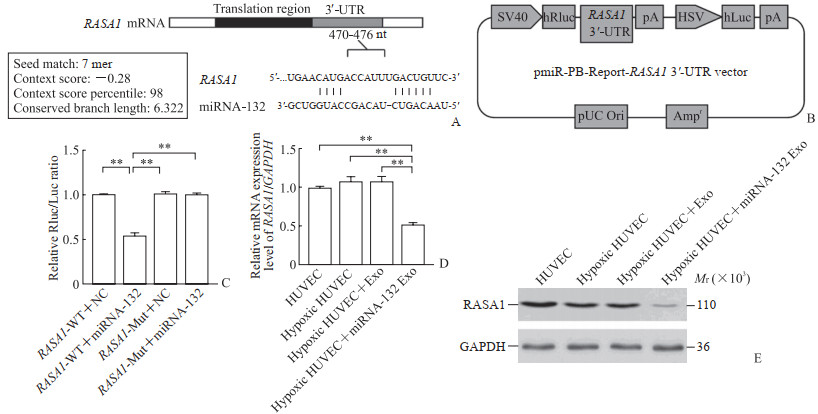
2.5 miRNA-132通过结合RASA1的3'-UTR抑制其表达
利用TargetScan数据库对miRNA-132可能的靶点进行预测,经过筛选发现RASA1的表达可以抑制血管新生,其与miRNA-132的结合位点见图 5A,构建的双萤光素酶报告质粒结构见图 5B。双萤光素酶报告基因实验结果(图 5C)显示,RASA1是miRNA-132的调控靶点。qPCR和蛋白质印迹法结果(图 5D、5E)均显示,单纯缺氧处理和在缺氧条件下加Exo处理均不会改变HUVEC中RASA1的表达量,而在缺氧条件下加miRNA-132 Exo处理则会抑制HUVEC中RASA1的表达,进一步证实RASA1为miRNA-132的靶点。
|
图 5 miRNA-132下游基因预测与验证 Fig 5 Prediction and validation of miRNA-132 downstream genes A: Binding motif of miRNA-132 with RASA1 3'-UTR was predicted by TargetScan database; B: Construction of luciferase reporter plasmid; C: Relative Rluc/Luc ratio; D: RASA1 mRNA expression in HUVECs in each group was detected by quantitative polymerase chain reaction; E: RASA1 protein expression of HUVECs in each group was detected by Western blotting. **P < 0.01. n=3, x±s. miRNA: MicroRNA; RASA1: Ras p21 protein activator 1; UTR: Untranslated region; SV40: Simian virus 40; hRluc: Human renilla luciferase; pA: Polyadenylation; HSV: Herpes simplex virus; hLuc: Human firefly luciferase; pUC Ori: Plasmid UC origin of replication; Ampr: Ampicillin resistant gene; Rluc: Renilla luciferase; Luc: Firefly luciferase; WT: Wild type; NC: Negative control; Mut: Mutant type; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; HUVEC: Human umbilical vein endothelial cell; Exo: Control exosomes; miRNA-132 Exo: miRNA-132-loaded exosomes. |
3 讨论
缺血性心脏病是造成全球人口死亡的主要原因之一,其中因动脉粥样硬化引起的急性心肌梗死是造成缺血性心脏病的主要因素[9]。近年来,我国心肌梗死发病率和死亡率逐年升高,已严重威胁我国人民的身体健康[10]。现阶段临床上常用的心肌梗死治疗措施主要包括药物治疗、介入治疗(经皮冠状动脉介入术)、手术治疗(冠状动脉旁路移植术)[11-12],这些治疗手段的出现降低了患者的死亡率,改善了患者预后,但其无法逆转缺氧、缺血造成的心脏组织损伤,更无法再生梗死的心脏组织[13]。心肌梗死后由于缺血、缺氧,心肌细胞和内皮细胞大量死亡,凋亡坏死的细胞释放大量氧自由基,恶化微循环内环境并进一步损伤内皮细胞,形成恶性循环。如何保证心脏微循环、改善缺血微环境、提高内皮细胞抗损伤能力,是治疗心肌梗死、延缓疾病发展、提高患者生存率的关键[14]。
随着干细胞治疗研究的不断深入,间充质干细胞得益于其免疫调节功能、抗炎作用和强大的旁分泌功能,在组织损伤修复中得到了关注。间充质干细胞是一类有多项分化能力的成体干细胞,分布广泛,存在于人体多种组织中。间充质干细胞可以提高心肌梗死后梗死周边区的新生血管密度、抑制心肌梗死纤维化、减少心肌梗死区炎症细胞浸润,从而改善心功能、延缓心室重构[15]。间充质干细胞对心肌梗死的治疗作用并非依赖于其分化能力,而是通过旁分泌机制动员、激活内源性内皮细胞和心肌细胞参与组织修复。随着研究重点逐渐转向旁分泌功能,有学者发现干细胞通过分泌抗凋亡因子、促血管生成因子、mRNA、miRNA和外泌体发挥治疗作用[13]。
Teng等[16]首次将间充质干细胞外泌体应用于心肌梗死组织的修复中,发现其促进血管新生、保护心功能的能力和直接注射干细胞并无明显差异。这一研究结果提示外泌体是间充质干细胞旁分泌中的主要活性物质,是间充质干细胞发挥功能的关键角色。外泌体是绝大多数真核细胞均可分泌的囊性小泡,是脂质、蛋白质、mRNA、miRNA和长链非编码RNA等众多信号分子的天然载体,介导细胞之间的信息交流,在肿瘤、自身免疫性疾病、感染和心血管疾病的生理和病理过程中起重要作用[17]。
miRNA是小调节RNA中数量最多的一组,主要通过结合mRNA的3'-UTR抑制mRNA的转录,从而调控基因的表达[18]。miRNA在调节心脏功能中发挥重要作用。一项研究表明,miRNA-150参与血管生成和缺血诱导的新生血管形成,miRNA-150过表达通过抑制Src激酶信号抑制因子1(Src kinase signaling inhibitor 1,SRCIN1)的表达解除SRCIN1对Src激酶的抑制作用,由于Src激酶是血管内皮生长因子合成所必需的激酶,故miRNA-150的过表达促进了血管新生[19]。另一项研究发现miRNA-497通过靶向调节抗凋亡基因Bcl-2降低miRNA-497的表达,从而减轻新生小鼠心脏缺血再灌注损伤[20]。miRNA还可介导器官间交流,如Cheng等[5]发现心肌梗死后外周循环血中外泌体成分发生改变,miRNA-1、miRNA-208、miRNA-499的表达量升高,这些外泌体携带的miRNA将信号传递至骨髓细胞中,动员骨髓中干细胞、祖细胞迁移至心肌梗死区修复组织损伤。
已有研究表明miRNA-132对内皮细胞具有保护作用[6-8],但其对缺氧环境中内皮细胞的保护功能及机制尚不清楚。本研究试图阐述miRNA-132和外泌体对缺氧环境下内皮细胞的保护作用。我们将miRNA-132装载在人UMSC来源外泌体中,在缺氧诱导损伤HUVEC模型的同时将外泌体与细胞共培养,通过细胞增殖实验、管样形成实验和Transwell迁移实验探究装载miRNA-132的外泌体对内皮细胞的保护作用。研究结果显示,UMSC来源外泌体可保护HUVEC抵抗缺氧损伤,而装载miRNA-132的外泌体具有更强的保护作用。Ma等[21]研究发现,在裸鼠皮下注射经miRNA-132外泌体预处理的HUVEC可提高其体内血管生成能力,在小鼠缺血心脏中移植miRNA-132外泌体可增强梗死周围区的血管新生并保留心脏功能,本研究结果与之一致。此外,本研究还通过TargetScan数据库预测并利用双萤光素酶报告基因实验证实了RASA1为miRNA-132的下游靶基因。RASA1是内皮细胞分泌Ⅳ型胶原并使其沉积在血管基膜所必需的因子,在内皮细胞发育成血管的过程中至关重要[22]。Liu等[23]研究发现RASA1的参与是miRNA-223增强心肌成纤维细胞增殖、迁移和分化从而介导心肌梗死后心肌纤维化的重要机制之一。本研究中qPCR和蛋白质印迹法结果显示,在缺氧条件下装载miRNA-132的外泌体能抑制HUVEC中RASA1的表达,提示miRNA-132可能通过抑制RASA1的表达发挥内皮细胞保护作用。
综上所述,本研究结果显示无论是否装载miRNA-132,间充质干细胞来源的外泌体均可在缺氧环境中保护HUVEC的增殖能力、成管能力和迁移能力,miRNA-132可能通过抑制RASA1的表达增强了这种保护作用,这为缺血性心脏病的治疗提供了新的思路。
| [1] |
MA T, SUN J C, ZHAO Z N, LEI W, CHEN Y Q, WANG X, et al. A brief review: adipose-derived stem cells and their therapeutic potential in cardiovascular diseases[J/OL]. Stem Cell Res Ther, 2017, 8: 124. DOI: 10.1186/s13287-017-0585-3.
|
| [2] |
WANG X, CHEN Y H, ZHAO Z N, MENG Q Y, YU Y, SUN J C, et al. Engineered exosomes with ischemic myocardium-targeting peptide for targeted therapy in myocardial infarction[J/OL]. J Am Heart Assoc, 2018, 7: e008737. DOI: 10.1161/JAHA.118.008737.
|
| [3] |
KHAN M, NICKOLOFF E, ABRAMOVA T, JOHNSON J, VERMA S K, KRISHNAMURTHY P, et al. Embryonic stem cell-derived exosomes promote endogenous repair mechanisms and enhance cardiac function following myocardial infarction[J]. Circ Res, 2015, 117: 52-64. DOI:10.1161/CIRCRESAHA.117.305990 |
| [4] |
SAHOO S, LOSORDO D W. Exosomes and cardiac repair after myocardial infarction[J]. Circ Res, 2014, 114: 333-344. DOI:10.1161/CIRCRESAHA.114.300639 |
| [5] |
CHENG M, YANG J J, ZHAO X Q, ZHANG E, ZENG Q T, YU Y, et al. Circulating myocardial microRNAs from infarcted hearts are carried in exosomes and mobilise bone marrow progenitor cells[J/OL]. Nat Commun, 2019, 10: 959. DOI: 10.1038/s41467-019-08895-7.
|
| [6] |
ANAND S, MAJETI B K, ACEVEDO L M, MURPHY E A, MUKTHAVARAM R, SCHEPPKE L, et al. microRNA-132-mediated loss of p120RasGAP activates the endothelium to facilitate pathological angiogenesis[J]. Nat Med, 2010, 16: 909-914. DOI:10.1038/nm.2186 |
| [7] |
LI X, LI D Q, WIKSTROM J D, PIVARCSI A, SONKOLY E, STÅHLE M, et al. MicroRNA-132 promotes fibroblast migration via regulating RAS p21 protein activator 1 in skin wound healing[J/OL]. Sci Rep, 2017, 7: 7797. DOI: 10.1038/s41598-017-07513-0.
|
| [8] |
WANG X L, WANG H C, CAO J L, YE C. Exosomes from adipose-derived stem cells promotes VEGF-C-dependent lymphangiogenesis by regulating miRNA-132/TGF-β pathway[J]. Cell Physiol Biochem, 2018, 49: 160-171. DOI:10.1159/000492851 |
| [9] |
BENTZON J F, OTSUKA F, VIRMANI R, FALK E. Mechanisms of plaque formation and rupture[J]. Circ Res, 2014, 114: 1852-1866. DOI:10.1161/CIRCRESAHA.114.302721 |
| [10] |
YANG X Y, HE T M, HAN S J, ZHANG X Y, SUN Y, XING Y W, et al. The role of traditional Chinese medicine in the regulation of oxidative stress in treating coronary heart disease[J/OL]. Oxid Med Cell Longev, 2019, 2019: 3231424. DOI: 10.1155/2019/3231424.
|
| [11] |
贾斯达, 姚懿, 何晨, 唐晓芳, 宋莹, 许晶晶, 等. 束支传导阻滞对冠状动脉介入治疗后急性冠状动脉综合征患者长期预后影响的研究[J]. 中国循环杂志, 2018, 33: 129-133. DOI:10.3969/j.issn.1000-3614.2018.02.006 |
| [12] |
贾斯达, 姚懿, 何晨, 唐晓芳, 宋莹, 许晶晶, 等. 束支阻滞对急性冠状动脉综合征患者临床预后影响的研究[J]. 中国循环杂志, 2017, 32(z1): 105. |
| [13] |
CAHILL T J, CHOUDHURY R P, RILEY P R. Heart regeneration and repair after myocardial infarction: translational opportunities for novel therapeutics[J]. Nat Rev Drug Discov, 2017, 16: 699-717. DOI:10.1038/nrd.2017.106 |
| [14] |
FRANGOGIANNIS N G. Pathophysiology of myocardial infarction[J]. Compr Physiol, 2015, 5: 1841-1875. |
| [15] |
MIAO C, LEI M M, HU W N, HAN S, WANG Q. A brief review: the therapeutic potential of bone marrow mesenchymal stem cells in myocardial infarction[J/OL]. Stem Cell Res Ther, 2017, 8: 242. DOI: 10.1186/s13287-017-0697-9.
|
| [16] |
TENG X M, CHEN L, CHEN W Q, YANG J J, YANG Z Y, SHEN Z Y. Mesenchymal stem cell-derived exosomes improve the microenvironment of infarcted myocardium contributing to angiogenesis and anti-inflammation[J]. Cell Physiol Biochem, 2015, 37: 2415-2424. DOI:10.1159/000438594 |
| [17] |
HESSVIK N P, LLORENTE A. Current knowledge on exosome biogenesis and release[J]. Cell Mol Life Sci, 2018, 75: 193-208. DOI:10.1007/s00018-017-2595-9 |
| [18] |
MOHR A M, MOTT J L. Overview of microRNA biology[J]. Semin Liver Dis, 2015, 35: 3-11. DOI:10.1055/s-0034-1397344 |
| [19] |
ZHU J M, HAN S C. miR-150-5p promotes the proliferation and epithelial-mesenchymal transition of cervical carcinoma cells via targeting SRCIN1[J]. Pathol Res Pract, 2019, 215: 738-747. DOI:10.1016/j.prp.2019.01.004 |
| [20] |
QIN L, YANG W, WANG Y X, WANG Z J, LI C C, LI M, et al. MicroRNA-497 promotes proliferation and inhibits apoptosis of cardiomyocytes through the downregulation of Mfn2 in a mouse model of myocardial ischemia-reperfusion injury[J]. Biomed Pharmacother, 2018, 105: 103-114. DOI:10.1016/j.biopha.2018.04.181 |
| [21] |
MA T, CHEN Y Q, CHEN Y H, MENG Q Y, SUN J C, SHAO L B, et al. MicroRNA-132, delivered by mesenchymal stem cell-derived exosomes, promote angiogenesis in myocardial infarction[J/OL]. Stem Cells Int, 2018, 2018: 3290372. DOI: 10.1155/2018/3290372.
|
| [22] |
CHEN D, TENG J M, NORTH P E, LAPINSKI P E, KING P D. RASA1-dependent cellular export of collagen Ⅳ controls blood and lymphatic vascular development[J]. J Clin Invest, 2019, 129: 3545-3561. DOI:10.1172/JCI124917 |
| [23] |
LIU X X, XU Y F, DENG Y F, LI H L. MicroRNA-223 regulates cardiac fibrosis after myocardial infarction by targeting RASA1[J]. Cell Physiol Biochem, 2018, 46: 1439-1454. DOI:10.1159/000489185 |
 2022, Vol. 43
2022, Vol. 43


